В последние годы установлена высокая встречаемость (до 74 % случаев) иммобилизационного остеопороза (ИОП), сопутствующего несращениям костей, развивающегося вследствие длительного дефицита весовой и динамической нагрузок поврежденной конечности после травмы [2, 4, 5]. Наличие ИОП сопровождается значительными техническими трудностями при операциях, в том числе и при чрескостном остеосинтезе (ЧО) [3, 4], который активно используется для лечения данной категории пациентов. Однако при ЧО часто отмечают резорбцию кости в зоне контакта её с имплантатом, что отрицательно влияет на остеогенез [1, 10]. В настоящее время практически отсутствует достоверная информация о степени выраженности резорбтивных процессов остеопоротически перестроенной костной ткани в зоне её контакта с металлофиксаторами, что свидетельствует об актуальности данного исследования.
Цель исследования – изучить в эксперименте морфоструктурные особенности ответной реакции здоровой кости и остеопоротически перестроенной костной ткани на введение металлофиксаторов.
Материалы и методы исследования
В исследовании были использованы 80 самцов крыс Вистар в возрасте 3–4 месяцев, массой 100–140 г. Исследования проводились согласно «Правилам проведения работы с использованием экспериментальных животных» (приложение по приказу МЗ СССР № 755) и Европейской Конвенции защиты животных, принятой в 1986 году в Страсбурге. Животные были разделены на две серии по 40 особей в каждой. Оперативное вмешательство выполнялось под внутримышечным наркозом. Животным второй серии предварительно моделировали иммобилизационный остеопороз путем ампутации 1/3 голени одной из задних конечностей. Крысы с ампутированной конечностью культю голени не нагружали. Крысам обеих серий выполнялась имплантация стандартных спиц из медицинской стали d = 0,8 мм в область дистального метафиза бедренной и проксимального метафиза большеберцовой костей. Сроки наблюдения в обеих группах составили: 7, 14, 30, 90, 120 дней после операции. У животных обеих серий не было выявлено клинических признаков воспаления в области доступа, заживление проходило первичным натяжением. Выведение из эксперимента проводилось согласно Международным правилам гуманного отношения к животным.
Экспериментальный материал представлял собой фрагменты метафизов бедренных и большеберцовых костей крыс, из которых после фиксации в 10 % растворе формалина, декальцинации в 7 % растворе азотной кислоты и Biodec R вырезали костные блоки, обезвоживали их в спиртах восходящей концентрации, заливали в парафин. Гистологические препараты окрашивали гематоксилин-эозином по Ван-Гизону. Изучение морфологического материала выполняли с использованием микроскопа Olimpus (Япония). Ввод изображений производили на цифровом модуле визуализации и документирования VIDI–CAM (Россия, СПб) при увеличении 40. Для анализа оцифрованных изображений использовали программное обеспечение «Видео – Тест Мастер – Морфология 5.2» (Россия, СПб.). Различия сравниваемых показателей считали достоверными при p ≤ 0,05.
Результаты исследования и их обсуждение
Результаты экспериментального морфологического исследования показали, что в обеих сериях опытных животных через 7 дней после введения спиц на стенках спицевого канала определялись участки грануляционной ткани с наличием большого количества кровеносных сосудов, скопления макрофагов и фибробластов. В участках введения спиц в корковую пластинку как у здоровых животных, так и у крыс с остеопорозом отмечалась слабая периостальная реакция в виде сети костных трабекул разной степени зрелости. У животных второй серии костная ткань вокруг спицевого канала была разрежена за счет увеличения диаметров гаверсовых каналов, в губчатой костной ткани отмечались истонченные трабекулы, за счет пазушной и остеокластической резорбции были расширены межтрабекулярные пространства.
Диаметр спицевого канала в этот срок во второй серии был достоверно больше, чем в первой, разница в его величине между сериями составила 0,072 мкм (рис. 1).
Через 14 дней после имплантации спиц у всех животных сохранялась слабо выраженная периостальная реакция вокруг них. В обеих сериях к стенкам спицевого канала на отдельных участках прилежала капсула, сформированная из коллагеновых волокон различной степени зрелости (рис. 2).
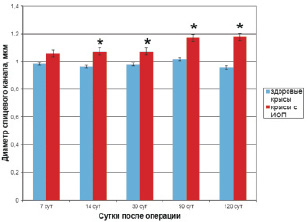
Рис. 1. Динамика изменений диаметра спицевого канала (мкм) у здоровых животных и животных с остеопорозом: * – р ≤ 0,05
У животных с иммобилизационным остеопорозом фиброзная капсула была толще, чем у крыс 1 серии. В костной ткани, прилегающей к каналу, было отмечено увеличение количества истонченных трабекул, широких межтрабекулярных пространств, а также появление очагов дистрофических и склеротических изменений костной ткани на отдельных участках спицевого канала. В этот срок диаметр спицевого канала второй серии был на 0,108 мкм больше, чем в первой (р ≤ 0,05).
Через 30 дней после операции в спицевых каналах обеих серий определялась утолщенная фиброзная капсула, но во второй она занимала большую площадь и протяженность. В прилежащей к спицевому каналу костной ткани сохранялись дистрофические и очаговые склеротические изменения. Во второй серии опытов эти явления носили более распространенный характер на фоне истонченных, атрофических трабекул, характерных для остеопороза. Широкие межтрабекулярные пространства были заполнены жировым и миелоидным костным мозгом, причем у животных с остеопорозом было выявлено преобладание жирового костного мозга. Диаметр спицевого канала, как и в предыдущие сроки наблюдения у животных второй серии был достоверно больше, чем в первой (рис. 1).
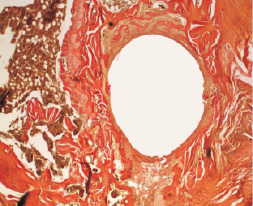
Рис. 2. 14 дней опыта. 1 серия. Фиброзная капсула в спицевом канале. Ван-Гизон. Увеличение ×40
Через 90 дней наблюдения фиброзная капсула, расположенная на стенках спицевого канала, была представлена круглыми фрагментами, между которыми отмечены участки вновь сформированной незрелой костной ткани с истонченными костными трабекулами и расширенными межтрабекулярными пространствами. Фиброзная ткань капсулы была представлена упорядоченными зрелыми коллагеновыми волокнами.
Через 120 дней на стенках спицевого канала отмечались отдельные фрагменты уплотненной фиброзной капсулы, преимущественно у животных второй серии. На остальной протяженности стенка спицевого канала была представлена костной тканью компактного строения (рис. 3).
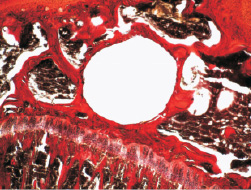
Рис. 3. 120 дней опыта. Компактная костная ткань на стенке спицевого канала. В прилежащей губчатой кости определяется жировой и миелоидный костный мозг. Ван-Гизон. Увеличение ×40
К завершению опытов (120 дней) у животных 2 серии в окружающей спицевой канал костной ткани сохранялись распространенные явления остеопороза. Диаметр спицевого канала во второй серии был на 0,083 мкм больше, чем в первой (р ≤ 0,05). В обеих сериях эксперимента в этот срок в губчатой костной ткани, прилежащей к спицевому каналу, определялись дистрофические изменения, а очаги склероза были увеличенными по площади относительно предыдущего срока наблюдения. Следует также отметить, что у животных обеих серий на протяжении всего периода наблюдения не были выявлены инфильтраты, гигантские клетки.
При морфологическом исследовании ткани, расположенной на стенках спицевого канала, в обеих сериях эксперимента было отмечено образование фиброзной капсулы, что, по мнению В.В. Серова и В.С. Паукова [9], является результатом преобразования грануляционной ткани, которую создает организм в условиях патологии. Формирование фиброзной капсулы постулируется многими авторами как закономерная реакция организма на внедрение любого инородного тела или материала [6, 7, 8]. Наблюдавшаяся в обеих сериях опытов компактизация стенок спицевого канала является следствием репаративной реакции кости, возникающей на введение спицы, причем в метафизе эндостальная реакция всегда наблюдается именно в непосредственной близости к раневому каналу с формированием так называемого костного «чехла» [10].
Анализ динамики морфологических данных обеих серий опытов показал, что у животных с ИОП после имплантации спиц явления остеопороза нарастали: увеличилось число участков пазушной и остеокластической резорбции, истонченных костных трабекул, расширенных межтрабекулярных пространств. Увеличение диаметра спицевого канала при ИОП, по-видимому, связано с изменением структуры костной ткани и сниженной её прочностью при остеопорозе. Это подтверждается данными сравнительного исследования, которые показали, что во все сроки наблюдения у здоровых животных диаметр спицевого канала оставался без изменений.
Выводы
- Морфологические изменения, развивающиеся в зоне «кость – имплантат», в обеих сериях были однотипными и независимо от исходного состояния костной ткани характеризовались формированием фиброзной капсулы вокруг спицы, компактизацией стенки спицевого канала.
- В условиях остеопоротической перестройки костной ткани введение даже такого малоинвазивного металлического имплантата, как спица, активизирует выраженность резорбтивных процессов, что приводит к увеличению диаметра спицевого канала.
Рецензенты:
Волокитина Е.А., д.м.н., профессор кафедры ФПК и ПП, ГБОУ ВПО УГМУ Минздрава России, г. Екатеринбург;
Данилова И.Г., д.б.н., заведующая лабораторией морфологии и биохимии Института иммунологии и физиологии УрО РАН, г. Екатеринбург.
Работа поступила в редакцию 28.05.2014.



