Операции на полых органах пищеварительного тракта часто связаны с необходимостью восстановления его непрерывности путём наложения межорганных анастомозов. Большой интерес представляет методика формирования таких соустий при помощи имплантатов из нитинола, разработанная группой учёных из Томска под руководством профессоров Гюнтера В.Э. и Зиганьшина Р.В. [2, 5, 7]. Предложенная ими методика, предусматривающая использование устройства из биметаллического сплава (нитинола) с эффектом термомеханической памяти формы, на сегодняшний день может рассматриваться как одна из традиционных [14, 15]. Создание анастомозов с помощью подобного рода устройств обладает определёнными преимуществами перед лигатурными и механическими (скобочными) способами соединения стенок полых органов. В то же время результаты таких вмешательств на сегодняшний день пока ещё далеки от идеальных [3, 4], что говорит об актуальности исследований, направленных на усовершенствование данного метода.
Целью настоящего исследования явилось изучение морфологических процессов в области межкишечных анастомозов, сформированных при помощи модифицированного имплантата из нитинола.
Материал и методы исследования
Проведено экспериментальное исследование на взрослых беспородных собаках. Собака имеет схожее с человеком строение кишечника, в связи с чем и была выбрана для эксперимента [1, 6].
Исследование было одобрено этическим комитетом ГБОУ ВПО Тверской ГМА Минздрава России соответствующим протоколом. Все эксперименты на лабораторных животных были выполнены в соответствии с «Правилами проведения работ с использованием экспериментальных животных», утверждёнными приказом МЗ СССР № 755 от 12.08.1977 года и основываясь на положениях Хельсинской Декларации Всемирной Медицинской Ассоциации от 1964 года, дополненной в 1975, 1983, 1989 и 2000 годы [8, 9, 16]. Исследовательская работа проводилась на базе экспериментальной лаборатории и вивария Тверской государственной медицинской академии.
Все собаки ранее были вакцинированы от бешенства и дегельминтизированы. В опытах использовались животные массой 10–20 кг. Выбраковывались длинношёрстные особи, чрезмерно агрессивные, с кожными и другими заболеваниями, беременные, а также животные моложе 1 года и старше 6 лет. Возраст собак определялся по зубной таблице, предложенной Западнюк И.П. [8, 10, 11].
При проведении опытов использовано 30 особей животных. Они оперированы с соблюдением всех правил асептики и использованием комбинированной анестезии. Выполнялись операции на тонкой кишке с формированием межкишечных анастомозов по типу «бок в бок». Сформированные соустья разделены на 3 исследовательские группы (по 10 в каждой группе).
Группа I была представлена лигатурными анастомозами, наложенными при помощи хирургической шовной нити и кишечной иглы.
Группа II состояла из компрессионных анастомозов, сформированных традиционным имплантатом Зиганьшина – Гюнтера.
Группа III была представлена компрессионными анастомозами, сформированными при помощи модифицированного устройства с памятью формы – имплантата из нитинола, полученного методом термической обработки, с напылением ионов серебра и ципрофлоксацина.
Оценка результатов производилась на 1-е, 3-и, 7-е, 14-е, 21-е и 30-е сутки после хирургической операции. Сроки опытов определены исходя из известных на этот счёт данных литературы [2, 13, 15]. В работе использовались гистологический, гистохимический и морфометрический методы исследования с последующей фоторегистрацией.
Для решения поставленных задач участки тонкой кишки с анастомозом иссекали и фиксировали в 10 % растворе нейтрального формалина (рН 7,2) в течение 12–24 часов. Далее из зоны соустий вырезали по 4 участка, в результате чего в каждой экспериментальной группе получали по 40 препаратов (всего 120 препаратов). Затем вырезанные участки повторно фиксировали в 10 % нейтральном растворе формалина, после чего проводили их в изопропиловом спирте с добавлением спирта «IsoPrep» (абсолютизированный изопропанол в концентрации не ниже 99,7 % – Тритон Х 15 – октилфеноксиполиэтоксиэтанол) [2, 12, 13, 17] и заливали в гомогенизированную парафиновую среду «HISTOMIX», формируя блоки. Из парафиновых блоков изготавливали серийные гистотопографические препараты толщиной 5–6 мкм и окрашивали их гематоксилином и эозином. Кроме вышеуказанной методики применяли окраску по Ван Гизону и гистохимическую окраску по Вейгерту – Ван Гизону с помощью набора готовых красителей производства итальянской фирмы «Bio-Optica Milano SPA». Применение указанных гистологических окрасок относится к числу интегрированных методов выявления эластических волокон, коллагена и ядер клеток соединительной ткани [6, 15].
При изучении микроскопических препаратов оценивали динамику развития воспалительной реакции, формирования рубца в анастомозах и особенности репаративной регенерации компонентов слизистой оболочки и стенки тонкой кишки.
Микроскопическое исследование изменений в тканях, а также фоторегистрацию и морфометрические исследования проводили на едином аппаратном комплексе, который включал в себя: исследовательский тринокулярный микроскоп «Nikon Eclipse 50 i»; специализированную цифровую фотокамеру «Nikon DS – Fi 2»; персональный компьютер, работающий под управлением операционной системы «Windows 7»; специализированные морфометрические программы «NIS-Elements» и «Bio Vision Professional».
При морфометрическом исследовании гистологического материала в зоне анастомоза определяли: плотность воспалительного инфильтрата на 1-е, 7-е и 14-е сутки после хирургической операции путём подсчёта количества составляющих его клеток в 10 полях зрения при увеличении микроскопа 400 х и ширину формирующегося рубца в микрометрах [1, 10, 15].
Статистическая обработка признаков осуществлялась расчётом распределения признака М ± m, где М – средняя арифметическая и m – средняя ошибка средней арифметической анализируемых показателей. Качественные признаки представлялись в виде количественных показателей. Поскольку объём выборки соответствовал закону нормального распределения, согласно тесту Шапиро – Вилка, то для оценки одинакового признака в трёх независимых группах сначала использовался параметрический F – критерий Фишера [2, 5]. При этом если выявлялось различие между исследуемыми группами (отвергалась нулевая гипотеза), то дополнительно определялось, между какими именно попарными нормально распределёнными группами (I–II; I–III; II–III) есть достоверные статистически значимые различия при помощи параметрического t-критерия Стьюдента с поправкой Бонферрони [8]. Различия считались статистически значимыми при p < 0,01.
Результаты исследования и их обсуждение
1-е сутки после оперативного вмешательства
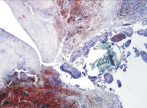
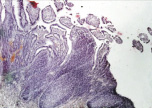
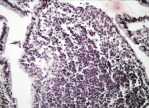
В группе I (лигатурный анастомоз) в зоне наложенного соустья со стороны кишечного края выявлялись отторжение слизистой оболочки и тканевой детрит, в ряде наблюдений отмечены обширные геморрагии при отсутствии плотного смыкания серозных оболочек (рис. 1, а). Наблюдалось выраженное демаркационное воспаление с инфильтрацией тканей нейтрофильными лейкоцитами, лимфоцитами и плазматическими клетками. В зоне воспаления имели место реактивные изменения в лимфоидных фолликулах слизистой оболочки кишки (рис. 1, б и в).
 а
а
 б
б
 в
в
 г
г
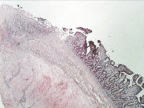 д
д
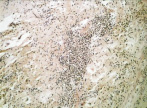 е
е
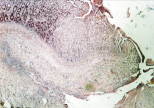
Рис. 1. 1-е сутки после операции: а – лигатурный анастомоз. Кишечный край. Отсутствие слизистой оболочки и тканевой детрит со стороны кишечного края. Неплотное смыкание со стороны серозной оболочки. Обширные геморрагии в стенке кишки. Окраска гематоксилином и эозином (увеличение 40 х); б – лигатурный анастомоз. Кишечный край. Зона демаркационного воспаления в строме слизистой оболочки. Окраска гематоксилином и эозином (увеличение 40 х); в – лигатурный анастомоз. Кишечный край. Реактивные изменения в лимфоидных фолликулах (деталь рис. 1 б). Окраска гематоксилином и эозином (увеличение 200 х); г – компрессионный анастомоз, сформированный имплантатом Зиганьшина – Гюнтера. Кишечный край. Отсутствие слизистой оболочки и тканевой детрит со стороны кишечного края. Наличие демаркационного воспаления. Окраска гематоксилином и эозином (увеличение 40 х); д – компрессионный анастомоз, сформированный имплантатом Зиганьшина – Гюнтера. Демаркационное воспаление в мышечном слое кишки. Окраска гематоксилином и эозином (увеличение 100 х); е – компрессионный анастомоз, сформированный новым имплантатом. Кишечный край. Отсутствие слизистой оболочки и умеренная демаркационная воспалительная инфильтрация. Окраска гематоксилином и эозином (увеличение 40 х)
В группе II (компрессионный анастомоз, сформированный с помощью имплантата Зиганьшина – Гюнтера) морфологическая картина области соустья существенных отличий от таковой при лигатурном анастомозе не имела. Со стороны кишечного края наблюдались отсутствие слизистой оболочки, тканевой детрит и выраженное демаркационное воспаление (рис. 1, г). Следует отметить, что воспалительный «лейкоцитарный вал» отмечался не только в строме слизистой, но и в мышечной оболочке (рис. 1, д).
В группе III (компрессионный анастомоз, сформированный с помощью нового имплантата) отмечено меньшее, чем в группе II, количество детрита при средней степени выраженности демаркационного воспаления (рис. 1, е).
3-е сутки после оперативного вмешательства
В группе I (лигатурный анастомоз) со стороны кишечного края соустья выявлялись массы тканевого детрита, демаркационное воспаление оставалось выраженным (рис. 2, а). Со стороны серозной оболочки тонкой кишки так же, как и на 1-е сутки, отмечались отсутствие плотного смыкания серозных оболочек, воспалительная инфильтрация, роста грануляционной ткани не отмечалось (рис. 2, б).
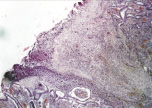 а
а
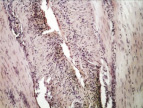 б
б
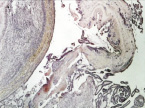 в
в
 г
г
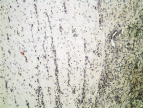 д
д
Рис. 2. 3-и сутки после операции: а – лигатурный анастомоз. Кишечный край. Тканевой детрит в зоне анастомоза. Сохраняется выраженная воспалительная реакция. Окраска гематоксилином и эозином (увеличение 40 х); б – лигатурный анастомоз. Край со стороны серозной оболочки тонкой кишки. Отсутствие плотного смыкания серозных оболочек тонкой кишки. Воспалительная инфильтрация. Окраска гематоксилином и эозином (увеличение 100 х); в – компрессионный анастомоз, сформированный имплантатом Зиганьшина – Гюнтера. Кишечный край. Некроз и отторжение слизистой оболочки. «Лейкоцитарный вал». Окраска гематоксилином и эозином (увеличение 40 х); г – компрессионный анастомоз, сформированный имплантатом Зиганьшина – Гюнтера. Дистрофические изменения гладкомышечных миоцитов кишечной стенки. «Лейкоцитарный вал». Окраска гематоксилином и эозином (увеличение 100 х); д – компрессионный анастомоз, сформированный новым имплантатом. Край со стороны серозной оболочки тонкой кишки. Начало образования грануляционной ткани. Ангиогенез, гистиоциты. Воспалительная инфильтрация слабо выражена. Окраска гематоксилином и эозином (увеличение 100 х)
В группе II (компрессионный анастомоз, сформированный с помощью имплантата Зиганьшина – Гюнтера) выявлялись некротические процессы со стороны кишечного края – некроз и отторжение слизистой оболочки, демаркационное воспаление в виде «лейкоцитарного вала» (рис. 2, в). В мышечном слое кишки выявлялись дистрофические изменения гладкомышечных миоцитов (рис. 2, г).
В группе III (компрессионный анастомоз, сформированный с помощью нового имплантата) отмечался активный ангиогенез и начало формирования грануляционной ткани, воспалительная инфильтрация была выражена слабее, чем в предыдущих наблюдениях (рис. 2, д).
7-е сутки после оперативного вмешательства
В группе I (лигатурный анастомоз) отмечалось начало регенерации эпителиального компонента слизистой оболочки тонкой кишки, тканевого детрита в зоне операционной раны не выявлялось, сохранялась умеренная воспалительная инфильтрация (рис. 3, а).
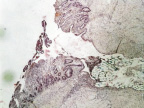 а
а
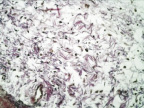 б
б
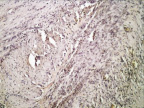 в
в
Рис. 3. 7-е сутки после операции: а – лигатурный анастомоз. Кишечный край. Регенерация эпителиального компонента слизистой оболочки тонкой кишки. Сохраняется умеренная воспалительная инфильтрация. Окраска гематоксилином и эозином (увеличение 40 х); б – компрессионный анастомоз, сформированный имплантатом Зиганьшина – Гюнтера. Край со стороны серозной оболочки тонкой кишки. Начало образования грануляционной ткани. Ангиогенез, гистиоциты. Воспалительная инфильтрация слабо выражена. Окраска гематоксилином и эозином (увеличение 100 х); в – компрессионный анастомоз, сформированный новым имплантатом. Образование эластических волокон в грануляционной ткани. Окраска по Вейгерту – Ван Гизону (увеличение 200 х)
В группе II (компрессионный анастомоз, сформированный с помощью имплантата Зиганьшина – Гюнтера), несмотря на достаточно выраженные некротические процессы на предыдущем сроке опыта, к 7-м суткам после операции отмечался активный ангиогенез и формирование грануляционной ткани со стороны серозной оболочки кишки (рис. 3, б).
В группе III (компрессионный анастомоз, сформированный с помощью нового имплантата) при окраске по Вейгерту – Ван Гизону выявлялось активное образование эластических волокон в грануляционной ткани на месте стыка серозных оболочек тонкой кишки (рис. 3, в).
14-е сутки после оперативного вмешательства
В группе I (лигатурный анастомоз) со стороны серозной оболочки тонкой кишки отмечался рост грануляционной ткани с началом дифференцировки её в соединительную, в отдельных наблюдениях выявлены геморрагии (рис. 4, а).
В группе II (компрессионный анастомоз, сформированный с помощью имплантата Зиганьшина – Гюнтера) со стороны серозной оболочки тонкой кишки формировался рубец с большим количеством «молодых» (рыхлых) коллагеновых волокон (рис. 4, б), что подтверждалось при окраске по Вейгерту – Ван Гизону (рис. 4, в).
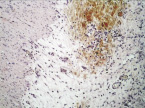 а
а
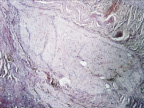 б
б
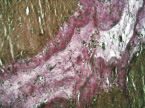 в
в
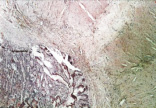 г
г
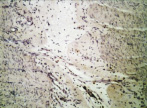 д
д
Рис. 4. 14-е сутки после операции: а – лигатурный анастомоз. Край со стороны серозной оболочки тонкой кишки. Начало дифференцировки грануляционной ткани в соединительную. Выявляется осложнение в виде геморрагии. Окраска гематоксилином и эозином (увеличение 100 х); б – компрессионный анастомоз, сформированный имплантатом Зиганьшина – Гюнтера. Край со стороны серозной оболочки тонкой кишки. «Молодая» (рыхлая) соединительная ткань. Окраска гематоксилином и эозином (увеличение 40 х); в – компрессионный анастомоз, сформированный имплантатом Зиганьшина – Гюнтера. «Молодая» (рыхлая) соединительная ткань. Окраска по Вейгерту – Ван Гизону (увеличение 40 х); г – компрессионный анастомоз, сформированный новым имплантатом. Кишечный край. Полная репаративная регенерация слизистой оболочки тонкой кишки. Окраска гематоксилином и эозином (увеличение 40 х); д – компрессионный анастомоз, сформированный новым имплантатом (14-е сутки). Край со стороны серозной оболочки кишки. Рубец с большим количеством рыхлых коллагеновых волокон. Окраска гематоксилином и эозином (увеличение 40 х)
В группе III (компрессионный анастомоз, сформированный с помощью нового имплантата) в ряде наблюдений уже к 14-м суткам после операции отмечалась полная репаративная регенерация слизистой оболочки кишки в зоне анастомоза (рис. 4, г), а со стороны стыка серозных оболочек кишки формировался рубец с большим количеством «молодых» (рыхлых) коллагеновых волокон (рис. 4, д).
21-е сутки после оперативного вмешательства
В группе I (лигатурный анастомоз) в ряде наблюдений полного заживления слизистой оболочки кишки не отмечалось, определялись признаки ее атрофии (рис. 5, а). При окраске по Вейгерту – Ван Гизону выявлено, что в новообразованной соединительной ткани сохраняется большое количество «молодых» (рыхлых) коллагеновых волокон (свидетельство неполного её созревания) (рис. 5, б).
В группе II (компрессионный анастомоз, сформированный с помощью имплантата Зиганьшина – Гюнтера) наблюдалось закрытие раневого дефекта слизистой оболочкой, однако в ряде наблюдений репарация последней была неполной (рис. 5, в). На месте соустья выявлялся рубец (рис. 5, г).
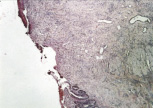 а
а
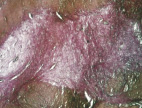 б
б
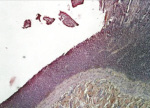 в
в
 г
г
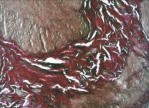 д
д
Рис. 5. 21-е сутки после операции: а – лигатурный анастомоз. Кишечный край. Атрофия слизистой оболочки кишки. В зоне анастомоза сохраняется дефект слизистой оболочки. Окраска гематоксилином и эозином (увеличение 40 х); б – лигатурный анастомоз. «Молодая» (рыхлая) соединительная ткань.
Окраска по Вейгерту – Ван Гизону (увеличение 40 х); в – компрессионный анастомоз, сформированный имплантатом Зиганьшина – Гюнтера. Кишечный край. Репаративная регенерация слизистой оболочки тонкой кишки неполная. Окраска гематоксилином и эозином (увеличение 40 х); г – компрессионный анастомоз, сформированный имплантатом Зиганьшина – Гюнтера. Рубец на месте соустья. Окраска по Вейгерту – Ван Гизону (увеличение 100 х); д – компрессионный анастомоз, сформированный новым имплантатом. Полноценный рубец в области соединения кишечных стенок. Окраска по Вейгерту – Ван Гизону (увеличение 100 х)
В группе III (компрессионный анастомоз, сформированный с помощью нового имплантата) в области соединения кишечных стенок определялся полноценный рубец (рис. 5, д).
30-е сутки после оперативного вмешательства
В группе I (лигатурный анастомоз) в зоне соустья отмечена полная репаративная регенерация кишечного эпителия и окончательная дифференцировка грубоволокнистой соединительной ткани (рис. 6, а и б),
тогда как в группе II и группе III аналогичные данные были получены уже к 21-м суткам после операции (см. выше).
Динамика плотности воспалительного инфильтрата (среднего числа его клеточных элементов в 10 полях зрения) в изученных межкишечных анастомозах представлена на гистограмме (рис. 7).
Ширина образующегося рубца и время его формирования при различных видах межкишечных анастомозов приведены в таблице.
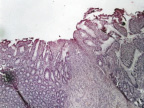 а
а
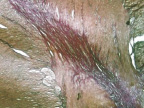 б
б
Рис. 6. 30-е сутки после операции: а – лигатурный анастомоз. Кишечный край. Полная репаративная регенерация слизистой оболочки тонкой кишки. Окраска гематоксилином и эозином (увеличение 40 х); б – лигатурный анастомоз. Сформированный рубец. Окраска по Вейгерту – Ван Гизону (увеличение 40 х)
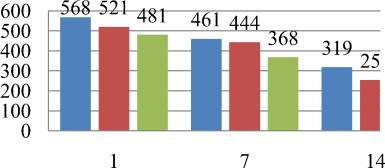
Рис. 7. Гистограмма. Динамика плотности воспалительного инфильтрата в области межкишечных анастомозов в 1-е, 7-е и 14-е сутки после операции
Ширина рубца на месте анастомоза и время его формирования
|
Вид межкишечного анастомоза |
Ширина сформированного рубца, мкм |
Время формирования |
|
Группа I |
1893 ± 75 |
30-е сутки после операции |
|
Группа II |
1381 ± 68 |
21-е сутки после операции |
|
Группа III |
1134 ± 54 |
21-е сутки после операции |
Проведённое морфологическое исследование показало, что применение методики создания компрессионного анастомоза с помощью имплантата с памятью формы имеет ряд преимуществ перед традиционной методикой. В компрессионных анастомозах, несмотря на то, что в срок до трёх суток после операции имеет место выраженная некротическая реакция, восстановление слизистой оболочки и образование полноценного рубца происходит быстрее. Если в группе I полное восстановление кишечного эпителия отмечалось только на 30-е сутки после операции, то в группах II и III это происходило уже к 21-м суткам, хотя в ряде наблюдений группы II (компрессионный анастомоз, наложенный с помощью имплантата Зиганьшина – Гюнтера) регенерация слизистой была неполной. На 21-е сутки после операции на месте компрессионных соустий формировался полноценный рубец. Морфометрические исследования (определение плотности воспалительного инфильтрата в области соустья и ширины формирующегося рубца) подтвердили более быстрое снижение воспалительной реакции тканей и меньшую толщину сформированного рубца в компрессионных анастомозах. Отмеченные положительные особенности хода репаративных процессов в наибольшей степени были выражены при использовании модифицированных имплантатов из нитинола.
Заключение
Проведённое исследование позволяет заключить, что применение нового имплантата приводит к снижению воспалительной реакции тканей и к ускорению восстановительных процессов в зоне наложенного с его помощью соустья. В связи с этим имеются все основания рекомендовать предлагаемое устройство к использованию в клинической практике.
Рецензенты:
Цай Г.Е., д.м.н., профессор кафедры топографической анатомии и оперативной хирургии, ГБОУ ВПО «Тверская ГМА» Минздрава России, г. Тверь;
Киселёв В.Я., д.м.н., профессор, заведующий кафедрой травматологии и ортопедии, ГБОУ ВПО «Тверская ГМА» Минздрава России, г. Тверь.
Работа поступила в редакцию 13.05.2014



