Катетер-ассоциированные инфекции составляют более 60 % госпитальных бактериемий в европейских странах и 11–37 % всех нозокомиальных инфекций [9, 13, 6]. Стафилококки являются ведущими возбудителями катетер-ассоциированных инфекций, из них превалируют коагулазонегативные стафилококки с преобладанием Staphylococcus epidermidis [12]. Имеется ряд доказательств наличия микробных биопленок стафилококка на установленных катетерах, причем не только в области просвета катетера, но и на внешней его стороне [7, 11].
Выраженная резистентность клеточных компонентов биопленок к антибиотикам требует поиска новых соединений, альтернативных широко используемым антибактериальным препаратам [3].
К стратегиям подавления образования биопленок можно отнести ингибирование первого этапа их формирования – бактериального прикрепления и колонизации имплантатов за счет использования биоматериалов, импрегнированных антимикробными агентами, среди которых в качестве перспективных рассматриваются низкомолекулярные катионные пептиды [8]. В этой связи особое внимание уделяется группе лантибиотиков – низкомолекулярных катионных пептидов, одним из ярких представителей которых является Низин [1].
В специальных экспериментах были получены первые результаты относительно ингибирующего действия низкомолекулярного катионного пептида Варнерина, синтезируемого бактериями Staphylococcus warneri KL-1. Подавляющий эффект пептида проявлялся как на стадии образования, так и на сформированных пленках при концентрациях, превышающих минимальную ингибирующую концентрацию для планктонной культуры [2].
При разработке методов предупреждения формирования и функционирования бактериальных пленок целесообразно использование экспериментальных моделей катетер-ассоциированных инфекций. Особенно важно проведение таких исследований на фоне подавления иммунных реакций организма, которое, в частности, может быть вызвано введением циклофосфамида, важнейшим эффектом которого является развитие нейтропении [10].
Патоморфологические исследования при моделировании катетер-ассоциированной инфекции для обоснования возможностей применения Варнерина не проводились и представляют большой интерес.
Целью настоящей работы стало применение низкомолекулярного катионного пептида варнерина на модели катетер-ассоциированной инфекции в условиях иммуносупрессии циклофосфамидом с последующей морфологической оценкой состояния тканей вокруг катетера.
Материалы и методы исследования
Исследования проводились на 60 белых беспородных мышах весом 25–30 грамм, разделенных на контрольную и опытную группы. Животным обеих групп под эфирным наркозом под кожу спины имплантировали фрагмент пластикового катетера длиной 0,5 см. Всем животным внутримышечно вводили циклофосфамид в дозе 200 мг/кг. На части фрагментов катетеров в течение двух суток перед имплантацией выращивали бактериальные пленки Staphylococcus epidermidis 33 [4]. В опытной группе использовали низкомолекулярный катионный пептид варнерин 54 серии с активностью 1/512 тысяч условных единиц [2]. В зависимости от предварительной обработки отрезков катетеров животные каждой группы были разделены на три подгруппы.
Первой подгруппе имплантировали стерильные катетеры, и в эту же область однократно вводили 1 мл варнерина. Второй подгруппе имплантировали катетеры с предварительно выращенными на них в течение двух суток биопленками, в эту же область ежесуточно вводили 1 мл варнерина. Третьей подгруппе вводили стерильные катетеры и затем в операционную рану после ее закрытия ежесуточно вводили 0,5 мл взвеси стафилококка в физиологическом растворе, содержащем 109 КОЕ/мл, после чего ежесуточно вводили 1 мл варнерина. Животные контрольной группы были разделены на аналогичные подгруппы, но без применения варнерина.
Животных всех групп выводили из эксперимента путем передозировки эфира в первые, вторые и третьи сутки, после чего для гистологического исследования забирали ткани вокруг катетера, которые фиксировали в 10 % растворе формалина. Обработку препаратов проводили по общепринятой методике и окрашивали гематоксилином и эозином, пикрофуксином по ван Гизону, по Броун-Хопсу.
Результаты исследования и их обсуждение
В первой подгруппе при имплантации стерильных катетеров и однократного введения 1 мл варнерина отмечалась последовательная смена фаз воспаления вокруг катетеров в течение трех суток. В первые сутки преобладающей была лейкоцитарная фаза, которая характеризовалась наличием фибринозно-лейкоцитарной инфильтрации. На вторые сутки в инфильтрате появлялись макрофаги в большом количестве, т.е. наступала макрофагальная фаза. На третьи сутки регистрировалось большое количество грануляционной ткани с наличием фибробластов и тонких коллагеновых волокон, т.е. наступала фибропластическая фаза. Данная картина и сроки смены фаз характерны для развития воспалительных реакций на инородное тело в коже у мышей [5]. При этом значимых отличий в клеточном составе и морфологии окружающих катетер тканей при введении варнерина не было выявлено (рис. 1).
Во второй подгруппе при имплантации катетеров с предварительно выращенными на них двухсуточными биопленками и ежесуточном введении варнерина в протекании фаз воспаления имелись следующие особенности. В первые сутки отмечался отек и повышенное кровенаполнение окружающих катетер тканей с выпадением фибрина. Инфильтрат был представлен макрофагами и лимфоцитами. На вторые стуки фибрин обнаруживался не только снаружи, но и в просвете катетера. Отмечалось очаговое скопление клеток – лимфоцитов, макрофагов, нейтрофилов с образованием «гнойных телец» и скоплений микроорганизмов. По периферии катетера обнаруживались единичные нейтрофилы, макрофаги, фибробласты (рис. 2).
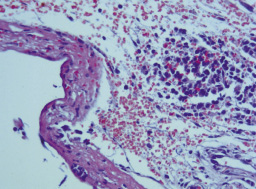
Рис. 1. Грануляционная ткань, слой фибрина и очаговая инфильтрация макрофагами, лимфоцитами и фибробластами вблизи имплантированного стерильного катетера после однократного введения 1 мл варнерина в окружающие ткани. Третьи сутки (Окраска гематоксилином и эозином, ×200)
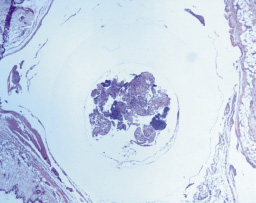
Рис. 2. Скопления микроорганизмов, фибрин внутри и вокруг катетера при имплантации катетеров с предварительно выращенными на них двухсуточными биопленками и ежесуточном введении 1 мл варнерина. Вторые сутки (Окраска гематоксилином и эозином, ×10)
На третьи сутки воспалительный инфильтрат был представлен единичными лимфоцитами, макрофагами, нейтрофилами, а фибробласты формировали ограничительный вал вокруг катетера.
По сравнению с аналогичной подгруппой без использования варнерина при его ежесуточном введении в область имплантации катетера с биопленками отмечается исчезновение скопления микроорганизмов и уменьшение объема воспалительного инфильтрата. Данная тенденция особенно выражена со вторых суток.
В третьей подгруппе с ежесуточным введением взвеси стафилококка в зону имплантации катетера и последующим ежесуточным введением 1 мл варнерина протекание фаз воспаления имело следующие особенности. Уже на первые сутки в лейкоцитарную фазу отмечалось скопление микроорганизмов на поверхности катетера, по периферии отмечалось формирование воспалительного инфильтрата из нейтрофилов, макрофагов и фибрина с формированием микроабсцесса. На вторые сутки морфологическая картина оставалась прежней с тенденцией к уменьшению объема скоплений микроорганизмов (рис. 3).
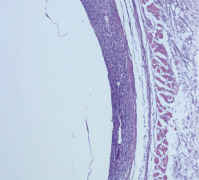
Рис. 3. Скопление микроорганизмов, фибрин и воспалительный инфильтрат из нейтрофилов и макрофагов при ежесуточном введении взвеси стафилококка в зону имплантации катетера и с последующим ежесуточным введением туда же 1 мл варнерина. Вторые сутки (Окраска гематоксилином и эозином, ×100)
На третьи сутки в инфильтрате появились фибробласты, синтезирующие коллаген, и обилие лимфоцитов. При этом объем воспалительного инфильтрата и скопления микроорганизмов уменьшались (рис. 4).
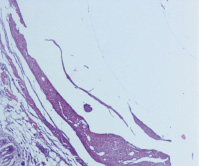
Рис. 4. Широкая зона фибрина, небольшие скопления микроорганизмов вокруг катетера при ежесуточном введении взвеси стафилококка в зону имплантации катетера и с последующим ежесуточным введением туда же 1 мл варнерина. Третья группа, третьи сутки (Окраска гематоксилином и эозином, ×100)
По сравнению с аналогичной подгруппой без использования варнерина при его ежесуточном введении в область имплантации катетера на фоне массивного бактериального обсеменения также отмечается тенденция к уменьшению объема воспалительного инфильтрата и скоплений микроорганизмов.
Выводы
- Введение в виде инъекции в зону имплантации стерильного катетера низкомолекулярного катионного пептида варнерина не оказывает влияния на клеточный состав инфильтрата вокруг катетера.
- Применение низкомолекулярного катионного пептида варнерина в виде инъекций при имплантации катетеров как с предварительно выращенными биопленками, так и при ежесуточном введении взвеси стафилококка в ткани, ведет к уменьшению и исчезновению скоплений микроорганизмов, а также к снижению выраженности воспалительной реакции.
Работа выполнена при финансовой поддержке РФФИ, грант 12-04-01431.
Рецензенты:
Лебединская О.В., д.м.н., профессор кафедры гистологии, эмбриологии и цитологии Пермской государственной медицинской академии им. ак. Е.А. Вагнера, г. Пермь;
Карпунина Т.И., д.м.н., профессор кафедры микробиологии Пермской государственной медицинской академии им. ак. Е.А. Вагнера, г. Пермь.
Работа поступила в редакцию 18.04.2014.



