В современном варианте Периодической системы элементов Менделеева (ПСЭ-М) все элементы расположены (упорядочены) по возрастанию их порядкового номера – Z, что подтверждается законом Г. Мозли, связавшим частоту характеристического рентгеновского излучения (ХРИ) нейтральных атомов элементов с их Z.
Сам Менделеев, основываясь на открытом им Периодическом законе, разделил эту последовательность на периоды (всего 7) (соответственно назвал свою систему периодической), а большие периоды, начиная с 4-го, еще и на гор. ряды (всего 10). Кроме того, элементы горизонтальных рядов разделены на 8 групп (вертикальные ряды таблицы). Таким образом, каждый элемент таблицы находится на пересечении горизонтального ряда и вертикального ряда, принадлежность к ним – это координаты элемента.
Номер периода и номер группы при этом имеют довольно формальный характер, без достаточно четкого критерия. Первый период из двух элементов не вписывается в 8-ми клеточную схему, к тому же он единственный остался непарным. Вообще не поместились в каноническую краткую форму таблицы (КФТ) лантаноиды и актиноиды, помещенные под таблицей. Имеются и некоторые другие слабые места современной ПСЭ, не случайно предпринимаются многочисленные попытки разработать более совершенную форму ПСЭ-М.
Далее представлены результаты работы автора, выполненной в период 1973 – 31.08.91. В основу своего варианта Периодической системы нейтральных атомов (далее ПСА) автор положил свободный (нейтральный) атом (для простоты в виде наиболее стабильного изотопа) и характеризующий его набор из 4-х квантовых чисел, полученных на основе изучения присущего ему уникального линейчатого оптического спектра (ЛОС). Квантовые числа конкретного атома не изменяются со временем и представляют собой параметры, определяющие его равновесное стабильное квантовое состояние. То есть автор использует чёткий и однозначный критерий.
Практически все, что мы знаем о нейтральном атоме, а именно они соединяются в молекулы и так далее, исходит из его уникальных спектров (ЛОС) и лишь небольшая часть данных происходит из химических свойств.
Имеет смысл строить периодическую систему именно нейтральных атомов (ПСА) в лице их наиболее устойчивых изотопов, ибо:
- целый ряд элементов представлен всего одним изотопом;
- элементы с нечетным порядковым номером Z имеют не более 2-х изотопов;
- имеется вполне определенная зависимость для изотопов относительно наиболее устойчивого изотопа (с минимальной внутренней энергией).
- нет необходимости отражать в самой таблице все конкретные характеристики всех изотопов элемента (их можно привести в справочнике или дать в виде гиперссылки на компьютере).
Начнем с уже хорошо известного и взглянем на школьную таблицу ПСЭ-М. Для каждого элемента таблицы в ней указана его электронная формула (например, для водорода – 1s1, что является формой записи того факта, что главное квантовое число n = 1, орбитальное квантовое число l = 0, и в электронной оболочке на этом квантовом энергетическом подуровне имеется один электрон).
В современной форме ПСЭ-М (краткая форма таблицы- КФТ) ячейка каждого элемента окрашена в один из четырех цветов в соответствии с конкретным значением орбитального квантового числа l и расположены они в виде групп последовательных элементов – это (перечислено в порядке появления):
1) s-элементы (l = 0) – это элементы I и II групп (щелочные и щелочноземельные элементы) (в 1,2,3,4,6,8 и 10 гор. рядах).
2) p-элементы (l = 1) – это элементы III-VIII групп (во 2,3,5 и 7 гор. рядах).
3) d-элементы (l = 2) - это элементы III-VIII групп (в 4,6,8 и 10 гор. рядах) и I и II групп (в 5, 7 и 9 гор. рядах), т.е. разорваны в 2 ряда.
4) f-элементы (l = 3) –– не уместились в таблице, расположены отдельно внизу (лантаноиды и актиноиды).
Всего 20 таких групп в пределах Z ≤ 120, причем в их числе имеется всего 4 типа l-групп.
Ёмкость такой l-группы определяется по формуле Е. Стонера Nl = 2(2l+1). Кратко эти группы охарактеризованы в табл 1.
Таблица 1. l-группы элементов ПСЭ в пределах Z ≤ 120
| l-группа | Емкость группы Nl= 2(2l+1) Формула Е.Стонера | Кол-во nl-групп в пределах Z ≤ 120 | Всего таких элементов | Сравнение с гор. рядом из 8 групп (Nl - 8) | Примечание |
| s-элементы (l = 0) | 2 | 8 | 2 х 8 =16 | - 6 | Объединены в КФТ в один гориз. ряд из 8 элементов |
| p-элементы (l = 1) | 6 | 6 | 6 х 6 =36 | - 2 | |
| d-элементы (l = 2) | 10 | 4 | 10 х 4=40 | + 2 | Два дополнит. элемента втиснуты в VIII группу |
| f-элементы (l = 3) | 14 | 2 | 14 х 2=28 | + 6 | Не уместились в КФТ и помещены под таблицей |
| Итого: 4 типа l-групп | = | 20 | 120 | - | - |
Изменение набора конкретных для данного элемента квантовых чисел вызывает изменение и суммарных квантовых чисел, записываемых обычно в виде т.н. спектрального терма 2S+1LJ,также определенного для каждого из известных элементов. См, например, Дж. Эмсли «Элементы», Москва, «Мир», 1993 [8].
Значение названных квантовых чисел до настоящего времени недостаточно осознано. Так, они не приведены для характеристики элементов даже в самых последних изданиях физической и химической энциклопедий. Зато щедро дополнены физическими и химическими свойствами простого вещества, очень важными для практики, но все же производными (вторичными).
Именно эти квантовые числа являются параметрами основного квантового состояния нейтрального атома в целом (не изменяются во времени) и однозначно определяются по результатам анализа спектров атома, которые строго индивидуальны для каждого конкретного атома, т.е. являются его визитной карточкой. Многие элементы и обнаружены по их спектрам. Осознание физического смысла квантовых чисел - путь к созданию теории атома (пока только модели), а теория атома и теория и форма представления ПСА - это как две стороны одной медали. Они параллельно развиваются и взаимно обогащают друг друга.
Согласно правилу Ф.Гунда в первой половине группы спиновое квантовое число ms = + ½ , а во второй - ms = - ½ . Магнитное квантовое число ml изменяется одинаково от - lmax до +lmax .
Порядок следования всех 20 nl-групп по возрастанию квантовых энергетических уровней (КВЭУ) определяется опять же из спектров свободных атомов. Номер такой группы Nnlопределяется по формуле R. Hakala (1948). [7]
Nnl = ![]() +
+ ![]() - l
- l
Эти nl-группы объединяются в более крупные (n+l)-группы последовательных атомов согласно правилам академика В.М. Клечковского (1900-72), см. табл. 2.
Таблица 2. (n+l)-периоды и их пары (диады) в пределах Z ≤ 120
| № диады M= lmax+1 | Состав диады (n+l)-группы (периоды) | Кол-во nl-групп в периоде | Состав (n+l)-группы | lmax = | Емкость (n+l)-периода Nn+l = 2M2 |
| 1 | 1-я и 2-я | 1 | s-элементы только | 0 | 2 |
| 2 | 3-я и 4-я | 2 | p-элементы, s-элементы | 1 | 8 |
| 3 | 5-я и 6-я | 3 | d-элементы, p-элементы, s-элементы | 2 | 18 |
| 4 | 7-я и 8-я | 4 | f-элементы, d-элементы, p-элементы, s-элементы | 3 | 32 |
|
|
| Итого: 10 х 2 = 20 |
|
|
|
Ёмкость (n+l)-периода Nn+l без всякой мистики получается сложением ёмкостей составляющих его l-групп
Nn+l =![]() =
= ![]() = 2(lmax+ 1)2 = 2M2 (см. табл. 2).
= 2(lmax+ 1)2 = 2M2 (см. табл. 2).
Начало (порядковый номер исходного элемента - ZM) каждой такой M-диады (пары периодов) можно получить из выполненного автором тождественного преобразования формулы В.М. Клечковского [3] для номера Zl элемента, при котором впервые появляется элемент с данным значением lmax
ZM = Zl –1 =![]() =
=![]() ;
;
тогда при lmax = 0; 1;2;3; 4… имеем ZM = 0; 4; 20; 56; 120 …, т.е. это так называемые тетраэдрические числа, что опосредованно связано с некими минимальными исходными для диады квантовыми энергетическими уровнями (тетраэдр имеет минимальную площадь поверхности при фиксированном объёме).
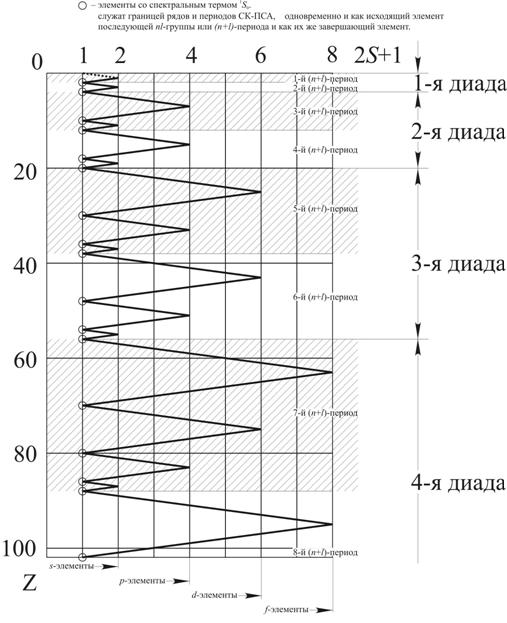
Рис. 1. Периодическая зависимость между порядковым номером Z и мультиплетностью (2S+1) основного терма нейтральных атомов [3] с разметкой на (n+1)-периоды и их диады
Особенно наглядным является график зависимости мультиплетности (2S+1) спектрального терма от Z (рис. 1), где предельно четко видны границы nl-групп, (n+l)-периодов и диад (пар периодов).
Используя отмеченные факты, автор и предложил новую форму графического изображения системы – «Cимметричную квантовую ПСА (СК-ПСА)», в которой:
1) период СК-ПСА представляет собой (n+l)-группу и все периоды, как и сами группы – парные. Каждая пара периодов составляет диаду. Всего в пределах Z ≤ 120 имеется 4 диады.
2) каждый горизонтальный ряд представляет собой одну из nl-групп (s-, p-, d-, f-элементов) с n = const. В качестве исходного атома слева к ряду присоединен последний элемент предыдущего горизонтального ряда. Каждый горизонтальный ряд начинается и кончается элементом со спектральным термом 1So (см. рис. 1).
3) Все горизонтальные ряды выстроены симметрично относительно центрального атома горизонтального ряда, завершающего первую половину l-группы.
4) На самом верху в таблицу включен свободный нейтрон, он же исходный элемент первого горизонтального ряда.
Тогда в предложенной автором форме таблицы набор из 4-х квантовых чисел становится координатами каждого конкретного атома:
1) Сумма (n + l) определяет период, к которому относится атом. Ряд авторов уже использовали такой подход, наиболее близко – проф. Черкесов А.И. [ 4]
2) Квантовое число l (с соответствующим ему n) определяет горизонтальный ряд в составе (n + l)-периода – конкретную l-группу, которой принадлежит атом.
3) Спиновое квантовое число ms (со своим знаком) указывает – в какой половине таблицы (левой или правой) расположен атом.
4) Магнитное квантовое число ml (со своим знаком) указывает на конкретный вертикальный ряд, в котором расположен атом. Таким образом, группа (в отличие от группы в ПСЭ-М) – этоатомы с одинаковыми квантовыми числами l и ml, а также координационным индексом Ek В.М. Клечковского.
Номер группы определяется принадлежностью к определенной l-группе и количеством электронов, поступивших на этот квантовый энергетический уровень. Так первая группа щелочных металлов (+водород) получает обозначение s1, вторая группа щелочноземельных металлов - s2, и т.д.
СК-ПСА, отражающая вышеуказанные принципы построения, приведена в табл. 3, форма которой:
1) в минимальной степени отличается от канонический ПСЭ-М;
2) лишена многих недостатков ПСЭ-М;
3) отвечает современным достижениям науки;
4) имеет перспективы для дальнейшего углубления знаний по теории строения атома и теории ПСА, уяснению физического смысла квантовых чисел и математическому выражению закона периодичности. Некоторые из этих вопросов будут изложены в готовящейся к печати книге автора;
5) является основой для лучшего понимания физических и химических свойств как самих атомов, так и образуемых ими простых веществ и химических соединений;
6) является теоретическим фундаментом для весьма перспективного направления – нанотехнологий, имеющих дело с материалами и веществами на атомно-молекулярном уровне;
7) в силу своей простоты и наглядности СК-ПСА наиболее пригодна для преподавания.
Данная форма таблицы разрабатывалась автором в 1973-1991 гг. С изложенными вопросами можно также ознакомиться в книге автора [5].
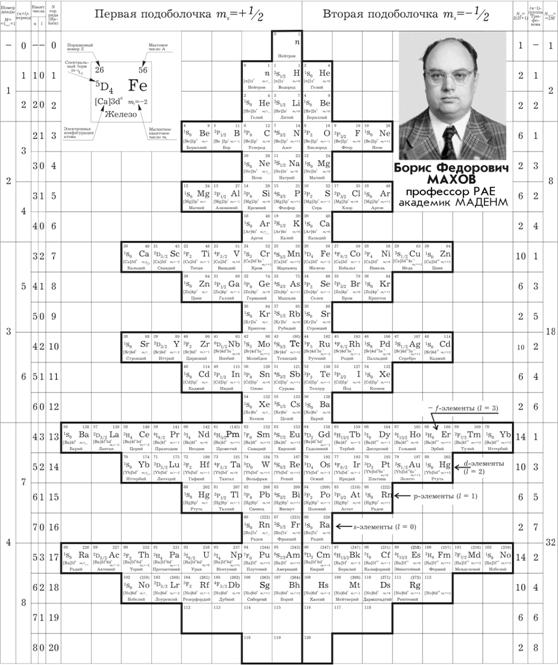
Таблица 3. Симметричная квантовая периодическая система нейтральных атомов
СПИСОК ЛИТЕРАТУРЫ:
- Трифонов Д.Н. “Структура и границы периодической системы”, М., Атомиздат, 1976, 271 стр.
- Клечковский В.М. «Распределение атомных электронов и правило последовательного заполнения (n+l)-групп», М., Атомиздат, 1968
- Клечковский В.М. «Развитие некоторых теоретических проблем Периодической системы Д.И. Менделеева” (доклад на симпозиуме Х Менделеевского съезда). - М., Наука, 1971, стр. 54-67.
- Черкесов А.И. Квантовые состояния ядерных протонов -физическая основа ПЗХЭ. Известия ВУЗов, Серия «Химия и химическая технология». 1982, т.XXV,№ 11, с.1302.
- Махов Б.Ф. «Симметричная квантовая периодическая система элементов», Москва, КМП «Фирма ЭРА», 1997, 28 с., ISBN 5-86700-027-3.
- Махов Б.Ф. Тезисы доклада на конференции РАЕ в г. Sousse, Тунис 12-19.06.05 «СК-СПЭ (нейтральных атомов) или новая периодизация Периодической системы» // Фундаментальные исследования , 2005, № 6, с. 52 –56, ISSN 1812-7339.
- R.Hakala Letter to the Editor,-"J. Chem.Educ.", 1948, v.25, p.229.
- Дж. Эмсли (John Emsley) «Элементы», Москва, «Мир», 1993, 256 стр с илл.



