Рак молочной железы. На сегодняшний день рак молочной железы (РМЖ) является одной из наиболее распространённых форм онкологических заболеваний. В 2012 году было диагностировано более 1,7 миллионов новых случаев рака молочной железы, по сравнению с 500 000 в 1975 году. Проанализировав ежегодное увеличение диагнозов РМЖ, к 2030 году ожидается увеличение этого показателя до 2,1 миллионов в год (GLOBOCAN 2012). Кроме того, РМЖ является основной причиной смерти женщин от онкологических заболеваний. Опухоли молочной железы подразделяют на две группы: опухоли, происходящие из базального эпителия и опухоли, образованные из люминального эпителия. Кроме того, работы последнего десятилетия, основанные на методах генного анализа, позволили создать новую молекулярную классификацию РМЖ. Выделенные данной классификацией типы РМЖ обладают различными молекулярными характеристиками и различаются по прогнозам и чувствительности к различным формам терапии [13, 28] (табл. 1).
Важным параметром для классификации по-прежнему является экспрессия рецепторов эстрогена (ER) и прогестерона (PgR) в опухоли, основываясь на которой определяется возможность использования эндокринной терапии. Основываясь на различной комбинации рецепторов ER, PgR и HER2 опухоли РМЖ подразделяют на 4 основных типа: люминальный A, люминальный B, базальноподобный/трижды негативный и HER2 тип.
Таблица 1
Классификация рака молочной железы, основанная на экспрессии рецепторов эстрогена (ER), прогестерона (PgR) и HER2
|
Тип РМЖ |
Молекулярные характеристики |
Частота |
|
Люминальный A |
ER+ и/или PgR+, HER2-, низкий уровень Ki67 |
40 % |
|
Люминальный B |
ER+ и/или PgR+, HER2+ (или HER2- при высоком уровне Ki67) |
20 % |
|
Базальноподобный/ трижды негативный |
ER-, PgR-, HER2- |
15–20 % |
|
HER2 тип |
ER-, PgR-, HER2+ |
10–15 % |
Наиболее благоприятным из выделенных четырёх вариантов РМЖ является люминальный A тип рака, характеризующийся наличием ER, PgR рецепторов и отсутствием HER2 [11, 3]. Лишь около 15 % опухолей данного типа обладают мутантным p53, наличие которого коррелирует с более плохим прогнозом заболевания [6, 5]. Кроме того, за счёт наличия ER и PgR рецепторов лечение данного типа опухолей зачастую основывается на более таргетной гормональной терапии.
Люминальный B тип рака также положителен по ER и PgR рецепторам, но в отличии от люминального A типа является HER2 положительным либо обладает высоким уровнем Ki67, что является показателем повышенного количества активно делящихся клеток. Люминальный B тип рака молочной железы часто диагностируется у женщин более молодого возраста [11] и обладает характеристиками, ассоциированными с более неблагоприятным прогнозом: опухоли менее дифференцированы, больший размер опухоли, распространение опухолевых клеток в лимфатические узлы, около 30 % пациентов обладают мутантным p53. В связи с вышеуказанными характеристиками, несмотря на гормонозависимость, химиотерапия играет важную роль для люминального B типа опухолей молочной железы.
HER2 тип РМЖ характеризуется положительным статусом рецептора HER2/neu. Чаще всего опухоли данного типа обладают такими характеристиками, как отсутствие ER и PgR рецепторов, распространение опухолевых клеток в близлежащие лимфатические узлы, а также неблагоприятный прогноз заболевания. Для более 70 % опухолей данного типа РМЖ характерны мутации p53 [24]. Для лечения HER2 типа РМЖ используется один из первых препаратов таргетной терапии трастузумаб (Герцептин).
Последним выделенным типом является базальноподобный/ трижды негативный рак молочной железы, характеризующийся отсутствием рецепторов ER, PgR и HER2. Для базальноподобных опухолей характерна экспрессия HER1 и/или экспрессия цитокератинов 5/6, а также для большинства характерны мутации p53. Большинство BRCA1 опухолей молочной железы обладают молекулярными характеристиками базальноподобного РМЖ [19]. Трижды негативные опухоли чаще всего обладают более агрессивным фенотипом и менее благоприятным прогнозом по сравнению с ER положительными типами РМЖ (люминальный A и B) [29, 26]. Для лечения трижды негативных опухолей не может быть использована ни эстрогенная терапия, ни трастузумаб (Герцептин), так как данный тип РМЖ является гормон ER, PgR и HER2/neu отрицательным. В связи с тем, что гены, потенциально связанные с развитием трижды негативного РМЖ, недостаточно изучены, на сегодняшний день не существует таргетной терапии для данного типа РМЖ. Тем не менее исследователи продолжают характеризовать потенциальные гены-мишени для лечения трижды негативных опухолей, среди которых EGF рецептор (EGFR), альфа-B-кристаллин и циклин E [37]. В настоящее же время для лечения базальноподобных/ трижды негативных опухолей чаще всего используется комбинация хирургического вмешательства, радио- и химиотерапии.
Множественная лекарственная устойчивость. Как было сказано ранее, химиотерапия является центральным звеном в лечении рака молочной железы, но развитие множественной лекарственной устойчивости (МЛУ) остается основной проблемой при лечении данного заболевания. МЛУ называют устойчивость опухолевых клеток к ряду лекарственных препаратов, отличающихся по химической структуре и механизму действия. Именно способность опухолевых клеток формировать МЛУ обусловливает трудность лечения онкологических больных: опухоль становится нечувствительна к химиотерапии независимо от комбинации химиопрепаратов. На сегодняшний день ответ метастатического рака молочной железы на химиотерапию первой линии лечения составляет около 30–70 %, безрецидивный период после лечения зачастую достигает лишь 7–10 месяцев [35].
Механизмы множественной лекарственной устойчивости. МЛУ возникает в результате активации клеткой её естественных защитных механизмов. Существуют различные механизмы клеточной МЛУ, для которых доказана их клиническая значимость (рис. 1). Данные механизмы можно разделить на две группы: первая группа включает в себя механизмы, основанные не на транспорте лекарственных препаратов за пределы клетки; вторая группа – механизмы, основанные на транспорте препаратов за пределы клетки посредством трансмембранных белков.
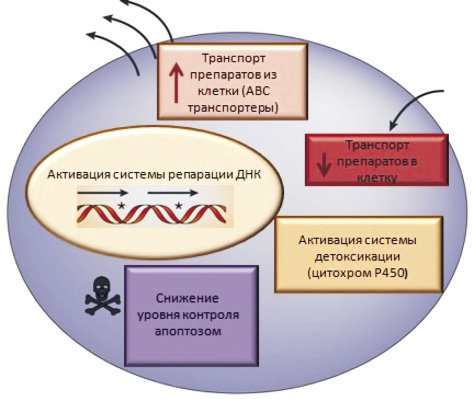
Рис. 1. Клеточные механизмы формирования МЛУ
Классический клеточный механизм МЛУ основан на транспорте препаратов из клетки посредством трансмембранных белков ABC-транспортеров (ATP Binding Cassette (ABC) transporters, АТФ-зависимые транспортеры), тем самым приводящих к снижению концентрации препарата внутри клетки [17]. Данная группа объединяет трансмембранные белки, использующие энергию гидролиза аденозинтрифосфата (АТФ) для транспортировки лекарственных препаратов за пределы клетки [25]. Было показано, что повышение экспрессии ABC-транспортеров отвечает за развитие феномена множественной лекарственной устойчивости [9].
ABC-транспортеры: структура и механизм действия. В настоящее время известно 49 ABC-транспортеров человека, которые подразделяют на подсемейства A, B, C, D, F и G, основываясь на гомологичности последовательности белков, а также их доменной организации [12]. Структура белков АВС-семейства аналогична для всех подклассов, они содержат трансмембранный домен(ы) (ТМД) и нуклеотид-связывающие домены (НСД) (рис. 2).
Трансмембранные домены образуют лиганд-связывающую область (каталитический центр), а два нуклеотид-связывающих домена, локализующиеся в цитоплазме, связывают АТФ, энергия гидролиза которого необходима для транспорта веществ [30].
На сегодняшний день наиболее изученными ABC-транспортерами, оказывающими влияние на развитие МЛУ при раке молочной железы, являются P-гликопротеин (Pgp) (ABCB1, подсемейство В), BCRP (ABCG2, подсемейство G) и MRP1 (ABCC1, подсемейство С). Повышенная экспрессия данных транспортеров была продемонстрирована в клетках опухолевого происхождения, за счёт этого повышается отток лекарственных препаратов за клеточные пределы, что приводит к снижению его внутриклеточной концентрации и тем самым снижению эффективности химиотерапии [31, 4].
ABCB1 и ABCG2. Наиболее охарактеризованным ABC транспортером является P-гликопротеин (Pgp) или АВСВ1 белок, являющийся членом подсемейства B [2]. Экспрессия Pgp была показана для многих тканей человека. Pgp является первым ABC-транспортером, гиперэкспрессия которого была ассоциирована с феноменом МЛУ клеток рака молочной железы [31]. Гиперэкспрессия Pgp приводит к снижению внутриклеточной концентрации препарата, тем самым уменьшая цитотоксичность противоопухолевых препаратов, таких как антрациклины, винка алкалоиды, подофиллотоксины и таксаны [1]. Много информации накоплено также о BCRP (ABCG2), представителе подсемейства G, гиперэкспрессия которого приводит к устойчивости к широкому спектру лекарственных соединений, включая нуклеотидные аналоги [36]. Несмотря на десятилетия исследований данных транспортеров, на сегодняшний день ни одно из клинических испытаний, основанных на ингибировании транспорта лекарственных препаратов, не увенчалось успехом. Более того, клинические испытания с использованием ингибиторов ABCB1, дающих положительный результат in vitro, не были эффективны для пациентов [32].
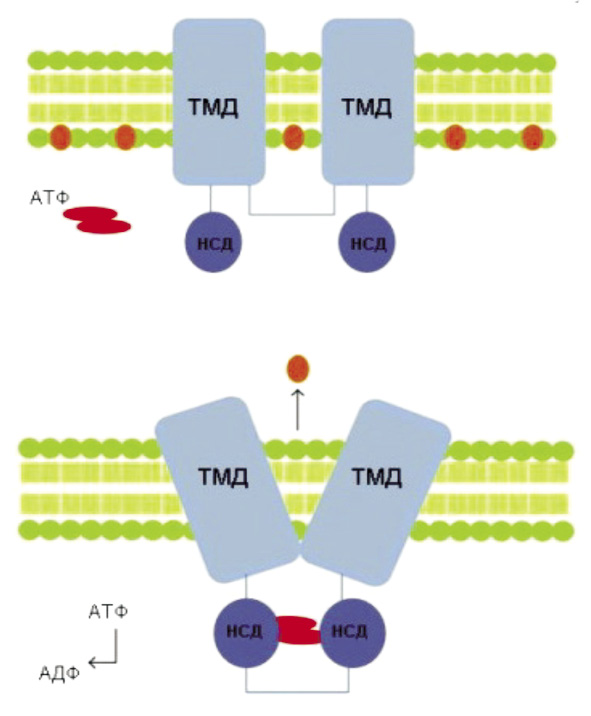
б
Рис. 2. а – пример структуры ABC-транспортера, состоящего из двух трансмембранных доменов (ТМД) и двух нуклеотид-связывающих доменов (НСД); б – при связывании АТФ НСД домены соединяются, что приводит к изменению конформации, за счёт которого осуществляется транспорт субстрата из клетки
ABCC – подсемейство белков множественной лекарственной устойчивости (MRP). Другим из выделенных подсемейств ABC-транспортеров является подсемейство C – подсемейство белков множественной лекарственной устойчивости (Multidrug Resistance Protein subfamily, MRP). Данное подсемейство состоит из 9 ABC белков: ABCC1-6, ABCC10-12. Для многих транспортеров подсемейства C на сегодняшний день описана субстратная специфичность, а также продемонстрированы профили множественной лекарственной устойчивости. Основные данные по субстрат-специфичности транспортеров данного подсемейства представлены в табл. 2.
ABCC1. Наиболее хорошо охарактеризованным представителем данного подсемейства является транспортер ABCC1 (MRP1). ABCC1 экспрессируется на высоком уровне в лёгких, семенниках, почках, плаценте, а также в сердечной и скелетных мышцах [16]. Несколько независимых исследований показали, что экспрессия ABCC1 является маркером неблагоприятного прогноза для некоторых типов РМЖ. Было показано, что повышенная на ранних стадиях экспрессия ABCC1 ассоциирована с более коротким временем до рецидива после постхирургической адьювантной химиотерапии [33]. Также было продемонстрировано, что экспрессия ABCC1 не только ассоциирована с уменьшением времени до рецидива, но также коррелирует с общей выживаемостью [14]. Было показано, что уровень экспрессии данного транспортера в опухолях РМЖ пациентов, прошедших прехирургическую адьювантную терапию, значительно выше уровня экспрессии до прохождения терапии [15].
Таблица 2
Субстратная специфичность транспортеров подсемейства MRP (ABCC). Таблица объединяет данные различных исследовательских групп [7, 8, 18, 20, 38]
|
Транспортер |
Устойчивость |
Лекарственные препараты |
Физиологические субстраты |
|
ABCC1 |
Вещества природного происхождения |
Доксорубицин Винбластин Винкристин |
Глутатион, эстроген, окисленный глутатион, лейкотриен C4, эстроген β глюкоронид |
|
ABCC2 |
Вещества природного происхождения |
Цисплатин Доксорубицин Этопозид Винкристин |
Лейкотриен C4, эстроген β глюкоронид, желчные кислоты |
|
ABCC3 |
Вещества природного происхождения |
Даунорубицин Доксорубицин Метотрексат Винкристин |
Эстроген β глюкоронид, этопозид-глюкоронид, этинилэстрадиол-гдюкоронид, желчные кислоты |
|
ABCC4 |
Нуклеотидные аналоги |
PMEA Метотрексат Топотекан Адефовир |
DHEAS, конъюгированные стероиды, желчные кислоты, простагландины PGE1 и PGE2, циклические нуклеотиды, эстроген β глюкоронид |
|
ABCC5 |
Нуклеотидные аналоги |
5-фторурацил Адефовир |
Циклические нуклеотиды |
|
ABCC10 |
Вещества природного происхождения + Нуклеотидные аналоги |
Эпотилон B Доцетаксел Паклитаксел Винбластин Винкристин Ara-C Гемцитобин ddC PMEA |
Лейкотриены, эстроген β глюкоронид, |
|
ABCC11 |
Нуклеотидные аналоги |
PMEA 5-фторурацил ddC |
Желчные кислоты, конъюгированные стероиды, циклические нуклеотиды, глюкоронид |
|
ABCC12 |
Неизвестно |
Неизвестно |
Неизвестно |
ABCC10. Другим представителем данного подсемейства, малоизученным на сегодняшний день, но интересным для изучения развития МЛУ при лечении рака молочной железы, является транспортер ABCC10 (MRP7). ABCC10 экспрессируется во всех органах человека, таких как поджелудочная железа, головной мозг, яичники, селезенка, печень, плацента, почки, сердечные и скелетные мышцы, семенники, кишечник, предстательная железа, и других органах [10, 23, 34]. Гиперэкспрессия ABCC10 in vitro даёт устойчивость к необычно широкому спектру лекарственных препаратов, таких как таксаны, винка алкалоиды, нуклеотидные аналоги, а также эпотилон B [20, 21, 27]. Функция данного белка in vivo остаётся неизученной, поэтому важным шагом в исследовании ABCC10 транспортера было создание Abcc10 нокаутной мыши [22]. Полученные Abcc10-/- мышиные фибробласты были гиперчувствительны к таким химиотерапевтическим агентам, как доцетаксел, паклитаксел, винкристин и Ara-C, а также было показано повышенное внутриклеточное накопление данных препаратов по сравнению с фибробластами мышей дикого типа.C использованием Abcc10-/- мышей и мышей дикого типа также была продемонстрирована фармакологическая функция in vivo. Была показана повышенная чувствительность Abcc10-/- мышей к паклитакселу по сравнению с мышами дикого типа. Минимальной токсической дозой для Abcc10-/- мышей была 32 мг/кг по сравнению с 150 мг/кг для мышей дикого типа, что практически в 5 раз ниже. Было показано, что лишь 33 % Abcc10-/- мышей выжили после инъекции 160 мг/кг паклитаксела, в то время как 100 % мышей дикого типа выжили при данной дозе препарата. При увеличении концентрации паклитаксела до 250 мг/кг смертность Abcc10-/- мышей составляла 100 %, смертность мышей дикого типа при этом не превышала 20 %. Мониторинг массы тела в течение 6 дней после инъекции паклитаксела показал, что мыши дикого типа потеряли 10 % массы тела, но восстановили массу до исходной до окончания эксперимента. Abcc10-/- мыши потеряли 20 % от изначальной массы тела, при этом восстановление массы тела не наблюдалось. Также после инъекции паклитаксела уровень лейкоцитов Abcc10-/- мышей снизился на 70 %, в то время как уровень лейкоцитов мышей дикого типа не изменился. Гистопатологический анализ костного мозга, селезенки и тимуса мышей, инъецированных субтоксичной дозой препарата (20 мг/кг), также показал повышенную чувствительность Abcc10-/- животных к паклитакселу по сравнению с мышами дикого типа: были зарегистрированы повышенные неутропения и гипоплазия костного мозга.
Эти результаты позволяют предположить, что ингибирование ABCC10 может иметь клиническое значение в лечении онкологических заболеваний такими химиотерапевтическими препаратами, как таксаны (паклитаксел и доцетаксел), широко использующимися для лечения рака молочной железы.
Рецензенты:
Айдагулова С.В., д.м.н., профессор, заведующая лабораторией клеточной биологии и фундаментальных основ репродукции ЦНИЛ, ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России, г. Новосибирск;
Вавилин В.А., д.м.н., профессор, руководитель лаборатории метаболизма лекарств и фармакокинетики, ФГБУ «Научно-исследовательский институт молекулярной биологии и биофизики» СО РАМН, г. Новосибирск.
Работа поступила в редакцию 18.04.2014.



