Одной из основных проблем современной медицины и ветеринарии является формирование множественной лекарственной устойчивости микроорганизмов, что ведет к снижению эффективности противомикробной терапии и развитию осложнений у пациентов [1]. Преодоление резистентности связывают с введением в практику новых химических соединений, обладающих антимикробной активностью [8, 9], а также с созданием инновационных наноразмерных препаратов. Одним из перспективных направлений в создании таких препаратов является технология конструирования структур «ядро-оболочка», которые в зависимости от носителя характеризуются антибактериальными, противовирусными и ранозаживляющими свойствами [4].
Материалы и методы исследования
В работе использовали полиазолидинаммоний, модифицированный гидрат ионами галогенов (ПААГ), который представляет собой биосовместимый полимер с молекулярной массой полимерной линейной цепи порядка 100–200 кДа, относящийся к IV классу токсичности (рис. 1). На концах цепи к молекуле полимера привиты молекулы сахарозы. Полимер неограниченно растворим в воде [4].
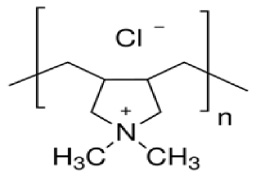
Рис. 1. Формула полиазолидинаммония, модифицированного гидрат ионами галогенов
Для создания структуры «ядро-оболочка» проводили последовательную адсорбцию биосовместимого полимера – полиазолидинаммония, модифицированного гидрат ионами галогенов, на поверхности гидрофобных носителей: синтетические соединения и наноагрегаты флавоноидов.
В качестве экспериментальной модели использовали референс-штаммы грамположительных и грамотрицательных бактерий Escherichia coli 113–13, Pseudomonas aeruginosa ATCC 27853, Bacillus cereus 8035, Staphylococcus aureus 209 P, а также клинические изоляты золотистого стафилококка.
Антимикробную активность гетероциклических и полимерного соединения изучали с использованием метода серийных разведений (МУК 4.2.1890-04.), с помощью которого определяли их минимальную подавляющую концентрацию (МПК).
Оценку ранозаживляющего действия структур «ядро-оболочка», содержащих наноагрегаты флавоноидов, покрытые ПААГ, проводили на модели экспериментальных полнослойных ран. Для оценки эффективности лечения ран рассчитывали ежесуточное уменьшение площади ран в % по общепринятой методике [6, 10].
Результаты исследования и их обсуждение
Создание инновационных препаратов для медико-биологической и ветеринарной практики предполагает использование современных технологий и методических подходов при их конструировании. Одним из перспективных направлений является создание структур «ядро-оболочка».
Ранее в наших исследованиях была показана высокая антимикробная активность ПААГ в отношении референс-штаммов и клинических изолятов грамположительных и грамотрицательных бактерий, причем наиболее выраженная в отношении грамположительных микроорганизмов [2, 5].
В дальнейших исследованиях нами была изучена биологическая активность гетероциклического соединения – адамантилметилен-циклогексен-дикарбоксилата, которое относится к группе енаминов. Это соединение представляло особый интерес в исследованиях, так как оно является структурным аналогом противовирусных средств [7]. Было установлено, что данное соединение обладало антимикробной активностью в отношении всех исследуемых бактерий, за исключением референс-штамма P.aeruginosa АТСС 27853, однако значения МПК были достаточно высокими (табл. 1).
Таблица 1
Антимикробная активность адамантилметилен-циклогексен-дикарбоксилата
|
№ п/п |
Исследуемые микроорганизмы |
МПК, мкг/мл |
|
1 |
S. aureus 209 P |
25 |
|
2 |
S. aureus № 2 |
50 |
|
3 |
S. aureus № 6 |
100 |
|
4 |
S. aureus № 21 |
25 |
|
5 |
S. aureus № 23 |
50 |
|
6 |
S. aureus № 92 |
100 |
|
7 |
S. aureus № 430 |
100 |
|
8 |
B. cereus 8035 |
50 |
|
9 |
E. coli M-17 |
100 |
|
10 |
P.aeruginosa АТСС 27853 |
– |
Для повышения эффективности гетероциклического соединения нами были созданы инновационные экспериментальные препараты по типу структуры «ядро-оболочка», поскольку поиск химических соединений, обладающих выраженной антимикробной активностью и низкой токсичностью для макроорганизма, является актуальным и востребованным в медико-биологической и ветеринарной практике.
Структуры «ядро-оболочка» создавали методом последовательной адсорбции биосовместимого полимера на поверхности адамантилметилен-циклогексен-дикарбоксилата (рис. 2), после чего была проведена оценка антимикробной активности инновационного препарата, результаты которой представлены в табл. 2.
Было установлено повышение биологической активности адамантилметилен-циклогексен-дикарбоксилата, модифицированного ПААГ: в отношении S. aureus 209 P – в 62 раза, S. aureus № 2, № 21 и № 92 – в 32 раза, S. aureus № 430 и B. cereus 8035 – в 16 раз, E. coli 113–13 – в 2 раза. МПК созданной структуры «ядро-оболочка» для P. aeruginosa АТСС 27853 составила 25 мкг/мл.
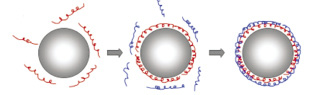
а б в

Рис. 2. Технология создания структур «ядро-оболочка»
Таблица 2
Биологическая активность структуры «ядро-оболочка» адамантилметилен-циклогексен-дикарбоксилата, модифицированного ПААГ
|
№ п/п |
Исследуемые микроорганизмы |
МПК, мкг/мл |
|
1 |
S. aureus 209 P |
0,4 |
|
2 |
S. aureus № 2 |
1,6 |
|
3 |
S. aureus № 6 |
1,6 |
|
4 |
S. aureus № 21 |
0,8 |
|
5 |
S. aureus № 23 |
0,8 |
|
6 |
S. aureus № 92 |
3,2 |
|
7 |
S. aureus № 430 |
6,4 |
|
8 |
B. cereus 8035 |
3,2 |
|
9 |
E. coli M-17 |
50 |
|
10 |
P. aeruginosa АТСС 27853 |
25 |
Полученные результаты позволяют считать перспективным направление создания инновационных препаратов по типу «ядро-оболочка» для повышения эффективности химиотерапевтических антимикробных препаратов с целью преодоления антибиотикорезистентности возбудителей инфекционных заболеваний.
Нами были исследованы также препараты, созданные по типу структуры «ядро-оболочка», у которых в качестве «ядра» были наноразмерные агрегаты флавоноидов [3]. По данным литературы известно, что биофлавоноиды, содержащиеся в прополисе, обладают выраженной регенерирующей способностью.
Была изучена ранозаживляющая способность наноагрегатов флавоноидов и их модификаций ПААГ. Исследования проводили на белых беспородных мышах (самцах), массой 18–20 г, которые содержались на стандартном рационе вивария. Животные были разделены на 3 группы:
1 – опытная группа, раны которой обрабатывали препаратом, содержащим структуры «ядро-оболочка», на основе наноагрегатов флавоноидов, стабилизированных ПААГ;
2 – контрольная группа 1, раны которой не обрабатывали.
3 – контрольная группа 2, раны которой обрабатывали суспензией наноагрегатов флавоноидов.
Оценку ранозаживляющих свойств наноагрегатов флавоноидов и структур «ядро-оболочка», созданных на их основе путем обработки ПААГ, проводили по ежесуточному уменьшению площади полнослойных ран. Полученные результаты представлены на диаграмме (рис. 3).
Было установлено, что в опытной группе животных наблюдается статистически достоверное уменьшение площади раневой поверхности, начиная со вторых суток эксперимента, а полное заживление ран происходит на 8 сутки. В контрольной группе животных, раны которых не обрабатывали, полное заживление ран наступало на 14 сутки от начала эксперимента. Полное заживление ран контрольной группы мышей, раны которых обрабатывали суспензией, содержащей наноагрегаты флавоноидов, происходило на 11 сутки.
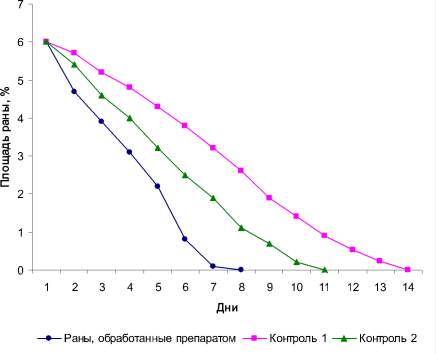
Рис. 3. Динамика изменения площади экспериментальных ран у белых мышей
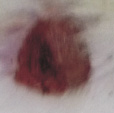
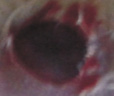
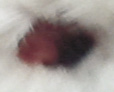
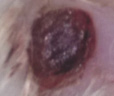
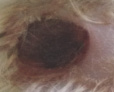
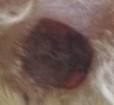
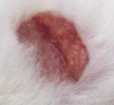
Оценивая морфологические изменения раневых дефектов, было установлено, что нанесение препаратов, содержащих как стабилизированные, так и нестабилизированные наноагрегаты флавоноидов, ускоряет заживление полнослойных ран кожи путем стимуляции репаративных процессов и усиливает барьерно-защитную функцию кожи (рис. 4).
Проведенные исследования показали высокую эффективность созданного инновационного препарата по сравнению с нестабилизированными флавоноидами, который можно рассматривать в качестве перспективного средства для лечения неосложненных и гнойных ран.
Заключение
Полученные результаты позволяют предположить, что большая эффективность структур «ядро-оболочка» по сравнению с нестабилизированными гетероциклическими соединениями и наноагрегатами флавоноидов связана с синергидным эффектом и большей биодоступностью созданных нами инновационных препаратов. Создание аналогичных препаратов на основе гетероциклических соединений различных классов, обладающих антимикробной активностью, позволит повысить их эффективность и снизить токсический эффект для макроорганизма.
Поскольку ранее нами была установлена высокая антимикробная активность ПААГ [3], то стабилизация им наноагрегатов флавоноидов снижает риск развития воспаления и контаминации раневой поверхности различными микроорганизмами. Следовательно, препарат, содержащий структуры «ядро-оболочка» на основе наноагрегатов флавоноидов, покрытых биосовместимым полимером ПААГ, может быть рекомендован как эффективное ранозаживляющее средство.
|
День эксперимента |
Опытная группа |
Контрольная группа 1 |
Контрольная группа 2 |
|
3 |
|
|
|
|
8 |
|
|
|
|
11 |
|
|
Рис. 4. Динамика заживления экспериментальных ран у белых мышей
Рецензенты:
Карпунина Л.В., д.б.н., профессор кафедры «Микробиология, биотехнология и химия» Саратовского государственного аграрного университета имени Н.И. Вавилова, г. Саратов;
Луцевич И.Н., д.м.н., профессор, заведующий кафедрой гигиены медико-профилактического факультета СГМУ им. В.И. Разумовского, г. Саратов.
Работа поступила в редакцию 11.04.2014.