Известно, что характерная для Грузии субтропическая среда сформировалась в условиях региональных географических особенностей западной Грузии. Такой азональный субтропический климат, естественно, характеризуется резкими периодическими изменениями. А цитрусовые как формы, филогенетически сформированные в настоящих субтропических условиях, по своей генетической структуре мало приспособлены к нашим сравнительно суровым условиям. Относительно в необычной среде очевидно повышенные уровни мутационного изменения у цитрусовых.
Среди многих факторов, которые вызывают естественный мутационный процесс, для цитрусовых особое значение имеют биохимические факторы. Некоторые промежуточные, а иногда даже конечные продукты метаболизма (дубильные вещества, флавоноиды, эфирные масла, пигменты, аминокислоты и др.) характеризуются мутагенными свойствами. Их называют автомутагенами.
Предположение о роли биомутагенов (автомутагенов) для объяснения повышенного уровня природной мутабильности у цитрусовых, предложил Диасамидзе [1]. После того исследованиями Керкадзе [4, 5] было экспериментально установлено биомутагенное действие вытяжек разных органов цитрусовых на модельный объект. Аналогичные исследования были проведены и другими авторами [2, 6, 9, 10]. Многими авторами на примере цитрусовых была подтверждена способность биосинтеза биологически особенных веществ.
Установлена связь стимулирующего действия содержимого пыльцевой трубки между способностью образования нуцеллярных сеянцев [3, 7, 8].
Наша работа посвящается изучению автомутагенной природы соматических мутаций цитрусовых. Экспериментами, которые были проведены с этой целью, было подтверждено, что соматические мутации в стерильных формах цитрусовых более вероятны, чем в фертильных формах.
Материалы и методы исследования
Объектами исследования были следующие формы цитрусовых: апельсин Вашингтон – Навэль, апельсин Местный и P. trifoliata.
С целью получения вытяжек были использованы листья первой вегетации. Вытяжки были получены из 100 г листьев каждого генотипа. Листья измельчались в фарфоровой посуде, куда добавляли чистый песок. После получения однородной массы добавляли 100 мл дистиллированной воды. Перед воздействием вытяжки были профильтрованы. Воздействие вытяжек проводили на меристемные клетки кончика корня C. wilsoni по 1 часовой экспозиции. Фиксацию материала проводили каждые 3 часа (от 3 до 30 ч). Приготовляли временные раздавленные препараты. Их окрашивали ацетокармином. Хромосомные аномалии были рассчитаны анафазным методом.
Результаты исследования и их обсуждениеИз таблицы видно, что при обработке кончика корня C. wilsoni вытяжками из листьев мандарина Уншиу, Вашингтон‒Навэль и P. trifoliata получен высокий процент хромосомных аномалий (12,2; 11,1; 10,7 %). Низкая мутагенная активность была обнаружена у вытяжки из листьев местного апельсина – 4,5 %. В контрольном варианте природные хромосомные аномалии были 2,9 %.
Частота структурных хромосомных нарушений после обработки проростков C. wilsoni вытяжками листьев разных генотипов цитрусовых
|
№ п/п |
Объекты исследования |
Количество проанализированных кончиков корня |
Количество проанализированных анафаз |
Структурные нарушения хромосом |
Эндомитоз |
||
|
число |
% |
число |
% |
||||
|
1 |
Мандарин Уншиу |
20 |
786 |
96 |
12,2 ± 1,2 |
15 |
1,9 |
|
2 |
Апельсин Вашингтон–Навэль |
25 |
1063 |
118 |
11,1 ± 0,3 |
10 |
0,9 |
|
3 |
P. trifoliata |
20 |
978 |
105 |
10,7 ± 0,9 |
18 |
1,8 |
|
4 |
Апельсин Местный |
25 |
1012 |
46 |
4,5 ± 0,7 |
3 |
0,3 |
|
5 |
Контроль (вода) |
20 |
1241 |
36 |
2,9 ± 0,5 |
4 |
0,3 |
В меристемных клетках C. wilsoni влиянием вытяжек из листьев различных генотипов цитрусовых обнаруживаются многоядерные клетки и эндомитоз. Большинство многоядерных клеток наблюдалось при действии вытяжек из листьев мандарина Уншиу и P. trifoliata. В контрольных вариантах было получено 6 многоядерных клеток. Спектр и частота хромосомных нарушений меняется в зависимости от обработки вытяжкой из листьев разных генотипов и в большинстве случаев носит специфический характер.
Эксперимент доказал, что у различных форм цитрусовых характеризуется образование и накопление автомутагенных веществ.
Следует отметить, что самый высокий процент хромосомных перестроек наблюдается при использовании вытяжки листьев стерильных форм. Но, что касается высокой мутагенной активности P. trifoliata, вытекает из его природы, в насколько большем количестве он содержит эфирные масла и другие биологически активные вещества.
Эксперименты были проведены также для определения автомутагенных свойств содержимого пыльцевых зерен, для чего были использованы вытяжки из пыльцевых зерен различных форм цитрусовых. Вытяжки были приготовлены из свежесобранных пыльцевых зерен в количестве 0,1 г и разбавлены до 2 % в спирте с добавлением дистиллированной воды.
При воздействии вытяжкой из пыльцевых зерен различных генотипов цитрусовых на меристемной ткани модельного объекта (Allium fistilozum L.) оказалось, что в пыльце отдаленной формы цитрусовых Papeda накапливается гораздо больше мутагенных веществ, чем у культигенов цитрусовых. Следовательно, влияние вытяжкой из их пыльцевых зерен дает больший генетический эффект, чем влияние вытяжкой из пыльцевых зерен культигенов. Например, при воздействии вытяжкой из пыльцевых зерен Вильсона генетический эффект больше, чем при воздействии вытяжкой из пыльцевых зерен культигенов. В частности, при воздействии вытяжкой из пыльцевых зерен C. Wilsoni было получено 14,5 % хромосомных нарушений, в случае C. ichangenzis – 13,4 %, при P. trifoliata – 13,3 % (рис. 1).
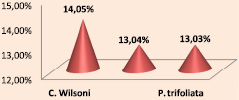
Рис. 1. Хромосомные нарушения у C. wilsoni, C. ichangenzis, P. trifoliata
А в случае культигенов этот показатель значительно ниже: в лимоне Мейер хромосомные перестройки составляют 7,4 %, а в апельсине Местный – 7,1 % (рис. 2).
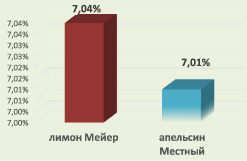
Рис. 2. Хромосомные нарушения у лимона Мейер и апельсина Местный
Таким образом, можно сделать вывод, что при гибридизации внуцеллярных сеянцев цитрусовых разнообразия мутантных форм в ряду с другими факторами могут быть вызваны автомутагенными особенностями состава пыльцевой трубки.
При гибридизации наиболее отдаленных форм автомутагенные вещества могут накапливаться в значительном количестве, следовательно, в последующие поколения может быть выявлено больше мутаций, притом более богатым спектром.
Выводы
Таким образом, в отличенных условиях первичных геноцентра цитрусовых высокий уровень мутабильности можно объяснить автомутагенным механизмом как адаптивной реакцией к относительно необычным для растений температурным факторам.
Исследованиями установлено повышение мутационной изменчивости у стерильных форм цитрусовых (по сравнению с фертильными) в связи с накоплением в них автомутагенных веществ. В стерильных растениях, в которых хотя цветы развиваются, но гаметы нежизнеспособные, не исключено, что главной причиной стерильности является накопление автомутагенных веществ.
Рецензенты:
Котельников А.В., д.б.н., профессор кафедры «Гидробиология и общая биология», ФГБОУ ВПО «Астраханский государственный технический университет», г. Астрахань;
Воронков А.В., д.м.н., заведующий кафедрой фармакологии Пятигорского медико-фармацевтического института ‒ филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Работа поступила в редакцию 04.04.2014.



