Алкогольная интоксикация проявляется генерированным поражением органов и систем, прежде всего – печени как барьерного органа, выполняющего антитоксическую функцию. В патогенезе алкогольной гепатопатии существенную роль играет образующийся в процессе метаболизма этанола ацетальдегид. Гепатотоксическое действие ацетальдегида проявляется усилением процессов перекисного окисления липидов с последующим нарушением функций фосфолипидов клеточных мембран. В этой связи можно полагать, что средства, обладающие антиоксидантной активностью, способны задерживать развитие алкогольной болезни печени. Используемые при патологии печени растительные средства обладают широким спектром биологического действия, включая антиоксидантный, мембраностабилизирующий, антитоксический, репаративный эффекты, обусловленные, как полагают [1, 3, 5, 7], преимущественно фенольными соединениями. В этой связи перспективным источником лекарственного средства могут служить извлечения из травы кориандра посевного, в котором содержатся флавоноиды, кумарины, органические кислоты, фенолкарбоновые кислоты, микроэлементы и ряд других биологически активных веществ [6].
Цель исследования – экспериментально обосновать целесообразность применения при алкогольной гепатопатии извлечения из травы кориандра посевного, содержащего флавоноиды, кумарины, фенолокислоты, витамины и ряд других биологически активных веществ.
Материалы и методы исследования
Водное извлечение из травы кориандра посевного получали согласно фармакопее ХI. В состав комплекса веществ входят флавоноидные соединения (апигенин, лютеолин, кверцетин и др.), кумарины, фенолкарбоновые кислоты, органические кислоты, витамины и другие биологически активные вещества [6]. В качестве препарата сравнения использовали водный экстракт из кукурузных стобиков с рыльцами.
Суммарный комплекс веществ водного извлечения вводили животным в течение двух недель перорально в виде водных растворов в объеме 2 мл в дозе 150 мг/кг, выбранной на основе фармакологического скрининга гепатотоксичности извлечений по В.В. Гацура [2]. Гепатоз у животных вызывали в конце первой недели семидневным пероральным введением 33 % раствора этанола из расчета 0,75 мл на 100 г массы тела. Животных декапитировали и забирали для исследования кровь и ткань печени. Часть печени помещали в 5 % раствор формалина. Срезы ткани печени готовили общепринятым методом заливки в парафиновые блоки, окраску проводили гематоксилин-эозином. Изучение гистологических срезов проводили с использованием светового микроскопа ЛОМО при увеличениях ×160 в проходящем свете. Снимки срезов производили на компьютеризированном микроскопе. Для морфометрических измерений использовали компьютерную программу для анализа изображений ImageJ 1.4. В сыворотке крови определяли активность аланинаминотрансферазы (АлТ), аспартатаминотрансферазы (АсТ), содержание альбуминов, общего холестерина, триглицеридов с помощью автоматического биохимического анализатора ВS-120 (Minzey, Китай) со стандартным набором реактивов (Diasis, Германия). Кроме того, в крови определяли активность каталазы, щелочной фосфатазы (ЩФ), содержание ТБК-активных продуктов общепринятыми методами.
В ткани печени определяли содержание гликогена по реакции с фенолом после щелочного гидролиза гликогена, содержащегося в определенной навеске печени. Полученные результаты обрабатывались методом вариационной статистики по t-критерию Стьюдента.
Результаты исследования и их обсуждение
Исследования показали, что у интактных животных микроморфологическая картина печени в целом соответствовала нормальным вазоцитарным взаимоотношениям в строении печеночной дольки (рис. 1), равно как и уровень биохимических показателей соответствовал нормальным величинам, что видно из таблицы.
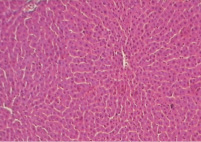
Рис. 1. Микроморфологическая картина печеночной дольки у интактных животных (увеличение 160)
Иная картина наблюдалась у животных контрольной группы с гепатозом. На гистологических срезах печени наблюдалось перивенулярное центролобулярное поражение гепатоцитов. В отдельных гепатоцитах имелась конденсация нуклеофильного вещества в сочетании с кариорексисом и плазмолизом. Некроз гепатоцитов имелся преимущественно в центре печеночных долек, в цитоплазме клеток появились вакуоли различной величины, клетки были увеличены в размерах, цитоплазма их была просветлена. Вместе с тем массового некроза клеток печени не наблюдалось. Определялось нарушение балочной структуры печеночных долек, резкая гиперемия центральных вен и кровеносных сосудов триад. Пространства Диссе были резко расширены (рис. 2). Признаков жирового стеатоза в гепатоцитах не отмечалось.
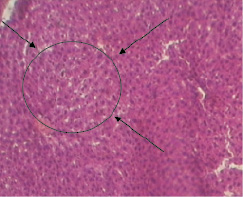
Рис. 2. Микроморфологическая картина печеночной дольки у животных с гепатозом (увеличение 160)
Гисто морфологические нарушения в печени сочетались с существенными нарушениями биохимических показателей (таблица): в крови животных отмечалось достоверное повышение содержания триглицеридов, общего холестерина, активности АлТ, АсТ, щелочной фосфатазы, ТБК-активных продуктов, снижение содержания альбуминов, каталазы крови, а также гликогена в ткани печени.
В группе животных, получавших извлечение из кориандра, в отличие от контрольных, нарушение балочной структуры гепатоцитов было выражено умеренно (рис. 3). Балочная структура долек в целом была сохранена. Центральные вены и кровеносные сосуды триад были без признаков гиперемии, свободны от содержимого. Определялась умеренная лимфоцитарная инфильтрация и активация пролиферативных процессов в зонах центральных вен (рис. 3). Гиперемии сосудов и диапедезных периваскулярных кровоизлияний не наблюдалось. Отмечались единичные клетки в состоянии гидропической дистрофии.
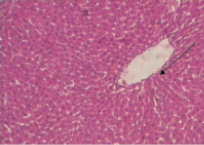
Рис. 3. Микроморфологическая картина печеночной дольки у животных с гепатозом, получавших извлечение из травы кориандра посевного (увеличение 160)
Влияние извлечения из травы кориандра посевного на биохимические показатели функционального состояния печени крыс при курсовой алкоголизации
|
№ п/п |
Серии опытов |
Количество животных |
Гликоген, г/кг |
АлТ крови, Е/л |
АсТ крови, Е/л |
ЩФ крови, Е/л |
Альбумины крови, г/л |
ТБК-активные продукты крови, мкмоль/л |
Общий холесте-рин, ммоль/л |
Тригли-цериды крови, ммоль/л |
Каталаза в крови, к.ч. |
|
1 |
Интактные |
n = 9 |
29,4 ± 2,42 |
48,5 ± 15,00 |
173,1 ± 8,20 |
226,3 ± 22,00 |
33,6 ± 1,00 |
2,85 ± 0,540 |
1,90 ± 0,200 |
0,80 ± 0,080 |
0,5 ± 0,05 |
|
2 |
Контрольные (гепатоз) |
n = 9 |
26,2 ± 5,09 Р1 < 0,05 |
66,4 ± 3,50 Р1 < 0,05 |
220,6 ± 12,40 Р1 < 0,001 |
314,0 ± 22,10 |
30,9 ± 0,20 Р1 < 0,001 |
5,44 ± 2,200 Р1 < 0,05 |
2,10 ± 0,050 Р1 < 0,05 |
1,01 ± 0,067 Р1 < 0,05 |
0,8 ± 0,05 Р1 < 0,05 |
|
3 |
Получавшие извлечение кориандра |
n = 9 |
34,5 ± 9,64 Р1 < 0,05 Р2 < 0,05 Р3 < 0,05 |
58,9 ± 2,30 Р1 < 0,05 Р2 < 0,05 Р3 < 0,05 |
218,2 ± 11,20 Р1 < 0,001 Р2 < 0,05 Р3 < 0,05 |
264,6 ± 28,60 Р1 < 0,05 Р2 < 0,05 Р3 < 0,05 |
31,3 ± 0,60 Р1 < 0,05 Р2 < 0,05 Р3 < 0,001 |
3,46 ± 1,150 Р1 < 0,05 Р2 < 0,05 Р3 < 0,05 |
1,88 ± 0,040 Р1 < 0,05 Р2 < 0,001 Р3 < 0,05 |
0,73 ± 0,040 Р1 < 0,05 Р2 < 0,01 Р3 < 0,05 |
1,0 ± 0,10 Р1 < 0,05 Р2 < 0,05 Р3 < 0,05 |
|
4 |
Получавшие извлечение кукурузных столбиков с рыльцами |
n = 9 |
31,5 ± 4,54 Р1 < 0,001 Р2 < 0,05 |
65,2 ± 1,95 Р1 < 0,05 Р2 < 0,05 |
227,2 ± 6,50 Р1 > 0,05 Р2 < 0,05 |
270,4 ± 16,20 Р1 < 0,05 Р2 < 0,05 |
33,7 ± 0,50 Р1 < 0,05 Р2 > 0,05 |
3,55 ± 1,27 Р1 < 0,05 Р2 < 0,05 |
1,85 ± 0,080 Р1 < 0,05 Р2 > 0,05 |
0,7 ± 0,07 Р1 < 0,05 Р2 < 0,01 |
0,9 ± 0,05 Р1 < 0,05 Р2 < 0,05 |
Примечания:
n – количество опытов;
Р1 – вероятность различия к группе интактных животных;
Р2 – вероятность различия к контрольной группе животных;
Р3 – вероятность различия по отношению к группе животных, получавших водное извлечение из кукурузных столбиков с рыльцами.
В группе животных, получавших в качестве лечения извлечение из кукурузных столбиков с рыльцами, наблюдались аналогичные контрольной группе микроморфологические изменения в печени, однако они были выражены в меньшей степени, чем в контрольной группе, и близки к изменениям в группе животных, получавших извлечение из травы кориандра (рис. 4).
Изменения биохимических показателей в крови и печени в общем соответствовали динамике микроморфологической картины печени. Уровень гликогена в ткани печени, содержание в крови триглицеридов, холестерина, ТБК-активных продуктов, альбуминов, активность АлТ, АсТ, ЩФ у животных, получавших извлечение из кориандра, проявили тенденцию к нормализации. У животных, получавших извлечение из кориандра посевного, содержание триглицеридов по сравнению с контролем понизилось на 54,1 % (p < 0,01), общего холестерина на 21,5 % (p < 0,001), ТБК-активных продуктов на 62,6 % (p < 0,05), снизилась активность АлТ на 48,3 % (p < 0,05), АсТ на 28,5 % (p < 0,05), ЩФ – на 54,5 % (p < 0,05), тогда как активность каталазы повысилась на 25,3 % (p < 0,05), содержание альбуминов ‒ на 8,9 % (p < 0,05), а гликогена в печени на 42,6 % (p < 0,05). Изменения показателей у животных, получавших водное извлечение из кукурузных столбиков с рыльцами, приближались к таковым у животных, получавших извлечения из кориандра. Однако изменения в содержании гликогена в печени и активность АлТ, АсТ и каталазы характеризовались меньшей степенью выраженности, чем в опытах с извлечением из кориандра. Существенное повышение активности каталазы и снижение ТБК-активных продуктов под влиянием водного извлечения из кориандра свидетельствует об увеличении эффективности эндогенной системы антиоксидантной защиты, что обусловлено, по-видимому, действием фенольных соединений, содержащихся в извлечении [4, 6, 7].
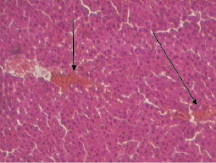
Рис. 4. Микроморфологическая картина печеночной дольки у животных с гепатозом, получавших извлечение из кукурузных столбиков с рыльцами (увеличение 160)
Заключение
Динамика микроморфологической картины печени и биохимических показателей свидетельствует, что суммарный комплекс веществ водного извлечения из травы кориандра посевного снижает глубину поражения печени при ее токсическом поражении. Этот эффект по некоторым показателям превышает аналогичное влияние извлечений из кукурузных столбиков с рыльцами. Учитывая состав веществ комплекса водного извлечения из кориандра посевного, можно говорить о существенной роли антиоксидантного действия в его лечебном эффекте.
Рецензенты:
Попова О.И., д.фарм.н., профессор кафедры фармакогнозии Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России, г. Пятигорск;
Погорелый В.Е., д.б.н., профессор кафедры фармакологии Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России, г. Пятигорск.
Работа поступила в редакцию 01.04.2014.



