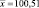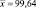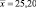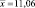В настоящее время адеметионин (S-аденозил-L-метионин) является одним из эффективных гепатопротекторов. Он участвует в реакциях трансметилирования, является биосинтетическим предшественником цистеина, таурина, глутатиона. Наряду с высокой гепатопротективной активностью адеметионин оказывает противовоспалительное, обезболивающее, антидепрессивное действие [1].
В настоящее время субстанция адеметионина в РФ не производится.
Нами поставлена цель изучить существующие способы и разработать наиболее доступный способ получения стабильной субстанции адеметионина.
Из литературных данных известно, что наиболее успешным является биосинтетический способ получения адеметионина. Сущность метода заключается в накоплении адеметионина в дрожжевых клетках в питательной среде, обогащенной метионином, лизисе дрожжевых клеток и выделении адеметионина из лизата в виде стабильной соли.
Ранее нами была получена соль адеметионина с серной и п-толуолсульфокислотой. Главным недостатком полученной соли является то, что она гигроскопична, что снижает срок хранения соли [2].
Было найдено, что добавление к двойной соли адеметионина с серной и п-толуолсульфокислотой лактозы в соотношении 1:1 приводит к уменьшению влажности полученной соли, а следовательно, повышает срок хранения.
Нами получена субстанция соли адеметионина с серной и п-толуолсульфокислотой с добавлением лактозы в соотношении 1:1 следующим образом.
В качестве продуцента адеметионина мы использовали сухие дрожжи рода Saccharomyces сerevisiae, а в качестве питательной среды была выбрана среда Шленка [3].
Дрожжи культивировали в течение 24–30 часов при постоянном перемешивании и аэрации при температуре 30 °С. Затем проводили лизис дрожжей, содержащих адеметионин, с помощью органического растворителя и разбавленной кислоты серной. Полученный лизат отделяли от остатков дрожжей при помощи центрифугирования.
На следующей стадии осуществляли очистку лизата. Для этого адеметионин из лизата осаждали 5 % водным раствором пикролоновой кислоты. Полученный осадок отстаивали, отфильтровывали и высушивали [4, 5].
На заключительной стадии получали стабильную двойную соль адеметионина с серной толуолсульфокислотой.
К высушенному осадку пикролоната адеметионина добавляли при энергичном встряхивании растворы 0,1 моль/л серной и толуолсульфокислоты, органический растворитель – н-бутанол. Отстаивали в течение 20 минут, органический слой удаляли, водный слой промывали н-бутанолом, до удаления следов пикролоновой кислоты. Затем к водному слою добавляли обесцвечивающий уголь, затем фильтровали.
К полученному бесцветному водному раствору добавляли этанол. Образующийся осадок отделяли декантацией, высушивали при температуре 0–5 °С.
Полученная таким образом соль адеметионина представляет собой гигроскопичный порошок, очень легко растворимый в воде, практически нерастворимый в этаноле, ацетоне и других органических растворителях.
Для уменьшения гигроскопичности к полученной соли добавляли лактозу в соотношении 1:1, высушивали в эксикаторе в течение 24 часов.
Для полученной субстанции соли нами были разработаны методики качественного и количественного анализа.
Для качественного анализа двойной соли адеметионина использовали известные химические реакции, а также УФ-спектроскопию.
УФ-спектроскопию использовали для идентификации полученной соли.
Приготовление раствора испытуемого образца. Точную массу соли (0,1 г, что эквивалентно 0,02 г адеметионин-иона) помещали в мерную колбу вместимостью 100 мл, прибавляли 50 мл воды, растворяли, и доводили тем же растворителем до метки. Аликвоту в количестве 5 мл переносили в мерную колбу вместимостью 100 мл, доводили водой до метки. Регистрировали спектр поглощения в области от 200 до 300 нм.
Приготовление раствора стандартного образца. Из точной массы СО адеметионина сульфата п-толуолсульфоната (0,12 г, что эквивалентно 0,025 г адеметионин-иона) получали раствор по методике, приведенной выше. Раствор сравнения – вода (рис. 1).
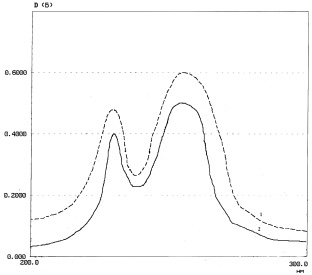
Рис. 1. Спектр поглощения: 1 – водного РСО адеметионина п-толуолсульфоната дисульфата 0,006 %; 2 – водного раствора соли адеметионина с серной и п-толуолсульфокислотой 0,005 %
Как видно из рис. 1, в спектре поглощения раствора испытуемого образца имеется 2 максимума при длинах волн 231 нм (п-толуолсульфокислота) и 256 нм (адеметионин), которые полностью совпадают и имеют одинаковые максимумы со спектром раствора стандартного образца.
С целью идентификации компонентов соли проводили гидролиз, для этого к водному раствору полученной соли адеметионина добавляли водный раствор натрия гидроксида 1М до значения рН среды 5,0, полученный раствор нагревали в течение 30 минут, после чего охлаждали и определяли наличие остатка метионина, тио-группы, а также сульфат-иона по следующим методикам:
К 2 мл гидролизата добавляли 1 мл водного раствора натрия гидроксида 1М и 0,5 мл свежеприготовленного водного раствора нитропруссида натрия 5 %, после кипячения на водяной бане в течение 10 минут появлялось красно-фиолетовое окрашивание (тио-группа).
К 2 мл гидролизата добавляли водный раствор натрия гидрокарбоната 5 % до значения рН среды 6,5–7,0, затем добавляли 1 мл водного раствора нингидрина 10 %, кипятили в течение 5 минут при температуре около 100 °С – появлялось фиолетовое окрашивание (первичная алифатическая аминогруппа).
К 2 мл полученного гидролизата добавляли 0,5 мл водного раствора бария хлорида 5 %, образовывался белый кристаллический осадок, нерастворимый в разведенных минеральных кислотах (сульфат-ион).
Для количественного определения компонентов соли нами разработана спектрофотометрическая методика анализа.
На первом этапе исследований нами были приготовлены водные растворы СО адеметионина сульфата и СО п-толуолсульфокислоты с целью определения возможности использования непосредственного спектрофотометрического метода.
На рис. 2 представлены спектры поглощения полученных растворов.
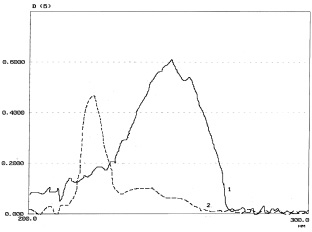
Рис. 2. Спектры поглощения: 1 – водного раствора СО адеметионина сульфата – 0,003 %; 2 – водного раствора СО п-толуолсульфокислоты – 0,002 %
Как следует из рис. 2, полосы поглощения веществ перекрываются и делают невозможным непосредственное спектрофотометрическое определение адеметионина и п-толуолсульфокислоты. Поэтому для определения их содержания нами был использован метод Фирордта.
Результаты определения адеметионина и п-толуолсульфокислоты в модельной смеси и двойной соли приведены в табл. 1 и 2.
Выводы
1. Разработан биосинтетический способ получения субстанции адеметионина с серной и п-толуолсульфокислотой с добавлением лактозы в соотношении 1:1.
2. Разработаны спектрофотометрические методики подлинности субстанции двойной соли адеметионина с серной и п-толуолсульфокислотой.
3. Разработаны методики количественного определения компонентов субстанции двойной соли при помощи спектрофотометрического метода Фирордта.
Таблица 1
Результаты определения адеметионина и п-толуолсульфокислоты в модельной смеси
|
Взято адеметионина, г |
Найдено адеметионина |
Взято п-толуолсульфокислоты, г |
Найдено п-толуолсульфокислоты |
||
|
г |
% |
г |
% |
||
|
0,0200 |
0,01957 |
97,85 |
0,1300 |
0,13236 |
101,82 |
|
0,0250 |
0,02598 |
103,92 |
0,1250 |
0,12238 |
97,90 |
|
0,0300 |
0,02935 |
97,83 |
0,1200 |
0,11802 |
98,35 |
|
0,0350 |
0,03621 |
103,46 |
0,1150 |
0,11796 |
102,57 |
|
0,0400 |
0,03989 |
99,73 |
0,1100 |
0,10955 |
99,59 |
|
0,0450 |
0,04511 |
100,24 |
0,1050 |
0,01025 |
97,62 |
|
Метрологические характеристики
SD = 2,656 RSD = 2,643 |
Метрологические характеристики
SD = 2,103 RSD = 2,111 |
||||
Таблица 2
Результаты определения компонентов в соли адеметионина с серной и п-толуолсульфокислотой
|
Взято соли, г |
Найдено адеметионина |
Взято соли, г |
Найдено п-толуолсульфокислоты |
||
|
г |
% |
г |
% |
||
|
0,1500 |
0,03608 |
24,25 |
0,1500 |
0,01706 |
11,37 |
|
0,1800 |
0,04423 |
24,57 |
0,1800 |
0,02013 |
11,18 |
|
0,2100 |
0,04411 |
25,00 |
0,2100 |
0,02483 |
11,82 |
|
0,2400 |
0,05126 |
26,36 |
0,2400 |
0,02419 |
10,08 |
|
0,2700 |
0,06163 |
25,83 |
0,2700 |
0,02932 |
10,86 |
|
Метрологические характеристики
SD = 2,044 RSD = 4,098 |
Метрологические характеристики
SD = 1,300 RSD = 5,878 |
||||
Рецензенты:
Компанцев В.А., д.фарм.н., профессор кафедры неорганической химии Пятигорского медико-фармацевтического института, филиала ГБОУ ВПО ВолгГМУ, г. Пятигорск;
Попова О.И., д.фарм.н., профессор кафедры фармакогнозии Пятигорского медико-фармацевтического института, филиала ГБОУ ВПО ВолгГМУ, г. Пятигорск.
Работа поступила в редакцию 26.03.2014.