В развитых странах смертность от нейродегенеративных и цереброваскулярных заболеваний в структуре общей летальности занимает 2–3-е места, в России наблюдается схожая ситуация. За последние 5 лет только в Российской Федерации от болезней системы кровообращения умерли 6,4 миллиона человек, что позволяет считать эту патологию глобальной эпидемией. Инсульт является лидирующей причиной инвалидизации населения. По данным Национального регистра инсульта, 31 % перенесших инсульт больных нуждаются в посторонней помощи, 20 % не могут самостоятельно ходить, что ставит эту проблему в ряд социально значимых. Лишь 8 % выживших больных могут вернуться к прежней работе.
Учитывая то, что нейроны гипоталамуса играют важную роль в регуляции водно-солевого обмена и артериального давления, необходимость изучения взаимодействия гипоталамуса и высших отделов ЦНС в норме и при патологии в настоящее время бесспорна.
Нейроэндокринология сегодня располагает большим количеством взаимоисключающих фактов, воззрений, гипотез и концепций относительно функциональной роли отдельных гипоталамических ядер и гистофизиологического смысла тех или иных структурных изменений в секреторных нейронах в возрастном аспекте и при ишемиях. Тем не менее остаются малопонятными вопросы специфичности морфологических изменений в гипоталамусе.
Одним из спорных вопросов является роль в индукции апоптоза нейронов липофусцина, обнаруженного в ткани мозга у людей различных возрастных групп. Dontsov А.Е. c соавторами считают, что липофусцин потенцирует антиоксидантные свойства ДОПА-меланина, а Fernandez de Castro J.P., Mullins R.F., Manea A.M., Hernandez J., Wallen T., Kuehn M.H. (2013) рассматривают липофусцин как элемент нейродегенерации [4, 6]. Наименее изученными и противоречивыми являются вопросы о липофусциновых гранулах в нейросекреторных клетках гипоталамуса человека. Утверждение о липофусцине как пигменте старения сменилось на точку зрения о его защитной роли. Противоречивость знаний о химическом составе, источниках и механизмах образования липофусцина обусловила проведение многочисленных работ с анализом полученного материала на различных уровнях. Осмиофильность гранул позволила отнести липофусцин к липидным включениям, но имеются и данные, отрицающие принадлежность липофусцина нейронов к этому классу веществ. Некоторые авторы утверждают, что липофусцин, как и меланин, является производным тирозина. Наличие в составе гранул липофусцина митохондриальных ферментов позволило считать их производными митохондрий [13], присутствие кислой фосфатазы – предположить, что они происходят из лизосом, являются резидуальными тельцами, которые не реагируют на лизосомальные ферменты. Подтверждают эти результаты и данные Feeney E.J., Austin S., Chien Y.H., Mandel H., Schoser B., Prater S., Hwu W.L., Ralston E., Kishnani P.S., Raben N. (2014) о том, что накопление липофусцина – результат неэффективных лизосомальных деградаций [5].
Некоторые авторы считают, что это пигмент «старения» нейрона и связан он с процессами неполного расщепления веществ в лисосомах. По теории S.E. Toth (1968), в генезе гранул липофусцина участвуют митохондрии и гранулярная ЭПС, которые после упаковки в диктиосомах комплекса Гольджи приобретают вид гранул. Xue Q., Hou J., Li Y. (1992) и Okamoto K., Hirai S., Amari M., Watanabe M., Sakurai A. (2013) утверждают источниками, ответственными за формирование липофусциновых гранул, только диктиосомы комплекса Гольджи (2013) [6, 17, 24]. Markelic M., Velickovic K., Golic I., Klepal W., Otasevic V., Stancic A., Jankovic A., Vucetic M., Buzadzic B., Korac B., Korac A. (2013) считают липофусцин результатом слияния липидных капель и митохондрий с лизосомами [12]. Противники состоятельности теории S.E. Toth считают накопление липофусцина генетически запрограммированным и отрицают его образование и накопление как результат метаболической поломки органелл в клетке.
Наличие незначительных исследований на материале человека, отсутствие системного анализа, как в возрастном аспекте, так и при патологии, оставляют проблему роли липофусцина в норме и при инсультах открытой, что диктует продолжение работ в этом направлении. Современные данные о неоднозначной роли липофусцина в метаболизме нервных клеток и отсутствие исчерпывающих доказательств его участия в физиологической и репаративной регенерации нейронов мозга диктуют необходимость проведения исследований именно морфологического характера.
Целью исследования является предупреждение геронтологических изменений нейронов головного мозга и повышение эффективности лечения больных после инсульта. Соответственно цели были поставлены следующие задачи:
1. Изучить морфологию нейронов переднего гипоталамуса человека после инсульта.
2. Получить характеристику липофусцинсодержащих нейронов ядер переднего гипоталамуса на фоне хронической ишемии.
3. Установить топографические особенности распределения нейронов гипоталамуса, содержащих гранулы липофусцина, и их взаимоотношения с кровеносными сосудами.
Материалы и методы исследования
В работе проанализирован материал биоптатов дна и боковых стенок третьего желудочка у 14 пациентов мужского пола различных возрастных групп, умерших от инсульта, полученный в соответствии с приказом Минздравмедпрома РФ от 29.04.94 N 82 «О порядке проведения патологоанатомических вскрытий», по правилам регламентирующей инструкции о порядке вскрытий трупов в лечебных учреждениях. Группу контроля составили 28 пациентов, погибших в результате травм, несовместимых с жизнью, предположительно без соматической патологии в возрасте от 24 до 76 лет. Биопсийный материал гипоталамуса фиксировался по прописи для подготовки к иммуногистохимическим исследованиям сразу после забора. Исключение возможных артефактов основано на данных, полученных при специальном исследовании на собаках, свидетельствующих, что при сохранении трупов при температуре 7 °С до 4–6 часов в морфологии гипоталамо-гипофизарной нейросекреторной системы микроскопически видимых изменений не наблюдается, кроме некоторого снижения интенсивности специфических реакций на нейросекрет.
Использованы классические гистологические методы исследования с окрашиванием гематоксилин-эозином для получения общей морфологической картины нейронов переднего гипоталамуса человека. Анализ материала проведён с помощью микроскопа Olympus – Bx82 и цифровой камеры CDх82 с фирменным программным обеспечением.
Результаты исследования и их обсуждение
В наших исследованиях нейроны передних ядер гипоталамуса имеют крупные размеры, достигая 100–120 мкм. Ядро круглой формы с эу- и гетерохроматином, либо равномерно распределённым в кариоплазме, либо расположенным в виде кольца по периферии (рис. 1, а, б). У части нейронов имеется светлоокрашенное перинуклеарное пространство, которое может свидетельствовать о вступлении нейрона в апоптоз. Мелкоклеточная глия равномерно распределяется вокруг нейронов (рис. 1, в).
а 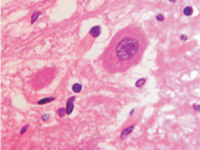 б
б 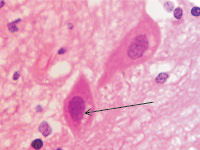
 г
г 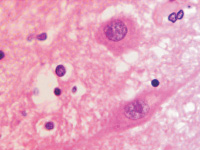
Рис. 1. Нейроны переднего гипоталамуса. Окраска г/э. Микрофото. Ув.х1000: а – эу- и гетерохроматин в ядре распределён неравномерно, по периферии и в центре, в нуклеоплазме идентифицируются глыбки хроматина; б – хроматин распределён равномерно, но ядро окружено светлым кольцом перинуклеарного пространства (указано стрелкой)
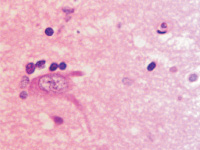
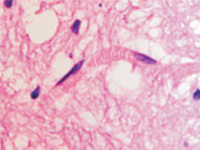
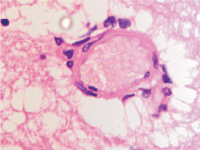
Кровеносные сосуды микроциркуляторного русла изученного нами гипоталамуса не образуют структур гематоэнцефалического барьера, как в других отделах головного мозга. Стенка капилляров представлена плоскими вытянутыми эндотелиоцитами с соответствующей вытянутой формой ярко базофильных ядер (рис. 2, а-е).
Нами отмечено, что диаметр капилляров достигает 10 мкм, в состав стенки более крупных капилляров входят перициты, располагающиеся в расщеплениях базальной мембраны (рис. 2, д, е).
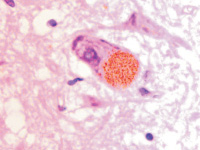
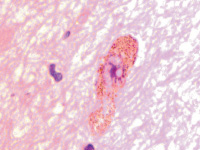
Установлено, что в результате хронической ишемии и развившегося обширного инсульта в области прецентральной извилины мозга человека в нейронах переднего гипоталамуса накапливаются крупные гранулы липофусцина, заполняющие всю цитоплазму вокруг ядра (рис. 3, а). Следует отметить, что гранулы представлены мелкозернистой (до 0,68 мкм) ярко окрашенной субстанцией с высокой оптической плотностью. При этом ядро может занимать один из полюсов клетки, базофилия нуклеоплазмы снижена по сравнению с клетками, лишёнными гранул. Ядро приобретает сетчатое строение с чётко идентифицирующимся в центре шаровидным уплотнением хроматина, вокруг которого располагается базофильное кольцо. От кольца идут тонкие нити, достигающие кариолеммы и придающие ядру в целом вид колеса со спицами (рис. 3, б). Некоторые клетки на одном из полюсов содержат ядра, на другом сосредоточены секреторные гранулы (рис. 3 в), а в некоторых гранулы расположены значительными фрагментами (рис. 3, г). Это может быть результатом либо накопления включений в динамике, либо результатом постепенного неполного освобождения цитоплазмы от гранул. Часть клеток содержит ядра с чёткими контурами (рис. 3 а, б), но в большей части клеток нуклеолемма разрушена (рис. 3, в-е), хроматин распределён хаотично, ядрышки не идентифицируются, как в исследованиях Sendrowski K., Sobaniec W., Sobaniec P., Sobaniec-Lotowska M.E. (2013) [20], относящих, как и мы, этот вид дегенерации клеток к апонекрозу.
а 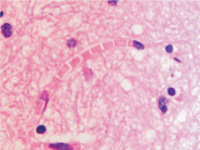 б
б 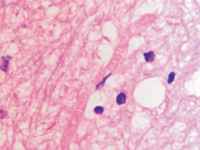
 г
г 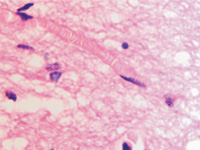
 е
е 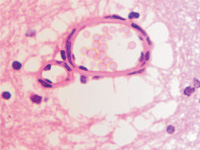
Рис. 2. Микроциркуляторное русло гипоталамуса человека. Окраска г/э. Микрофото. Ув. х600
В нейронах переднего гипоталамуса структура ядер свидетельствует о различном уровне дезорганизации хроматина, разрушении ядерной оболочки, апоптозе нейронов (рис. 3, д). Гранулы приобретают более тёмный коричневый цвет (рис. 3, е). В некоторых клетках вся цитоплазма заполнена гранулами, ядра не идентифицируются. Приобретение резкой базофилии окружающей нейроны глии свидетельствует об апоптозе.
а 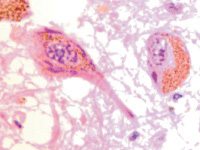 б
б 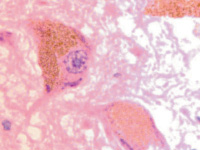
 г
г 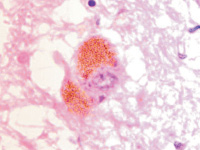
 е
е 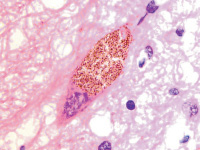
Рис. 3. Нейроны переднего гипоталамуса при ишемическом инсульте в области прецентральной извилины. Окраска г/э. Микрофото. Ув. х1000: а – в клетке слева зернистые включения располагаются равномерно вокруг ядра, а в расположенном рядом нейроне – на одной стороне вдоль длинной оси клетки; б – клетка с гранулами на одном из полюсов, ядро в виде колеса со спицами; в – клетка резко полярна, гранулы располагаются на одном из полюсов; г, д – гранулы располагаются в одном или двух фрагментах на противоположных полюсах клетки; д, е – вытянутая форма клеток со смещением ядра в один из полюсов, гранулы тёмно-коричневого цвета
Нами выделены 4 типа гранулосодержащих клеток: клетки 1 типа, практически лишенные гранул, по нашему мнению, наиболее активно выводящие нейросекрет; клетки 2 типа с умеренным темпом выведения нейросекрета и потому содержащие его гранулы в небольшом количестве в перинуклеарной зоне; клетки 3 типа с пониженной активностью выведения нейросекрета и цитоплазмой, переполненной гранулами. 4-й тип соответствует апоптозирующим нейронам. Наши данные частично согласуются с данными Braak H., Braak E. (1987), которые при окрашивании нейронов по Нисслю также выделили четыре типа нейронов на основе размеров гранул [2]. Клетки I типа, по их данным, содержат крупные гранулы интенсивно окрашенного липофусцина. Клетки II типа характеризуются наличием плотных скоплений мелких гранул. III тип нейронов содержит рассеянные пылевидные гранулы, в то время как IV тип нейронов лишен пигмента. По нашим данным изменяется не размер гранул, а их количество в цитоплазме нейронов, отражающее секреторную активность клеток. Поэтому мы считаем, что наличие одинаковой величины гранул может подтверждать, что это результат накопления секрета в определённых структурах типа лизосом, как и в исследованиях Feeney E.J., Austin S., Chien Y.H., Mandel H., Schoser B., Prater S., Hwu W.L., Ralston E., Kishnani P.S., Raben N. (2014), предположивших, что накопление липофусцина – результат неэффективных лизосомальных деградаций [5].
Заключение
Особенностями нейронов гипоталамуса являются чувствительность к составу омывающей их крови, отсутствие гематоэнцефалического барьера между нейронами и кровью, способность нейронов к нейросекреции пептидов, нейромедиаторов. Возбуждение ядер передней группы гипоталамуса приводит к реакции организма по парасимпатическому типу, т.е. реакциям, направленным на восстановление и сохранение резервов организма. Различные виды артериальной гипертензии, развивающиеся после стимуляции гипоталамуса, обусловлены комбинированным влиянием симпатической части вегетативной нервной системы и выделением адреналина надпочечниками, хотя в данном случае нельзя исключить влияние нейрогипофиза в генезе устойчивой артериальной гипертензии. В экспериментах на животных установлено, что при острой гипоксии различной этиологии (ишемии, вызванной кровопотерей или перевязкой сосудов, питающих мозг, при уменьшении парциального давления кислорода в барокамере) увеличивается содержание нейросекрета в нейронах супраоптического и паравентрикулярного ядер, что, вероятно, следует рассматривать как признак, указывающий на подавление секреторной активности. Принято считать, что липофусцин накапливается в ущерб синтетической функции клеток. Хроническая гипоксия, сопутствующая кровопотере, и связанная с ней дегидратация явились в эксперименте причиной повышенной функции нейронов. Аналогичный характер изменений со стороны нейросекреторных ядер переднего гипоталамуса у лиц, умерших от острой кровопотери, наблюдали и другие авторы, отметившие преобладание в «секреторной формуле» ядер гипоталамуса нейронов с морфологическими и цитохимическими признаками, типичными для фаз синтеза и гиперсекреции, при невысоком содержании клеток, находившихся на других фазах секреторного цикла. По мнению авторов, активация функции гипоталамо-нейрогипофизарной системы при острой кровопотере, по-видимому, направлена на развитие защитной вазоконстрикторной реакции периферического сосудистого русла. Визуальная оценка состояния элементов, образующих супраоптические ядра при острой гипоксии в течение от 10 минут до 5 часов не приводит к каким-либо морфологическим сдвигам в нейронах паравентрикулярных ядер, однако отмечено, что высокая активность синтеза нейросекрета не соответствует темпам его выведения. В опытах с наложением лигатур на кровеносные сосуды было установлено, что уже на пятый день наблюдаются морфологические сдвиги в нейронах гипоталамуса с деструкцией части клеток. Хроническая ишемия структур мозга человека приводит к тому, что нейроны уменьшаются в размерах, часто имеют вытянутую форму, со значительным количеством гиперхромного секрета в цитоплазме; появляются дегенеративные («пикноморфные») нейросекреторные элементы, что наблюдалось и в наших исследованиях. В норме у человека преобладают клетки I типа; 2 и 3 типы содержатся в большем количестве в нейронах переднего гипоталамуса при хронической ишемии. Наши данные согласуются в этом отношении с результатами исследований других авторов, полученных в экспериментах на животных. При гипоксическом воздействии возрастает число нейронов с морфологическими признаками повышенной экструзии нейросекреторных гранул. Glees P., Spoerri P.E., El-Ghazzawi E. (1975) на обезьянах показали накопление липофусцина в заднем гипоталамусе у молодых особей и преобладание клеток, содержащих липофусцин в переднем гипоталамусе в старших возрастных группах подопытных животных [8]. Они не только отнесли идентифицированные гранулы к производным митохондрий, но и к факторам старения. Как и в наших исследованиях, они наблюдали наличие гранул в микроглии, расположенной вблизи капилляров.
Многие авторы рассматривают накопление липофусцина в цитоплазме как явление, предшествующее апоптозу нейронов [1, 18, 23]. Но факт его обнаружения в нейроцитах людей в возрасте 20 лет, погибших в результате причин, не связанных с ишемическим повреждением мозга, свидетельствует о накоплении липофусцина как физиологическом процессе, возможно, и для выполнения роли депо кислорода [7, 14]. Липофусцин накапливается в лизосомах, предполагается, что основной его источник – переваренные при аутофагии митохондрии. Исследования показали в гранулах липофусцина митохондриальные ферменты на разных стадиях образования, что является свидетельством повреждения липидной оксигенации клеточных мембран, а Fe-содержащий гемин, цитохром С и миоглобин рассматриваются как катализаторы этого процесса. Считают, что это мёртвый балласт, усложняющий работу нервных клеток. Davies I., Fotheringham A., Roberts C. (1983) не считают, что липофусцин накапливается в ущерб синтетической функции клеток [3]. Kubasik-Juraniec J., Knap N. (2009) выявили накопление липофусцина в нейронах при голодании [10, 11]. Navarro A., Tolivia J., Alvarez-Uría M. (1998) наблюдали при голодании у животных инвагинации ядерных мембран [15, 16], что отмечено и в наших исследованиях в нейронах гипоталамуса людей, умерших от ишемии мозга. Очевидно, проблема при ишемии мозга заключается не только в потреблении кислорода, но и в нарушении трофического обеспечения в целом. Sturrock R.R. cвязывает накопление липофусцина с синтезом антидиуретического гормона [21]. Некоторые авторы считают, что в основе накопления гранул лежит гидролитический фотораспад ретиноидов под действием ультрафиолетового излучения.
Несмотря на то, что в гранулах липофусцина 20–50 % жира, 30–60 % белков, 9–20 % – остаток чёрного цвета, до сих пор точно неизвестно, из каких продуктов белкового обмена образуется липофусцин; полагают, что из продуктов ядерного распада. В настоящее время появились данные Lubarsch, Brahn, Schmidtmann (1913), что липофусцин является пигментом белковой природы, жиры в нем являются лишь случайной примесью и могут отсутствовать вовсе, причем от этого меняются лишь некоторые микрохимические реакции. По своему качественному составу (С – 50,4 %, II – 5,9 %, N – 10,8 %, серы – 3,2 %) липофусцин крайне близко примыкает к другому белковому пигменту меланину и многими авторами даже идентифицируется с ним. Разграничение проводится лишь в той плоскости, что меланин–пигмент эктодермального происхождения, а липофусцин встречается также и в дериватах других зародышевых листков и поэтому, вероятно, химически несколько отличается от кожного меланина, для которого главным фактором синтеза являются ультрафиолетовые лучи.
Морфологически наши данные не вписываются в общую картину четырёх морфологических стадий старения нейронов. У молодых нейронов (1-я стадия – диффузная) – липофусцина мало и он рассеян по цитоплазме нейрона. У зрелых нервных клеток (2-я стадия, околоядерная) – количество пигмента увеличивается и он начинает скапливаться в зоне ядра. У стареющих нейронов (3-я стадия – полярная), липофусцина все больше и больше и скопления его гранул концентрируются около одного из полюсов нейрона. И наконец, у старых нейронов (4-я стадия, биполярная), липофусцин заполняет большой объем цитоплазмы и его скопления находятся на противоположных полюсах нейрона. В ряде случаев липофусцина в клетке становится так много, что его гранулы деформируют ядро. Накопление липофусцина в процессе старения нейронов и организма связывают также со свойством липофусцина, как каротиноида, связывать кислород. Полагают, что таким образом нервная система адаптируется к происходящему с возрастом ухудшению кислородного питания клеток. В наших исследованиях все клетки содержали только крупные гранулы, степень заполнения цитоплазмы была различной, но в случае переполнения гранулами по всему объёму цитоплазмы сопровождалась смещением ядра к одному из полюсов. Изменения в ядре не носили классической картины апоптоза. В единичных клетках наблюдались инвагинации кариолеммы. Отмечено уменьшение плотности нейронов без увеличения количества глии, увеличивается содержание моноаминоксидазы, уменьшается содержание серотонина. Острая ишемия приводит к немедленной гибели нейронов от кислородного голодания. Но старой загадкой является вопрос, что происходит с нейронами в областях внешних по отношению к ядру зоны инсульта с уменьшенным, но не отсутствующим снабжением кислородом. Было показано, что картина умирания нейронов не полностью соответствует описанию апоптоза. До середины 1990-х большинство исследователей считали, что нейроны, погибшие в ходе инсульта, умирают не в соответствии срабатывания обычной программы апоптоза, но просто за счет разрушения в процессе неконтролируемой формы смерти, некроза. По нашим данным многие клетки с гранулами имели признаки деструкции и разрушенные ядра с растворённым хроматином, что не совсем вписывается в морфологическую картину, характерную для апоптоза.
Выявленные нами нейроны, содержащие гранулы жёлто-коричневого цвета в цитоплазме, сохранившиеся после проводки материала по спиртам высокой концентрации для обезвоживания скорее всего имеют отношение к накоплению меланина. Кора головного мозга может оказывать тормозящий эффект на функции нейронов гипоталамуса, хотя расположенного не в зоне ишемии, но реагирующего на недостаток кислорода в крови путём снижения секреторной активности.
Исследование выполнено Рева И.В. и Ямамото Т. в рамках международного гранта ДВФУ (соглашение № 13-09-0602-а от 6 ноября 2013 г.).
Рева Г.В., Сон Е.А., Шеком Л.И. исследование выполнено в рамках ГЗ по теме «Разработка современных средств доставки лекарственных веществ на основе технологий стволовых клеток и наноструктурированных морских биополимеров», № проекта: 413.
Рецензенты:
Храмова И.А., д.м.н., профессор, врач акушер-гинеколог, Приморский краевой диагностический центр, г. Владивосток;
Шульгина Л.В., д.б.н., профессор, заведующая лабораторией микробиологии, ФГУП «ТИНРО-Центр», г. Владивосток.
Работа поступила в редакцию 04.04.2014.



