Рассеянный склероз (РС) является хроническим прогрессирующим заболеванием нервной системы с иммунопатологическими механизмами развития, поражающим в основном людей молодого и трудоспособного возраста. В изучении вопросов патогенеза, клинического развития заболевания, терапии важная роль отводится механизмам нейроиммунных взаимодействий [4, 6, 9], что позволяет рассматривать отдельные аспекты РС с позиций дизрегуляционной патологии иммунной системы [1, 2]. Отмечено участие дофамина в формировании когнитивной дисфункции, депрессивных расстройств у больных РС [5]. Предполагается, что катехоламины являются значимым регулятором активации лимфоцитов при различном течении заболевания[6], принимают участие в механизмах прогрессирования РС [7]. Представляет интерес исследование влияния биогенных аминов на лимфоциты\моноциты клеток крови у больных РС с различным течением заболевания.
Цель исследования состояла в оценке экспрессирующей способности лимфоцитов\моноцитов крови к биогенным аминам у больных с ремиттирующим и прогрессирующим течением рассеянного склероза.
Материал и методы исследования
Почти у 80 % пациентов с РС заболевание дебютирует ремиттирующим типом течения (РРС) с периодами обострения и стабилизации клинической картины между ними. На определенном, трудно прогнозируемом этапе своего развития РРС трансформируется во вторично-прогрессирующее течение (ВПРС) с постепенным нарастанием неврологической симптоматики и возможными периодами обострения заболевания. Первично-прогрессирующее течение РС (ППРС) характеризуется неуклонным нарастанием неврологических расстройств с дебюта заболевания. Прогредиентное течение заболевания с периодами обострения как отдельная форма не рассматривалось в данном исследовании.
С достоверным диагнозом РС наблюдалось 54 больных с ремиттирующим течением РС, 26 пациентов со вторично-прогрессирующим РС и 6 с первично-прогрессирующим течением заболевания в возрасте от 24 до 47 лет. Длительность заболевания до момента осмотра при РРС составляла от 2 до 11 лет, при ВПРС – от 6 до 19 лет, ППРС – от 3 до 7 лет. Степень инвалидизации по шкале EDSS составила от 3 до 8 баллов.
Мононуклеарные клетки венозной крови были выделены по общепринятой методике в градиенте плотности фиколл-верографина фирмы «Pharmacia Chemical» (Uppsala, Sweden). Для оценки экспрессирующей способности лимфоцитов\моноцитов периферической крови к биогенным аминам взвесь мононуклеарных клеток инкубировалась в среде 199 в концентрации 2·106 кл в 1 мл 40 мин при t 37 ° С в 10–4 М растворами серотонина (С), адреналина (А), гистамина (Г). В контрольной пробирке отсутствовали биогенные амины. Популяционный и субпопуляционный состав лимфоцитов определяли иммуноферментным методом по уровню экспрессии мембранных маркеров: CD3+; CD4+; CD8 +; CD16+; CD56+; CD95+; CD54+; CD25+; CD20+ − с использованием моноклональных антител серии ICO НПЦ «Биомедспектр». Определялся коэффициент экспрессии (КЭ) ‒ расчетная величина, наглядный показатель, характеризующий степень отклонения системы МНК от нормированных значений в условиях инкубирования с биогенными аминами и отражал свойства рецепторов этих клеток [3],свидетельствующих о ее модификации. Экспрессирующая способность клеток тем выше, чем ниже показатель коэффициента экспрессии. Для статистической обработки данных использовался пакет программ Statistica 6,0. Оценка внутригрупповых различий проводилась с использованием непараметрического критерия Манна-Уитни, поскольку частота регистрации ряда параметров не отвечала нормальному распределению.
Результаты исследования и их обсуждение
Мононуклеарные клетки больных РС под влиянием биогенных аминов с маркером CD16+; CD20+; CD54+; CD25+; CD95+; CD4+ качественно и количественно отличались по коэффициенту экспрессии от донорских. Наблюдалось увеличение экспрессирующей способности CD56 + клеток при инкубировании с биогенными аминами как у больных РС, так и у доноров. Необходимо отметить, что большинство популяционных маркеров у больных РС реагируют увеличением экспрессирующей способности клеток на инкубацию с адреналином и в меньшей степени на присутствие в тест-системе серотонина. Этот феномен согласуется с ранее полученными результатами в ином методическом подходе. Необходимо отметить, что разброс показателей среднего значения и стандартного отклонения относительного содержания мононуклеарных клеток при РРС имеет более широкий диапазон, чем при ВПРС. Это может быть признаком иммунологической гетерогенности больных с РРС, связанной с реализацией компенсаторных механизмов иммунопатологического процесса. У больных РС с вторично-прогрессирующим типом течения заболевания (рис. 1) отмечались более высокие показатели адреночувствительности CD16+, CD20+, CD54+, CD56+ клеток. В этой группе достоверно возрастало количество клеток с маркерами CD16+, CD20+, CD56+ в тест-системах с гистамином (p < 0,05). По всем показателям аминергической регуляции CD25+ клеток наблюдались количественные различия в сравниваемых группах.
Во всех тест-системах у больных с ППPC отмечаются статистически значимые более высокие показатели CD4+ клеток, чем при ВПРC течении. Обращают внимание также существенно более высокие значения CD25+ клеток в тест-системах с гистамином и адреналином при ВПРС, что подтверждает существующее представление об участии активационных маркеров в воспалительном и иммунопатологических механизмах при этом типе течения заболевания. Следует отметить, что по уровню экспрессии мембранных маркеров под влиянием биогенных аминов ВПРС отличается от ППРС за исключением клеток с феноменом CD8+, CD20+, CD95+. При ВПРС в тест-системах с адреналином значительно уменьшалось количество CD3+, CD4+ клеток. Однако у больных с ППРС в этой же тест-системе наблюдался больший прирост клеток с маркером CD16+. Под влиянием гистамина выявлено увеличение экспрессирующей способности CD4+, CD56+ клеток в большей мере при ВПРС. Серотонинергическая регуляция, судя по коэффициенту экспрессии, мало различалась между описываемыми группами, за исключением клеток с маркером CD4+, CD25+, CD56+. Необходимо отметить, что при ППРС падает экспрессирующая способность CD25 + клеток во всех тест-системах с биогенными аминами.
В период обострения при ремиттирующем течении заболевания у больных отмечалось нарастание или появление новой очаговой неврологической симптоматики, преимущественно в координаторной и двигательной сферах. Наблюдалась дисфункция тазовых органов, чувствительные нарушения, снижение зрения. Показатель EDSS возрастал на 0,5–1,5 балла. В отличие от стадии ремиссии выявлены более низкие значения показателей клеток с маркерами: CD4+, CD8+, CD56+. В тест-системе с биогенными аминами в период обострения при РРС в отличие от ремиссии отмечалось увеличение клеток с маркерами CD8+. Под влиянием адреналина и гистамина с нарастанием неврологического дефицита увеличивалась экспрессирующая способность CD16+, CD20+, CD56+, CD54+ клеток (рис. 2).
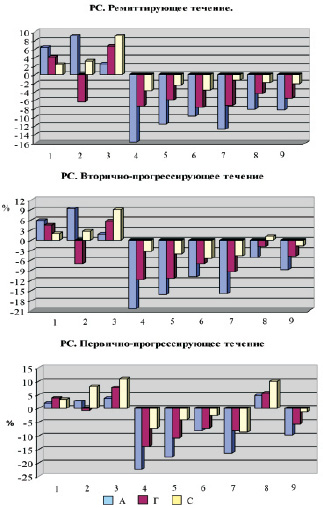
Рис. 1. Коэффициент экспрессии CD3+(1); CD4+(2); CD8+(3); CD16+(4); CD20+(5); CD54+(6); CD56+(7); CD25+(8); CD95+(9) клеток под влиянием биогенных аминов у больных РС с различным течением заболевания
Не выявлено динамики при инкубации лимфоцитов/моноцитов с серотонином в сравниваемых периодах развития заболевания, за исключением CD8+, где экспрессирующая способность снижается в стадии ремиссии (p < 0,045). Иная картина наблюдалась в период выхода из обострения. Новых симптомов не появлялось, отчетливо уменьшалась выраженность имеющихся неврологических признаков. У большинства больных в клинической картине имелась тенденция к снижению показателя EDSS, признаков атаксии и пирамидной недостаточности. Они в меньшей степени жаловались на чувствительные расстройства. Выявлена определенная динамика изменения экспрессирующей способности МНК. Именно в этот период происходило снижение гистаминергической и серотонинергической чувствительности CD8 + клеток.
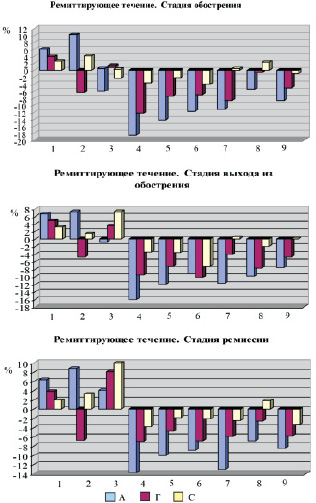
Рис. 2. Коэффициент экспрессии CD3+(1); CD4+(2); CD8+(3); CD16+(4); CD20+(5); CD54+(6); CD56+(7); CD25+(8); CD95+(9) клеток под влиянием биогенных аминов у больных РС с ремиттирующим течением РС
Также отмечено незначительное повышение экспрессии мембранных маркеров при инкубации с гистамином и серотонином CD54+ лимфоцитов, а CD25+ клеток со всеми аминами. С формированием ремиссии значительно снижается в периферической крови количество клеток с маркером CD54+ не только в контроле, но и в нагрузочных тестах по сравнению с периодом выхода из обострения. Характерной особенностью следует считать, что в период ремиссии увеличивается дисбаланс МНК с фенотипом ЕК: CD16+ стремится в коридор нормированных значений, а уровень CD56 + возрастает. С формированием клинической ремиссии изменяется и коэффициент экспрессии мембранных маркеров субпопуляции: CD8+, CD54+, CD25+ прежде всего в тест-системе с гистамином, что может рассматриваться как дополнительный клинико-лабораторный тест. В этот период в большей мере снижается экспрессирующая способность лимфоцитов с маркером CD8+ во всех тест-системах. В период ремиссии отмечено также уменьшение клеток с маркером CD16+ в нагрузочном тесте с гистамином. Под влиянием гистамина и серотонина снижается экспрессирующая способность CD54+, CD25+ клеток, а серотонинчувствительность CD95+ лимфоцитов возрастает. Полученные данные согласуются с результатами[8], подтвердившими ингибирующий эффект гистамина через рецепторы Н1и Н2 на активированные к миелину аутореактивные Т-клетки в модели рассеянного склероза. Необходимо отметить отсутствие изменений популяций клеток CD3 + при инкубации со всеми биогенными аминами в динамике иммунопатологических реакций при РРС, что свидетельствует об отсутствии регуляции этого фенотипа клеток биогенными аминами при ремиттирующем течении заболевания.
Заключение
Таким образом, совокупность выявленных клеточных иммунологических изменений у больных РС с различным клиническим проявлением указывает на заинтересованность и полифункциональный характер аминорегуляторных механизмов при этой патологии. Полученные данные могут быть учтены при лабораторной диагностике РС. Необходимо дальнейшее исследование с целью выяснения дискриминирующей возможности биогенных аминов в решении вопросов диагностики и прогнозирования развития заболевания, оценке иммунопатологических механизмов и функциональной активности системы естественной цитотоксичности, а также взаимосвязи аминов с формированием демиелинизирующего, воспалительного и нейродегенеративного компонентов заболевания.
Рецензенты:
Кухтевич И.И., д.м.н., профессор, заведующий кафедрой неврологии, ГБОУ ДПО «Пензенский институт усовершенствования врачей» Минздрава России, г. Пенза;
Калуцкий П.В., д.м.н., профессор, заведующий кафедрой микробиологии, вирусологии и иммунологии, ГБОУ ВПО «Курский государственный медицинский университет» Минздрава России. г. Курск.
Работа поступила в редакцию 03.04.2014.



