Воспалительные заболевания пародонта занимают второе место по частоте и распространенности среди всех стоматологических заболеваний [1]. Интенсивные эпидемиологические исследования заболеваний пародонта привели к существенным изменениям общей концепции этиологии и патогенеза и предопределили новые приоритеты в диагностике и лечении данной патологии [8, 13].
В настоящее время большой интерес представляет изучение антимикробных пептидов, обеспечивающих реализацию защитных и приспособительных реакций организма при инфицировании и стрессорном воздействии [4, 5, 7]. Кроме антимикробной функции они обладают выраженным иммуномодулирующим воздействием, оказывают влияние на продукцию цитокинов, хемотаксис иммунокомпетентных клеток [10].
Антимикробные пептиды обладают уникальными свойствами: они селективно действуют на бактерии, поскольку их катионные молекулы имеют высокое сродство к мембранам бактерий, обогащенным отрицательно заряженными компонентами – липополисахаридом и др. Выработка у бактерий резистентности к пептидам затруднена в связи с особенностями механизма их бактерицидного действия – быстрого повышения проницаемости мембран микроорганизмов, утратой их барьерной функции, приводящей к осмотическому разрушению клеток [3]. Так, недостаточное количество антибактериальных пептидов предрасполагает к возникновению и развитию пародонтита [11].
На сегодняшний день изучено около сотни антимикробных пептидов, которые выявляются в барьерных эпителиальных тканях, фагоцитирующих в клетках и биологических жидкостях человека, особое место среди которых занимают пептиды ротовой жидкости – дефензины [2, 9]. Установлено, что α- и β-дефензины являются сильными хемоаттрактантами для моноцитов, Т-лимфоцитов и незрелых дендритных клеток [14]. Эти данные демонстрируют связь между экспрессией антимикробных дефензинов и вовлечением иммунокомпетентных клеток в очаг инфекции, способных оказывать длительный гуморальный и/или клеточный ответ после попадания потенциального патогена. Последующие исследования показали, что α- и β-дефензины также обеспечивают антиген-специфические иммунные реакции [15]. Установлено, что пациенты, у которых отсутствуют α-дефензины, страдают частыми и тяжелыми бактериальными инфекциями [12].
Использование антимикробных пептидов в качестве диагностических маркеров для защиты пародонтальных тканей от бактериальной агрессии приобретает все большее значение. S.U. Gorr (2012) представил данные, свидетельствующие, что антимикробные пептиды могут влиять на развитие заболеваний тканей пародонта путем инактивации бактериальных или хост-протеаз или связывать бактериальные токсины, в том числе липополисахариды (например, LL-37). Это коррелирует с данными D. Jonsson и B.O. Nilsson (2012), в которых также показана роль LL-37 в развитии воспалительных заболеваний тканей пародонта. В работе U.K. Gursoy и E. Kononen (2012) рассмотрены общие представления о β-дефензинах и представлены новые аспекты, подчеркивающие их важную роль в деструкции тканей пародонта. В целом, обсуждаемые в литературе открытия значительно расширяют современные представления о роли антимикробных пептидов в механизмах специфической и неспецифической защиты тканей пародонта и открывают новые возможности в профилактике и лечении его заболеваний.
Вышесказанное свидетельствует о том, что в последние годы благодаря быстрому развитию клинической иммунологии внимание исследователей привлекли иммунологические аспекты заболеваний пародонта. Нарушение целостности тканей пародонта в механизмах пародонтита стали относить к иммуноопосредованным заболеваниям [6]. Однако до настоящего времени нет единого мнения по поводу подходов к оценке факторов риска при развитии патологического процесса в тканях пародонта и соотнесения его с изменениями местных механизмов иммунной реактивности полости рта. Учитывая сложность иммунологического ответа человеческого организма, практически невозможно считать какой-либо один медиатр воспаления диагностическим маркером заболевания.
Цель исследования: Изучить уровень α-дефензинов в нейтрофилах смешанной слюны у больных с хроническим катаральным гингивитом в сравнении с пациентами со здоровым пародонтом в процессе ортодонтического лечения.
Материалы и методы исследования
В исследовании приняли участие 97 пациентов с разными видами ортодонтической патологии в возрасте от 14 до 24 лет, без признаков воспаления в тканях пародонта. Постановку диагноза проводили согласно рекомендациям ВОЗ, в соответствии с МКБ-10, на основании клинических проявлений заболевания, выявленных в результате организации клинической стоматологической диагностики с использованием основных и дополнительных методов обследования. В процессе ортодонтического лечения пациенты были ранжированы на две группы. Основную группу составили 54 человека, которым в период лечения несъемной аппаратурой был поставлен диагноз хронический катаральный гингивит. Группу сравнения составили 43 пациента без воспалительных процессов в тканях пародонта.
Клинические обследования проводили в динамике – до постановки брекет-системы и в процессе использования ортодонтических конструкций. При клиническом обследовании определяли состояние полости рта по упрощённому гигиеническому индексу Грина-Вермиллиона (OHI-S). Иммунологическое исследование включало определение содержания α-дефензина до начала лечения зубочелюстных аномалий с применением несъемных конструкций и через 3 месяца ношения брекет-системы.
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов проводилась в электронных таблицах Excel. Статистический анализ осуществлялся с использованием программ IBM SPSS Statistics 20 и Microsoft Office Excel 2007.
Результаты исследования и их обсуждение
В процессе наблюдения у пациентов основной группы на 3-м месяце после начала ортодонтического лечения отмечались значительные изменения данных клинического обследования в сторону увеличения количества зубного налёта, по сравнению с пациентами группы сравнения. Распределение пациентов по значению индекса OHI-S представлено в табл. 1.
Таким образом, наблюдается статистически значимое увеличение среднего значения индекса OHI-S среди пациентов основной группы по сравнению с контрольной через 3 месяца ношения брекет-системы (p < 0,01). При этом различия средних значений индекса до начала лечения – статистически не значимы (p > 0,05). Появление различий объясняется прежде всего значительным ростом индекса у пациентов основной группы в процессе ортодонтического лечения: от исходного среднего значения 0,64 ± 0,02 до 1,49 ± 0,03 через 3 месяца.
Динамика средних значений индекса Грина-Вермиллиона в основной и контрольной группах представлена на рис. 1.
Таблица 1
Значение индекса OHI-S у пациентов основной и контрольной групп на различных этапах ортодонтического лечения
|
Срок определения индекса OHI-S |
Основная группа (n = 54) |
Контрольная группа (n = 43) |
Уровень значимости, р |
||
|
min-max |
M ± m |
min-max |
M ± m |
||
|
До установки брекет-системы |
0,3–1,0 |
0,64 ± 0,02 |
0,4–1,1 |
0,68 ± 0,03 |
> 0,05 |
|
3 месяца ношения |
0,9–2,0 |
1,49 ± 0,03 |
0,6–1,7 |
0,93 ± 0,04 |
< 0,01 |
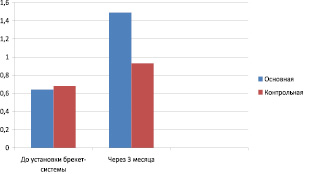
Рис. 1. Динамика среднего значения индекса OHI-S в основной и контрольной группах
α-дефензин является одним из показателей иммунного статуса, который оценивали у ортодонтических пациентов в динамике по его содержанию в смешанной слюне. Значения уровня содержания α-дефензина пациентов основной и контрольной групп отражены в табл. 2.
Таблица 2
Содержание α-дефензина (пг/мл) в смешанной слюне пациентов основной и контрольной групп на разных сроках ортодонтического лечения
|
Срок измерения показателя |
Основная группа (n = 54) |
Контрольная группа (n = 43) |
Уровень значимости, р |
||
|
min-max |
M ± m |
min-max |
M ± m |
||
|
До установки брекет-системы |
12–1365 |
469,0 ± 55,7 |
0– 813 |
297,1 ± 57,7 |
< 0,05 |
|
Через 3 месяца от начала ортодонтического лечения |
18–769 |
333,5 ± 31,6 |
5–1096 |
408,7 ± 53,9 |
> 0,05 |
Несмотря на наблюдаемый значительный разброс данных, при сравнении исходного уровня антимикробного пептида до установки брекет-системы были получены статистически значимые различия (p < 0,05): в смешанной слюне у пациентов основной группы отмечался более высокий уровень содержания α-дефензина (469,0 ± 55,7), чем в контрольной группе (297,1 ± 57,7). Через 3 месяца ношения брекет-системы значения показателя существенно меняются: в основной группе происходит снижение содержания α-дефензина до 333,5 ± 31,6, а в контрольной – увеличение до 408,7 ± 53,9. Изменения в основной группе за 3 месяца – статистически значимы (p < 0,05). Динамика показателей по группам представлена на рис. 2.
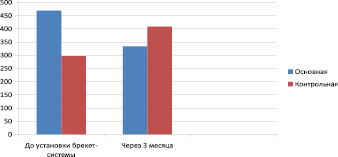
Рис. 2. Динамика содержания α-дефензина (пг/мл) в слюне пациентов основной и контрольной групп
Среднее содержание антимикробного пептида в слюне до установки брекет-системы имеет статистически значимые различия по группам: в основной группе отмечался более высокий уровень содержания α-дефензина, чем в контрольной группе. Однако через 3 месяца ношения брекет-системы в основной группе происходит снижение содержания α-дефензина, а в контрольной – его увеличение. Так, клиническая картина и состояние индекса гигиены у пациентов основной группы свидетельствовали о наличии воспалительных процессов в тканях пародонта.
Заключение
Таким образом, приведенные данные позволяют считать, что снижение уровня α-дефензина у больных с хроническим катаральным гингивитом, находящихся на ортодонтическом лечении, может служить прогностическим критерием при развитии воспалительных процессов в тканях пародонта в процессе лечения зубочелюстных аномалий несъемной аппаратурой.
Рецензенты:
Герасимова Л.П., д.м.н., профессор, заведующий кафедрой терапевтической стоматологии, ГБОУ ВПО «Башкирский государственный медицинский университет» Минздрава РФ, г. Уфа;
Анохина А.В., д.м.н., профессор, зав. кафедрой терапевтической и детской стоматологии и ортодонтии ГБОУ ДПО КГМА Минздрава РФ, г. Казань.
Работа поступила в редакцию 03.04.2014.



