При хронических вирусных гепатитах в развитие воспалительного процесса в печени вносит вклад активация механизмов перекисного окисления липидов (ПОЛ), негативными последствиями которого может быть стимуляция фиброгенеза и прогрессирование патологического процесса в инфицированной печени [2, 11]. Ряд исследователей при хроническом гепатите С (ХГС) и циррозах печени отмечают повышение концентрации малонового диальдегида (МДА) как интегративного показателя интенсивности ПОЛ, зависящие от степени тяжести патологического процесса и более выраженные при циррозах печени независимо от этиологии [2, 5, 7, 10]. Антиоксидантная система (АОС) определяет устойчивость гепатоцитов к действию свободных радикалов и лимитируют эффекты окислительного стресса [4]. В отношении активности ферментов АОС в литературе встречаются достаточно противоречивые сведения. Очевидно, это объясняется многокомпонентностью её структуры, многообразием применяемых методических подходов к оценке этой системы, в том числе определением активности ферментов в эритроцитах, сыворотке, плазме крови или в биоптатах печени, а также гетерогенностью обследованных по степени поражения печени. Некоторые авторы считают, что активность ферментов в эритроцитах отражает процессы, происходящие в гепатоцитах. В литературе встречаются данные о повышении активности ферментов глутатиона в эритроцитах при токсических и вирусных гепатитах [3]. Другие авторы при заболеваниях печени находили нормальной общую антиоксидантную активность в сыворотке крови [9]. В некоторых исследованиях при ХГС отмечено снижение уровня глутатиона, другие исследователи выявили повышение активности ферментов системы глутатиона в биоптатах печени при гепатите и циррозе [10]. Опубликованы данные о наличии корреляций глутатионтрансферазы (ГЛТ) при ХГС с аланиновой трансаминазой (АЛТ) и рекомендовано использовать определение этого фермента для мониторинга повреждения печени, а показатели ПОЛ и АОС оценивать в качестве дополнительных неинвазивных маркеров активности ХГС [2].
Известно, что на прогрессирование поражения печени при ХГС оказывает влияние генетическая предрасположенность пациентов к развитию цирроза печени [8]. В этом отношении интерес представляет изучение генов ферментов семейства глутатионтрансфераз осуществляющих конъюгацию сульфгидрильной группы глутатиона с ксенобиотиками или их метаболитами. Данная реакция играет ведущую роль в защите клеток от свободных радикалов. Выявлена ассоциация полиморфных вариантов с генотипом GG и AG гена ГЛТ (GSTP1) (ile105Val) и летальным исходом в течение 4 лет у больных циррозом печени, которая в 2,5 раза была выше, чем у больных с генотипом АА [6].
В настоящее время «золотым стандартом» противовирусной терапии хронического гепатита С (ХГС) является пегилированный интерферон в сочетании с рибавирином. Комбинированная противовирусная терапия обеспечивает устойчивый вирусологический ответ в среднем у 50–60 % больных хроническим гепатитом С, актуальной остается задача повышения эффективности лечения [1]. В этой связи представляется целесообразным изучение взаимосвязи интенсивности ПОЛ, активности фермента ГЛТ, а также влияние полиморфизма гена ГЛТ на прогрессирование поражения печени при ХГС.
Цель исследования – изучить концентрацию МДА и активность ГЛТ в сыворотке крови больных ХГС, их взаимосвязи с тестами цитолиза, фиброза, регенерации гепатоцитов и полиморфизмом гена GSTP1 (ile105Val) и исследовать динамику тестов после комбинированной противовирусной терапии.
Материалы и методы исследования
Обследовано 96 пациентов с ХГС в фазе реактивации. Средний возраст больных составил 38,3 ± 10,4 года, из них 46 мужчин и 50 женщин. Сопоставимая по полу и возрасту контрольная группа включала 80 практически здоровых лиц (доноров), не имеющих заболеваний печени. Исследование активности АЛТ в сыворотке крови проводилось на автоматическом биохимическом анализаторе «Architect-4000» (США). Концентрацию МДА в сыворотке крови определяли по реакции с тиобарбитуровой кислотой фотометрически методом А. Кона и В. Ливерсейджа в модификации Ю.В. Владимирова и А.В. Арчакова (1972) при длине волны 540 нм у всех пациентов. Активность фермента ГЛТ в сыворотке крови исследовали фотометрически при длине волны 340 нм у 50 больных по методу Habigetal V.H. (1974). Концентрацию гиалуроновой кислоты (ГК) – прямого маркера фиброза печени в сыворотке крови изучали с помощью набора ВСМ Diagnostics (США) методом ИФА на анализаторе «Stat-Fax» (США) у 96 больных. В качестве теста регенерации гепатоцитов оценивали уровень альфа-фетопротеина (АФП) иммунохемилюминесцентным методом с помощью набора «AFP» (Siemens) на анализаторе «Immulitе-1000» (Германия) у 50 больных. В группе контроля уровень АЛТ исследовали у 80 практически здоровых лиц, концентрацию МДА, ГК, АФП и активность ГЛТ определяли у 20 человек. Полиморфные варианты маркера ile105Val гена GSTP1 изучали методом аллель-специфической ПЦР (ЗАО «Синтол», г. Москва) на амплификаторе Real-time «CFХ-96» Bio-Rad Laboratories, Inc. (США). Для определения генотипов указанного гена у всех пациентов с ХГС и 80 здоровых доноров проводилось выделение ДНК из цельной венозной крови, предварительно стабилизированной ЭДТА.
Исследование показателей АЛТ, МДА, ГЛП и АФП после проведенного курса комбинированной противовирусной терапии проводилось 35 больным ХГС, из которых 10 человек получали противовирусный препарат пегинтрон, 13 пациентов – альтевир, а 12 больных – лайфферон по стандартной схеме. В качестве комбинирующего препарата все пациенты с ХГС получали рибавирин.
Статистическую обработку полученных результатов проводили с использованием программы Statistica 6.0 (StatSoft). Проверку распределения результатов с помощью критерия Колмогорова-Смирнова. Для описания полученных количественных признаков данные представляли в виде среднего арифметического (М) ± одно стандартное отклонение (SD), минимума (min) и максимума (max). Так как распределение показателей отклонялось от нормального, для оценки значимости различий независимых групп использовали непараметрический критерий Манна-Уитни. Для описания соотношения частот генотипов и аллелей генов использовали равновесие Харди-Вайнберга. Исследуемые группы находились в равновесном (устойчивом) состоянии по частотам генотипов изученного гена (р > 0,05). Различия в двух популяциях рассчитывались по отношению шансов (OR) с использованием подхода «случай-контроль» для различных моделей наследования: аддитивной, общей, мультипликативной, доминантной и рецессивной и считались достоверными при р < 0,05. Количественная оценка линейной связи между двумя независимыми величинами определялась с использованием коэффициента ранговой корреляции по Спирмену (r). Значимость различий между выборками и взаимосвязей показателей считалось достоверной при значении для р < 0,05.
Результаты исследования и их обсуждение
У пациентов с ХГС в фазе реактивации было выявлено достоверное по сравнению с контрольной группой повышение активности АЛТ в сыворотке крови (табл. 1). На фоне хронического воспалительного процесса в печени определено повышенное содержание МДА в сыворотке крови, что отражает активацию процессов ПОЛ. Среднее значение концентрации МДА в крови почти в 3,6 раза превышало уровень этого теста в группе контроля (р < 0,001).
Таблица 1
Исследуемые показатели у больных ХГС и в контрольной группе М ± SD; [Min-Max]
|
Показатель, единица измерения |
Группа контроля |
Пациенты с ХГС до лечения |
р |
|
АЛТ, Е/л |
15 ± 7,45; [5,0-40,0] |
76,41 ± 54,22; [15,0-261,0] |
< 0,001 |
|
МДА, мкмоль/л |
2,18 ± 1,04; [1-4,4] |
7,8 ± 3,6; [1,6-16] |
< 0,001 |
|
ГЛТ, мкмоль/мин/л |
10,89 ± 1,81; [8,1-13,2] |
20,97 ± 5,28; [11-36] |
< 0,001 |
|
ГК, нг/мл |
24,12 ± 20,18; [0-63,3] |
68,15 ± 82,9; [11,0-551,0] |
0,002 |
|
АФП, МЕ/мл |
1,28 ± 0,53; [0,5-2,64] |
3,39 ± 4,02; [1,04-27,4] |
< 0,001 |
Примечание. р – значимость различий показателей в исследуемых группах.
Активность ГЛТ у больных ХГС была повышена в среднем в 2 раза по сравнению с практически здоровыми лицами (р < 0,001). При этом соотношение средних величин ГЛП/МДА в контрольной группе составило 5,0, а в основной группе – 2,7. Можно предположить, что на фоне повышения интенсивности ПОЛ при ХГС возникает относительный дефицит активности такого значимого антиоксидантного фермента как ГЛП. Содержание ГК в крови у больных ХГС было повышено, при этом средняя величина в 2,8 раз превышала уровень показателя в группе практически здоровых лиц (р = 0,002), что отражает активацию фиброза при хроническом воспалении в печени. Концентрация АФП, маркера регенерации гепатоцитов, у пациентов с ХГС была в 2,6 раз выше, чем в контрольной группе (р < 0,001).
При анализе однонуклеотидной замены (SNP) в гене GSTP1 (ile105Val) распространенность гомозигот по аллелю А (АА) в группе здоровых и больных гепатитом составила соответственно 60 % и 49 %, но различия были не достоверны (χ2 = 2,147 р = 0,34) по общей и по другим моделям наследования (рисунок).
Встречаемость патологических гомозигот (GG) в группе контроля и у больных ХГС составила по 9 % и 10 % соответственно (χ2 = 0,00; р = 0,98). Частота выявления гетерозиготы AG значимо не отличалась и составила 31 % у здоровых и 41 % при ХГС (χ2 = 2,14; р = 0,14). Не было достоверного различия также и в соотношении частот аллелей изучаемого маркера в группах сравнения: встречаемость минорного аллеля G составила 24 % в группе контроля, 31 % в основной группе (χ2 = 1,75; р = 0,19). Хотя следует отметить некоторое, хотя и не достоверное, преобладание у больных ХГС гетерозигот AG и частоты встречаемости патологического минорного аллеля G. Таким образом, в ходе исследования не было установлено статистически значимого отличия частот генотипов и аллелей гена GSTP1 (ile105Val) между группами здоровых лиц и больных ХГС. Но, учитывая тенденцию к преобладанию среди обследованных пациентов с ХГС носителей патологического аллеля G и литературные данные об ассоциации полиморфных вариантов этого гена с высокой летальностью больных циррозом печени в исходе вирусного гепатита, следует учитывать такой генетический фактор при прогнозировании течения вирусного гепатита [6].
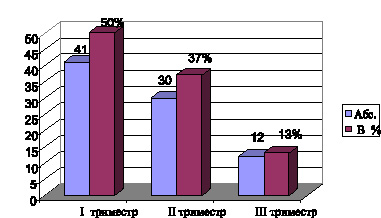
Распространенность генотипов и аллелей полиморфизма ile105Val гена GSTP1 у больных ХГС и в группе контроля
При корреляционном анализе концентрация МДА и активность ГЛП продемонстрировали прямые достоверные взаимосвязи с АЛТ и между собой, что указывает на ассоциацию цитолиза гепатоцитов с активацией процессов пероксидации липидов и компенсаторным увеличением функции антиоксидантной системы при ХГС (табл. 2).
Таблица 2
Взаимосвязи ГЛТ с МДА, АЛТ, маркерами фиброза и регенерации печени при ХГС
|
Показатели |
r |
p |
|
МДА и АЛТ |
0,33 |
0,02 |
|
МДА и ГЛТ |
0,41 |
0,01 |
|
ГЛТ и АЛТ |
0,45 |
0,01 |
|
ГЛТ и ГК |
0,43 |
0,013 |
|
ГЛТ и АФП |
0,54 |
0,02 |
Примечание. r – взаимосвязь показателей; р – значимость корреляции.
Следовательно, повышение активности ГЛТ на фоне интенсификации ПОЛ усиливается по мере нарастания тяжести поражения печени, оцениваемого по выраженности биохимического показателя цитолиза. Удалось также выявить прямые достоверные корреляции активности ГЛТ с маркером фиброза – ГК и уровнем АФП. То есть, при ХГС на фоне оксидантного стресса происходит стимуляция развития соединительной ткани и повышенной регенерации гепатоцитов, что вносит вклад в нарушение архитектоники печени и в целом в прогрессирование заболевания от гепатита к циррозу. При этом активность ГЛТ является более информативным тестом для оценки тяжести и прогрессирования поражения печени при ХГС по сравнению с МДА.
После проведенного курса комбинированной противовирусной терапии элиминация вируса по результатам ПЦР достигнута у 94 % больных ХГС. При этом отмечено снижение уровня АЛТ в 3,8 раз (р < 0,001), концентрации МДА в 2,5 раз (р < 0,001) и активности ГЛТ в 2,4 раза (р < 0,001) (табл. 3). Следует отметить, что среднее значение ГЛТ после лечения у больных ХГС достоверно не отличалось от этого параметра в группе контроля (р = 0,1), что свидетельствует о полной нормализации активности этого фермента. Уровень МДА в исследуемой группе больных после противовирусной терапии значительно снизился, при этом отличие между средними показателями со здоровыми составило 42 %, а до лечения у пациентов с ХГС было повышение в 3,6 раз. Тем не менее концентрация МДА все же полностью не нормализовалась по сравнению с группой контроля (р = 0,01). Средняя концентрация АФП после лечения также значительно снизилась, уменьшился и разброс показателей, хотя и не достоверно (р = 0,05). Возможно, сохранение выработки АФП у больных выше показателей в контрольной группе связано с продолжающейся регенерацией печени на фоне элиминации вируса.
Таблица 3
Исследуемые показатели у больных ХГС после противовирусной терапии
|
Показатель, единица измерения |
М ± SD; [Min- Max] |
р |
|
АЛТ, Е/л |
26,82 ± 22,75; [4,9-133,0] |
< 0,001 |
|
МДА, мкмоль/л |
3,1 ± 1,15; [1,2-4,8] |
< 0,001 |
|
ГЛТ, мкмоль/мин/л |
8,72 ± 3,22; [4,5-15,7] |
< 0,001 |
|
АФП, МЕ/мл |
2,19 ± 1,27; [0,7-9,32] |
0,05 |
Примечание. р – значимость различий показателя до и после лечения.
Таким образом, комбинированная противовирусная терапия у больных ХГС, помимо уменьшения выраженности цитолиза гепатоцитов, приводит к значительному снижению интенсивности ПОЛ и нормализации активности антиоксидантного фермента ГЛТ на фоне элиминации вируса.
Выводы
1. У больных ХГС в фазе реактивации выявлено повышение концентрации МДА и активности ГЛТ в сыворотке крови, что отражает активацию процессов пероксидации липидов и механизмов антиоксидантной защиты на фоне хронического воспалительного процесса в печени.
2. На фоне ХГС в фазе реактивации заболевания повышена концентрация ГК и АФП, что свидетельствует о стимуляции фиброза и процессов регенерации в печени.
3. Активность ГЛТ и концентрация МДА ассоциированы с тяжестью поражения печени по выраженности биохимического маркера цитолиза гепатоцитов – АЛТ.
4. У больных ХГС выявлена взаимосвязь активности ГЛТ с маркерами фиброза и регенерации печени, что свидетельствует о роли фермента в прогрессировании заболевания.
5. В ходе исследования не было установлено статистически значимого отличия частоты встречаемости генотипов и аллелей гена GSTP1 (ile105Val) между группами здоровых лиц и больных ХГС.
6. Эффективная комбинированная противовирусная терапия у больных ХГС приводит к значительному уменьшению оксидантного стресса, что сопровождается снижением выработки МДА и нормализацией активности ГЛП.
Рецензенты:Устинова О.Ю., д.м.н., профессор, заместитель директора по лечебной работе, ФБУН «Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения», г. Пермь;
Юшкова Т.А., д.м.н., профессор кафедры фармакологии, ГБОУ ВПО «Пермская государственная фармацевтическая академия», г. Пермь.
Работа поступила в редакцию 14.03.2014.



