Современная биотехнология изучает общие и частные вопросы использования микроорганизмов в микробиологическом синтезе биологически активных веществ, производстве разнообразных препаратов, разрабатывает технологии применения микроорганизмов в различных областях промышленности, создаёт системы микробиологической деградации технических материалов и отходов производств. Биотехнологические товары представлены на мировом и отечественном рынке в фармацевтическом секторе, агропищевом секторе, промышленной биотехнологии, биоэнергетики и секторе так называемых веществ из возобновляемых источников сырья (renewable chemicals).
Бактерии E. coli играют важную роль в современной промышленной микробиологии, биологической инженерии и биофармацевтике. Научные публикации с результатами исследований по биохимии, физиологии, молекулярной и общей биологии бактерий рода Escherichia позволяют довольно широко их использовать как при производстве препаратов-пробиотиков, так и в качестве модельных микроорганизмов при проведении исследований в области биотехнологического синтеза [1]. Некоторые штаммы E. coli являются продуцентами ферментов, используемых в пищевой биотехнологии, и реципиентами для клонируемых генов эукариот и прокариот [3].
В «Комплексной программе развития биотехнологий в Российской Федерации на период до 2020 года» указано, что для инновационного развития современной экономики ключевыми являются три направления развития технологий: информационные технологии, нанотехнологии и биотехнологии. В качестве одной из первоочередных задач развития биотехнологии определено создание новых производственных технологий и повышение эффективности существующих технологий производства продуктов биотехнологического синтеза [5].
В последние годы авторами проводятся исследования, связанные с оценкой возможности использования перфторорганических соединений (ПФОС) с газотранспортной функцией с целью интенсификации скорости роста и повышения биосинтетической продуктивности микроорганизмов различных групп при глубинном культивировании для последующего внедрения полученных результатов в биотехнологическое производство [2]. Доказано, что перфторорганические соединения обладают уникальными свойствами и находят широкое применение в трансфузиологии, хирургии, реаниматологии и других областях медицины [4]. Однако применение ПФОС в других областях биологической науки и в биотехнологии пока не нашло достойного обсуждения и реализации. На наш взгляд, биотехнология стоит на пороге прорыва и цепной реакции в расширении направлений и областей использования ПФОС. Спрос для биотехнологии на ПФОС ввиду их уникальных газотранспортных свойств в ближайшие годы должен возрасти в десятки и сотни раз. Теоретическому и практическому рассмотрению перспективности использования ПФОС в биотехнологических процессах, связанных с глубинным выращиванием микроорганизмов, посвящена данная научная работа.
Целью работы являлась оценка возможности интенсификации темпов роста E.coli M-17 при глубинном культивировании с использованием перфторорганических соединений в качестве стимулятора роста.
Материалы и методы исследований
Для оценки возможности влияния перфторорганических соединений на интенсификацию роста микроорганизмов в экспериментах по глубинному культивированию микроорганизмов использовали перфтордекалин (ПФД) производства ОАО «Кирово-Чепецкий химкомбинат им. Б.П. Константинова». В качестве культивируемого биообъекта использовали выделенную из пробиотического препарата «Колибактерин» культуру штамма E. coli М-17. Режим культивирования отрабатывался на лабораторном ферментере BIOSTAT®plus фирмы Sartorius (Германия) с рабочим объёмом колбы для культивирования 1,5 дм3. Температурный оптимум роста культуры проводился при 37 °С. Жидкая питательная среда (ЖПС), приготовленная по рекомендованным прописям и технологиям [6] содержала мясную воду – 700 см3; водопроводную воду – 700 см3; сухой пептон – 1 % и хлорид натрия – 0,5 % (по массе). Интенсивность роста культуры E.coli M-17 оценивали методом высева серийных разведений отобранных в разные промежутки времени проб культуральной жидкости на плотную питательную среду Эндо. Режим автоклавирования питательных сред, тонкостенной лабораторной посуды для вспомогательных коммуникаций для ведения процесса и перфторорганических соединений для внесения в питательную среду отрабатывался на лабораторном автоклаве Tuttnauer (США).
Результаты исследования и их обсуждение
В ходе предварительных экспериментальных исследований авторами была оценена устойчивость ПФД к наиболее часто используемой манипуляции с компонентами микробиологических питательных сред – стерилизации. Экспериментально проанализирован основной метод стерилизации питательных сред – стерилизация паром под избыточным давлением (автоклавированием) при температурном воздействии пара в 126 °С, что соответствовало избыточному давлению в 1,5 атмосфер. При этом была выбрана экспозиция в 60 минут. После проведения стерилизации проб ПФОС в стеклянных пробирках по 7 мл оценивали внешний вид, массу стерилизуемого перфтордекалина и чувствительность к ним исследуемой культуры бактерий. Необходимо отметить, что в процессе и после стерилизации перфтордекалина автоклавированием при использованном режиме он не изменил своего исходного внешнего вида и исходной массы даже после пяти циклов стерилизации. Результаты оценки чувствительности бактерий, представленные в таблице к анализируемому ПФОС до и после стерилизации показали отсутствие ингибирующего действия перфтордекалина на жизнеспособность и развитие бактерий в жидкой среде в статических условиях при периодическом встряхивании.
Более того, при выращивании бактериальной культуры отмечалась выраженная тенденция к увеличению скорости роста культуры и выхода общего количества бактериальных клеток в 2 раза (при концентрации перфтордекалина в среде 0,5–2,5 %). Дальнейшее повышение концентрации перфтордекалина не приводило к увеличению выхода биомассы использованного штамма, это позволяет предположить, что оптимальная концентрация перфтордекалина в среде находится в диапазоне 0,5–12,5 %. Учитывая то, что выход биомассы был максимальным при концентрации в среде 5 %, следует признать эту концентрацию оптимальной для данного этапа исследований.
Результаты оценки действия различных концентраций перфтордекалина в жидкой питательной среде на клетки E.coli M-17
|
Содержание в среде перфтордекалина, % |
Концентрация клеток (⋅107) КОЕ/мл бактерий после выращивания в течение 48 часов в жидкой питательной среде с перфтордекалином стерилизованным … |
||||
|
контроль |
111 °С, 30 мин * |
134 °С, 60 мин |
134 °С, 60 мин |
фильтрацией |
|
|
0 |
16 |
16 |
16 |
16 |
16 |
|
0,1 |
15 |
17 |
17 |
15 |
16 |
|
0,5 |
27 |
26 |
28 |
29 |
28 |
|
5 |
47 |
48 |
45 |
48 |
48 |
|
12,5 |
45 |
46 |
44 |
46 |
47 |
В ходе основного эксперимента – оценки возможности интенсификации динамики роста E.coli M-17 при внесении в питательную среду перфтордекалина ‒ последовательно проводили два эксперимента по глубинному культивированию микроорганизмов (эксперимент № 1 и эксперимент № 2). В эксперименте № 1 использовали жидкую питательную среду без добавления ПФД, в эксперименте № 2 в жидкую питательную среду добавляли ПФД 5 об. %. Температурные параметры, показатели рН, состав питательной среды, плотность посева и прочие технологические параметры процесса в экспериментах задавали в обоих экспериментах одинаковыми. При выполнении эксперимента № 2 введение ПФД (5 об. %) производили после инокуляции посевной культуры в колбу с жидкой питательной средой.
Время начальной фазы роста E.coli M-17 в жидкой питательной среде с добавлением ПФД сократилось более чем в 1,5 раза по сравнению с временем роста культуры в среде без ПФД. При этом продолжительность фазы экспоненциального роста в эксперименте с ПФД уменьшилась в 1,6 раза.
Время выхода роста культуры E.coli M-17 на стационарную фазу при культивировании в жидкой питательной среде с ПФД составило 5,0 часа, без добавления ПФД – 5,8 часа. Определение общего количества живых клеток по результатам подсчета выросших колоний свидетельствует о том, что в эксперименте № 2 с добавлением ПФД количество микроорганизмов составило 5,0 ± 0,3 млрд. живых микробных клеток в 1 см3 полученной культуральной жидкости, в эксперименте № 1 без добавления ПФД – 3,5 ± 0,3 млрд живых микробных клеток в 1 см3 полученной культуральной жидкости (рисунок).
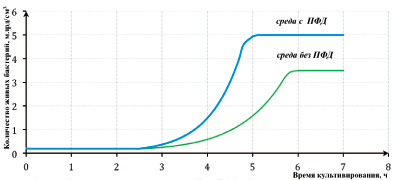
Динамика роста культуры E.coli M-17
Заключение
В настоящей работе на примере бактерий E.coli M-17 экспериментально обоснована возможность использования ПФД как вещества, обеспечивающего при культивировании на лабораторном ферментере BIOSTAT®plus фирмы Sartorius интенсификацию роста культуры E.coli M-17, проявляющуюся сокращением времени культивирования и увеличением биомассы культивируемого биообъекта.
Можно высказать предположение, что данные результаты (по аналогии с процессами, описанными для клеток эукариот), получаются за счет более интенсивного транспорта в бактериальную клетку наноконтейнерами на основе перфторуглеродов основных компонентов жидкой питательной среды, необходимых для построения структуры клеток и последующего деления бактерий [4].
Рецензенты:Погорельский И.П., д.м.н., профессор, ведущий научный сотрудник НИЦ ФГКУ «33 ЦНИИИ» Минобороны России, г. Киров;
Рылов А.В., д.м.н., профессор, заместитель генерального директора по научной и испытательной работе, ФГБУ РМНПЦ РОСПЛАЗМА ФМБА России, г. Киров.
Работа поступила в редакцию 26.02.2014.



