Исследование механизмов, лежащих в основе репаративных процессов в травмированных тканях, в настоящее время продолжает оставаться актуальной проблемой клеточной биологии. В этом аспекте особо важными представляются поиск и изучение различных факторов, способствующих восстановлению структуры и функции патологически измененных тканей. Ранее было показано, что биорегулятор, выделенный из сыворотки крови крупного рогатого скота, проявляет выраженное ранозаживляющее свойство на моделях экспериментальной кожной раны и роговицы глаза у млекопитающих in vivo: в обоих случаях происходило полное восстановление морфологически нормальной структуры тканей [3, 7].
Биорегулятор, выделенный из сыворотки крови, является одним из представителей новой группы биорегуляторов, получившей название мембранотропных гомеостатических тканеспецифических биорегуляторов (МГТБ), которая была обнаружена в различных тканях позвоночных животных и растений [4, 6, 10, 11]. Основу биорегуляторов данной группы составляет пептидно-белковый комплекс, причем за проявление биологической активности МГТБ ответственны пептиды с мол. массами 1000–6000 Да, которые взаимодействуют с определенными белками, модулирующих их действие [8]. МГТБ локализованы внеклеточно, они проявляют мембранотропную активность, оказывают влияние на основные биологические процессы (миграцию, адгезию, пролиферацию, дифференцировку клеток, апоптоз). Биологическое действие МГТБ проявляется в сверхмалых дозах (СМД, 10–7-10–15 мг белка) и характеризуется наличием тканевой специфичности [12]. Позже был исследован биорегулятор, выделенный из подорожника большого, который также в СМД проявлял выраженное ранозаживляющее свойство у мышей in vivo [6]. Следует отметить, что ранозаживляющее действие биорегуляторов, выделенных, соответственно из сыворотки крови быка и из листьев подорожника большого, различалось: сывороточный биорегулятор вызывал практически полное восстановление нормальной структуры кожи – происходила не только полная реэпителизация раны, но в области раны восстанавливались волосяные фолликулы, подкожная жировая клетчатка, железы, мышечные волокна; в случае действия биорегулятора, выделенного из подорожника большого, наблюдали образование большого количества подкожного жира, восстановление желез, проходила реэпителизация, но волосяные фолликулы и мышечные волокна не восстанавливались. Безусловный интерес представляло исследование биорегуляторов данной группы, выделенных из других таксономических групп.
Целью настоящей работы явилось сравнительное исследование ранозаживляющего действия пептидной компоненты нескольких биорегуляторов, выделенных из таких растений как алоэ древовидный, зверобой, кабачок, укроп пахучий. Отдельно был исследован МГТБ, выделенный из моллюска пресноводной жемчужницы. Известно, что его личинки (глохидии) после закрепления на поверхности жабр рыбы-хозяина стимулируют образование вокруг своего тела эпителиальной капсулы [14]. Учитывая это, можно было предположить, что глохидии пресноводной жемчужницы могут стимулировать восстановление покровного эпителия посредством некоторых биологически активных веществ, входящих в состав вырабатываемого ими секрета.
В качестве препарата сравнения были выбраны биологически активные пептиды биорегулятора, выделенного из листьев подорожника большого, который, как мы ранее показали, обладал выраженным ранозаживляющим действием [6].
Материалы и методы исследования
В работе для получения растительных экстрактов использовали листья таких растений, как подорожник большой (Plantago major), алоэ древовидное (Alóe arboréscens), кабачки (Cucurbita pepo), укроп пахучий (Anethum graveolens), зверобой продырявленный (Hypericum perforatum). Фракции пептидов, входящих в состав биорегуляторов исследуемых растений, а также моллюска Margaritifera margaritifera, получали следующим образом.
Cвежесобранные нарезанные листья каждого растения по отдельности помещали в экстрагирующий раствор (2,06∙10–2 М NH4NO3; 1,88∙10–2 М KNO3; 3∙10–3 М CaCl2∙2H2O; 1,5∙10–3 М MgSO4∙7H2O; 1,25∙10–3 М KH2PO4) на 4–5 часов при +4 °С (на 500 г зеленой массы использовали 1000 мл р-ра). Полученные экстракты отфильтровывали через несколько слоев марли, затем центрифугировали при 3000 g в течение 30 мин. Образовавшийся осадок отделяли от основного раствора, который далее очищали методом высаливания белков.
Для получения экстракта, содержащего секрет глохидиев моллюска, 50 взрослых особей, помещенных в речную воду, из которой они были взяты, аккуратно нагревали до температуры не более 45 °С. В этих условиях напряжение мускулатуры, закрывающей створки раковин, значительно уменьшалось, и створки можно было аккуратно разжать. Производили смыв с тканей моллюска, получая таким образом экстракт секрета жабр моллюска, в которых содержатся глохидии. Полученный экстракт сохраняли, добавляя азид натрия (0,1 мг на 100 мл экстракта) и далее из него получали фракцию пептидов, входящих в состав биорегулятора, путем высаливания белков сульфатом аммония.
К каждому полученному экстракту при постоянном перемешивании добавляли сухой сернокислый аммоний до образования насыщенного раствора соли (780 г/л), поддерживая рН раствора 7,5–8,0 путем добавления раствора гидроксида аммония. Образовавшуюся смесь оставляли на 7 суток при +4 °С, затем центрифугированием при 10 000 g в течение 30 мин отделяли образовавшийся осадок, который далее не исследовали. Фракции надосадочной жидкости (супернатанта) подвергали диализу против воды через полунепроницаемую мембрану при +4 °С для удаления ионов аммония. Супернатанты, выделенные из всех растительных экстрактов и экстракта моллюска, концентрировали в роторном вакуумном испарителе (35 °С) и далее исследовали их мембранотропную активность адгезиометрическим методом [9], фракционировали обращенно-фазовой ВЭЖХ, изучали с помощью электрофореза в ПААГ, методами масс-спектрометрии, а также в экспериментах по ранозаживлению кожи у мышей in vivo.
Концентрацию белка определяли спектрофотометрически [1].
Определение размеров частиц в растворах фракций выполняли методом динамического рассеивания света на приборе «PhotoCor Complex» (фирма «ФотоКор», Россия), снабженном автоматическим гониометром, мультивременным коррелятором реального времени «PhotoCor-FC» и гелий-неоновым лазером «Uniphase 1135P» мощностью 20 мВт (λ = 633 нм) в качестве источника света. Измерения проводили при угле рассеяния 90 °С и температуре 25 °С. Пыль из растворов удаляли путем фильтрования через мембраны «Durapore» с диаметром пор 0,22 мкм («Millipore»). Определяли гомодинную корреляционную функцию интенсивности G(2)(t) в интервале времен задержки от 2∙10–8 до 103 с. Распределение по временам корреляции получено методом обратного преобразования Лапласа с использованием программы CONTIN. Для перехода от времен корреляции (τ) к гидродинамическому радиусу (Rh) использовали следующие соотношения D = 1/q2τ и D=kT/6phRh, где h – вязкость растворителя; k – константа Больцмана; D – коэффициент диффузии; q – волновой вектор.
Обращенно-фазовую ВЭЖХ осуществляли на колонке Hypersil ODS C18 (4.6 × 250 мм) «Thermo Scientific» (Швейцария), уравновешенную водным раствором 0.1 % трифторуксусной кислоты, рН 2.2, и подвергали ВЭЖХ с обращенной фазой на хроматографе высокого давления «Agilent 1100 Series» (США). Связавшийся с сорбентом материал элюировали градиентом концентрации 5–80 % ацетонитрила в 0,1 % трифторуксусной кислоте, рН 2.2, в течение 90 мин. Скорость элюции – 1 мл/мин. Содержание продуктов определяли спектрофотометрически при 210 нм.
Масс-спектрометрический анализ осуществляли на времяпролетном MALDI-TOF масс-спектрометре UltraFlex 2 («Bruker Daltonics», Германия), оснащенном азотным лазером 337 нм с частотой импульса до 20 Гц. Все измерения проводили в линейном и рефлекторном режиме, определяя положительные ионы. Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции-ионизации образца. Внешнюю калибровку проводили с использованием точных значений молекулярных масс известных белков. Образец наносили на три ячейки планшета, для каждой из которых записывали спектр, полученный в результате суммирования 10 серий спектров по 50 импульсов лазера для каждой. Для записи, обработки и анализа масс-спектров использовали программное обеспечение фирмы «Bruker Daltonics» (Германия): flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11). Точность измерения масс составляла ±2 Да. В качестве матрицы использовали насыщенный раствор α-циано-4-гидроксикоричной кислоты («Sigma-Aldrich», Германия) в смеси 50 %-го ацетонитрила и 2,5 %-й трифторуксусной кислоты. Все использованные реактивы, включая воду, были аналитической или специальной для масс-спектрометрии чистоты.
Эксперимент по исследованию ранозаживления кожи проводили на мышах-гибридах F1, самцы, весом 20–22 г – 80 животных. У мышей, наркотизированных эфиром, на спине выщипывали шерсть и вырезали лоскут кожи диаметром около 1 см.
Животных разделяли на 8 групп. 1-я (контрольная) группа – рана заживала первичным натяжением; 2-я (контрольная) группа – в рану ежедневно наносили физиологический раствор. В опытных группах раны ежедневно обрабатывали растворами фракций супернатантов, выделенных соответственно из экстрактов пресноводной жемчужницы (группа 3), листьев кабачков (группа 4), подорожника большого (группа 5), алоэ древовидного (группа 6), укропа пахучего (группа 7), зверобоя продырявленного (группа 8). Растворы изучаемых фракций пептидов биорегуляторов в СМД приготавливали путем последовательного десятикратного разбавления исходных фракций супернатантов, исследовали дозы 10–11–10–14 мг белка. На 11-е сутки после нанесения ран, животных выводили из эксперимента в атмосфере эфира, вырезали фрагменты кожи вокруг раны. Исследования кожных ран проводили на поперечных гистологических срезах толщиной 7 мкм. Срезы окрашивали гематоксилином и эозином, просматривали и фотографировали на микроскопе «Leica» (Германия).
Результаты исследования и их обсуждение
Согласно разработанному экспериментальному подходу для исследования МГТБ и отдельных его компонентов данные биорегуляторы выделяют из тканей животных и растений путем экстракции. Наиболее изученной является биологически активная фракция, получаемая из тканевых экстрактов в насыщенном растворе сульфата аммония – супернатант, которая содержит в основном, биологически активные низкомолекулярные пептиды [9, 11]. В настоящем исследовании использовали данные фракции, которые получали из экстрактов листьев растений, а также секрета моллюска Margaritifera margaritifera. Их характеристики представлены в таблице.
Характеристики пептидных фракций, выделенных из растений и моллюска
|
Источник выделения пептидной фракции биорегулятора |
Концентрация (мг белка в мл) |
Размер наночастиц (нм) |
Десятикратное последовательное разбавление фракции, в которой определялась мембранотропная активность |
Дозы пептидных фракций, исследованных в эксперименте по ранозаживлению (мг белка/мл) |
|
Пресноводная жемчужница |
0,025–0,05 |
500–700 |
106–107; 1013–1015 |
10–14 |
|
Кабачок |
0,2–0,4 |
70–80 |
105–107; 10–10–1011 |
10–11 |
|
Подорожник большой |
0,3–0,4 |
100–115 |
103, 105, 107; 1011–1012 |
10–12 |
|
Алоэ древовидное |
0,4–0,5 |
90–100 |
103, 107, 1010–1011 |
10–11 |
|
Укроп пахучий |
0,1–0,2 |
80–90 |
108–109, 1011–1012 |
10–12 |
|
Зверобой продырявленный |
0,1–0,2 |
80–110 |
107–108, 1011–1012 |
10–12 |
Методами обращенно-фазовой ВЭЖХ и MALDI TOF масс-спектометрии было показано, что в исследуемых фракциях содержатся пептиды с мол. массами от 1000 до 5000 Да (рис. 1). На рис. 2 представлена в качестве примера картина разделения фракции, полученной из жемчужницы. Методом оценки мембранотропной активности (метод биотестирования) было показано, что активной является только фракция со временем удерживания 10 мин, в которой масс-спектрометрией показано присутствие небольших пептидов с мол. массой до 4000 Да. В случае разделения супернатантов растительных экстрактов обращенно-фазовой ВЭЖХ были обнаружены несколько активных фракций, которые характеризовались временем удерживания от 4 до 10 мин и от 15 до 30 мин. Полученные данные коррелируют с результатами исследования состава пептидов, входящих в биорегуляторы данной группы, которые были выделены из различных тканей млекопитающих [8].
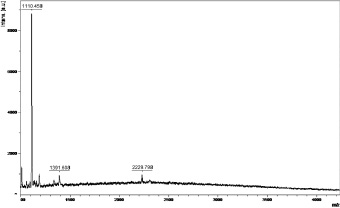
Рис. 1. MALDI-TOF масс-спектр фракции супернатанта укропа пахучего. По оси абсцисс: отношение массы к заряду (m/z); по оси ординат – интенсивность сигнала (относительные единицы)
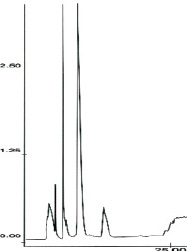
Рис. 2. Обращенно-фазовая ВЭЖХ хроматография фракции супернатанта, выделенной из жемчужницы. По оси абсцисс – время удерживания (мин); по оси ординат – оптическая плотность при длине волны 210 нм. Звездочкой отмечена активная фракция
Для исследования ранозаживляющего действия каждой пептидной компоненты биорегуляторов были выбраны дозы согласно данным оценки мембранотропной активности, которая используется в качестве биотеста для идентификации биорегуляторов данной группы [9].
На рис. 3 представлены микрофотографии гистологических срезов интактной кожи мыши, а также срезов кожи мышей всех экспериментальных групп.
На 11-е сутки после нанесения раны у животных всех групп наблюдали практически полную реэпителизацию, небольшое воспаление в субэпидермальной зоне. У мышей 1-й контрольной группы (необработанная рана) образовывался фиброзный рубец с плотными тяжами коллагеновых волокон (рис. 3, а). При обработке раны физиологическим раствором также наблюдали формирование соединительнотканного рубца, но из-за хронического очага воспаления в области травмы не происходило полной реэпителизации, не формировалась подкожная жировая ткань (рис. 3, б). Гистологическое исследование показало, что у мышей 1-й и 2-й контрольных групп наблюдали развитие воспалительного процесса, неполную эпителизацию области раны, отмечалось нарушение адгезионных взаимодействий между эпителием и дермой, не происходило восстановления протоков желез, в дерме образовывалась рубцовая ткань. В отличие от животных контрольных групп при воздействии фракции, выделенной из пресноводной жемчужницы (3-я группа), происходила полная реэпителизация области раны и наблюдали стимуляцию ранозаживления. Важно отметить, что восстановление эпителия происходило за счет связанных с эпидермисом и нередко открывающихся в него гиперкератинизированных мешочков (эпителиальных мешочков) (рис. 3, в). Они имели вытянутую или неправильную форму и были соединены протоками с сальными железами (рис. 3, г). В них можно наблюдать разрушающиеся волосоподобные филаментозные структуры. Помимо этого, можно наблюдать в дерме хорошо развитые цисты, или пузыри (дермальные цисты), как правило, имеющие округлую форму и окруженные однослойным эпителием. При ранозаживлении эпителиальные мешочки и дермальные цисты начинали мигрировать из глубины дермы к поверхности эпителия, встраивались в эпителиальный слой, тем самым восстанавливая его. Следует также отметить, что данные дериваты волосяных фолликулов были обнаружены при регенерации кожи у безволосых мутантных мышей Hrhr/Hrhr при ожогах in vivo [2, 13]. У мутантных мышей происходило существенное изменение морфологии волосяных фолликулов и нарушалась основная его функция – формирование волоса, но при этом данные дериваты могли являться источниками эпителиальных стволовых клеток и участвовать в репарации при повреждениях [2, 13]. Очевидно, подобный механизм действия реализуется и при ранозаживлении кожи у мышей под влиянием биорегулятора, выделенного из жемчужницы. Обнаруженная аналогия может быть объяснена отсутствием волосяных фолликулов у моллюсков, что имеет место и в результате мутации у мышей Hrhr/Hrhr. Эпителиальная капсула вокруг глохидиев, внедренных в ткани жабр рыб, образуется в течение очень непродолжительного периода времени, сопоставимого с циклом деления эпителиальных клеток (на полное покрытие глохидия эпителиальной тканью уходит около 10 часов) [14]. Можно предположить, что исследование механизмов, лежащих в основе действия пептидной компоненты биорегулятора, который обнаружен в секрете глохидиев пресноводной жемчужницы, приведет к пониманию процессов, возникающих при утрате волосяного покрова у млекопитающих.
Интересно отметить, что сходная картина ранозаживления была отмечена при воздействии пептидной фракции, выделенной из кабачков (рис. 3, г, д). Восстановление эпителия в данном случае было неполным и также происходило за счет образования эпителиальных мешочков. Однако не наблюдалось восстановления сальных и потовых желез, при этом не была развита подкожная жировая ткань. В дерме наблюдали выраженное воспаление.
Совершенно иная картина наблюдалась при воздействии фракций, выделенных из листьев подорожника и алоэ – растений с известным ранозаживляющим действием. Под действием обеих фракций можно наблюдать восстановление нормальной структуры кожи с полной реэпителизацией, с сильно разросшейся подкожной жировой тканью и восстановлением в ней протоков потовых желез, а также полным отсутствием воспаления в дерме (рис. 3, ж, з).
Под действием фракций, выделенных из листьев укропа и зверобоя – растений, не обладающих выраженным ранозаживляющим действием, наблюдали образование фиброзного рубца (Рис. 3, и, к). При этом происходила полная реэпителизация и утолщение эпителия в области раны, была нарушена его адгезия с дермой, в которой наблюдали воспалительные процессы. Следует также отметить, что ни в одной из экспериментальных групп не происходило восстановления волосяных фолликулов в коже на месте раны, которое имело место при воздействии пептидной компоненты биорегулятора, выделенного из сыворотки крови [5, 7].
Полученные данные указывают на то, что восстановление эпителия может происходить за счет различных клеточных источников регенерации в коже (дериваты волосяных фолликулов – область bulge, сальные железы, а также эпителиальные мешочки и дермальные цисты). Поскольку в случае воздействия фракций, выделенных из жемчужницы и кабачка, наблюдается восстановление эпителия за счет измененных дериватов (эпителиальных мешочков и дермальных цист), как у мутантных безволосых мышей Hrhr/Hrhr, представляется вероятным, что данные биорегуляторы способствуют ингибированию гена hairless (hr). Подтверждение этого предположения будет являться предметом отдельного дальнейшего исследования. В связи с этим можно предложить, что пептидные фракции биорегуляторов, выделенных из листьев кабачка и пресноводной жемчужницы, в качестве молекулярных инструментов для исследования процессов, связанных с утратой волосяного покрова у млекопитающих.


а б


в г


д е


ж з


и к
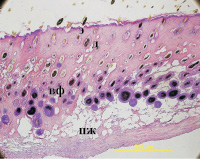
л
Рис. 3. Ранозаживление кожной раны у мыши на 11 сут: а – группа 1 (контроль первичным натяжением); б – группа 2 (контроль с добавлением физиологического раствора в рану); в, г – группа 3 (добавление в рану раствора фракции супернатанта, выделенной из экстракта пресноводной жемчужницы; д, е – группа 4 (добавление в рану раствора фракции супернатанта, выделенной из экстракта листьев кабачков; ж – группа 5 (добавление в рану раствора фракции супернатанта, выделенной из экстракта подорожника большого; з – группа 6 (добавление в рану раствора фракции супернатанта, выделенной из экстракта алоэ древовидного; и – группа 7 (добавление в рану раствора фракции супернатанта, выделенной из экстракта укропа пахучего; к – группа 8 (добавление в рану раствора фракции супернатанта, выделенной из экстракта зверобоя продырявленного; л – нативная кожа мыши. Увеличение а, б, в, д, ж, з, и, к, л – ок. 10, об х 10; г – ок. 10, об. 40; е – ок. 10, об. 20. Окраска гематоксилином и эозином; э – эпидермис, д – дерма, пж – подкожная жировая ткань, с – струп, ппж – протоки потовых желез, вф – волосяные фолликулы; дц – дермальные цисты; эм – эпителиальные мешочки; сж – сальные железы; ов – очаг воспаления
Заключение
Таким образом, сравнительное исследование пептидных компонент биорегуляторов, выделенных из разных таксономических групп, показывает, что фракции, полученные из лекарственных растений, которые используют в народной медицине для репарации кожных дефектов (подорожник, алоэ), проявляют ранозаживляющее действие, выражающееся в полном восстановлении нормальной структуры кожи с сильно разросшейся подкожно-жировой клетчаткой, но без формирования волосяных фолликулов. Пептидные фракции биорегуляторов, выделенных из растений, которые не обладают ранозаживляющим действием – укропа и зверобоя, не влияют на репарацию кожных ран в эксперименте. Совершенно иной характер заживления ран оказывали пептиды биорегуляторов, выделенных из жемчужницы и кабачков: в основном в данном случае происходила реэпителизация раны за счет образования дериватов волосяных фолликулов, характерных для мышей с нарушенным формированием волосяного покрова. Можно предположить, что пептидные компоненты биорегуляторов, выделенных из различных таксономических групп, могут участвовать в различных каскадах реакций, обусловливающих механизмы, лежащие в основе процессов, происходящих при репарации кожных ран у млекопитающих.
Работа выполнена при поддержке грантов РФФИ № 10-04-00706-а и № 12-04-00707-а.
Рецензенты:Домарацкая Е.И., д.б.н., ведущий научный сотрудник, и.о. зав. лаборатории гистогенеза, ФГБУН Института биологии развития им. Н.К. Кольцова РАН, г. Москва;
Григорян Э.Н., д.б.н., зав. лабораторией проблем регенерации ФГБУН Института биологии развития им. Н.К. Кольцова РАН, г. Москва.
Работа поступила в редакцию 26.02.2014.



