История изучения бактерий рода Aeromonas насчитывает более ста лет. Долгое время их считали сапрофитами, но исследования последних лет позволяют отнести их к условным патогенам, вызывающим при определенных условиях заболевания людей и животных [1]. Бактерии рода Aeromonas широко распространены в окружающей среде, их выделяют из речной воды, сточных вод, почвы, от гидробионтов, растений, теплокровных животных [9, 10].
Актуальность разработки методов детекции бактерий рода Aeromonas и в частности Aeromonas hydrophila в пищевой продукции из гидробионтов обусловлена тем, что контаминированные аэромонадами рыбное сырьё и продукция представляют собой источник пищевых и кормовых инфекций человека и животных [6, 8].
Обнаружение и типирование аэромонад является трудоемким и длительным исследованием, затрачивающим до 120 часов [11, 12]. Типирование до рода Aeromonas требует применения сложных и дорогостоящих сред и проведения широкого перечня тестов, что формирует значительный процент ошибочных результатов. Внутривидовая идентификация бактерий данного рода из-за незначительных различий между видами сложна и может служить причиной получения ложных результатов анализов [3, 5,13].
Перечисленное актуализирует необходимость разработки методов индикации бактерий рода Aeromonas, обладающих следующими критериями:
– быстрота исследования,
– простота в применении,
– высокая чувствительность,
– специфичность.
Метод фагодетекции полностью отвечает поставленным задачам [2, 4, 7]. Строгая специфичность бактериофагов позволяет дифференцировать отдельные виды [7]. Согласно литературным данным наборы тест-систем на основе бактериофагов для диагностики аэромонадных инфекций в настоящее время отсутствуют [1, 11, 12, 13].
Для реализации названного метода нами был разработан биопрепарат на основе выделенного и изученного бактериофага Ф43-УГСХА и параметры его применения в схеме фагодетекции.
Материалы и методы исследования
Для выделения бактериофагов были исследованы 103 пробы воды из водоемов Ульяновской области. В качестве индикаторной культуры использовали референс-штамм A. hydrophila A.h.-43, полученный из музея кафедры микробиологии, вирусологии, эпизоотологии и ветеринарно-санитарной экспертизы Ульяновской ГСХА им. П.А. Столыпина. Выделение и изучение биологических свойств фагов проводили по методам, описанным С.Н. Золотухиным (2007), Д.А. Викторовым (2011) [2].
Исследуемый материал предварительно фильтровали через бумажный фильтр для удаления механических примесей. Затем в колбу с концентрированным стерильным мясо-пептонным бульоном вносили пробы материала из такого расчета, чтобы после смешивания получить среду приемлемой концентрации. Туда же добавляли по 1,0 мл 18–24-часовой бульонной индикаторной культуры Aeromonas hydrophila A.h.-43. Колбу с содержимым инкубировали в термостате при 35 °С (оптимальные условия для Aeromonas hydrophila) в течение 24–48 часов. Затем содержимое колбы в количестве 10,0 мл переносили в стерильные пробирки. С целью очистки от бактериальной микрофлоры материал центрифугировали при 3000 об/мин в течение 40 минут. Надосадочную жидкость обрабатывали хлороформом в соотношении 1:10 в течение 10 минут, прогревали в водяной бане при температуре 58–60 °С в течение 30 минут, фильтровали на установке вакуумной фильтрации фирмы «Millipore» через мембранные фильтры с диаметром пор 0,2 мкм. Наличие бактериофагов в полученных субстратах определяли по методу агаровых слоев по Грациа, а также с помощью спот-теста. Наличие зон лизиса или негативных колоний на газоне индикаторной культуры указывало на присутствие бактериофага в исследуемом материале [5].
Селекцию бактериофагов и повышение их литической активности проводили пассированием фагов на бактериальной культуре штамма A. hydrophila A.h.-43 с периодическим пересевом типичных для данного изолята негативных колоний. Основные биологические свойства выделенных бактериофагов изучались по общепринятым методикам [3, 7]. Литическую активность определяли методами Аппельмана и Грациа. Для определения спектра литической активности применяли референс-штамм и выделенные нами ранее 14 полевых штаммов. Для определения специфичности использовали штаммы бактерий гетерологичных родов: Proteus, Morganella, Klebssiella, Bacillus, Citrobacter, Yersinia, Pseudomonas, полученные из музея кафедры. Реакцию нарастания титра фага проводили по методам, изложенным в работах Васильева Д.А., Викторова Д.А. [2].
Результаты исследований и их обсуждение
В результате нами было выделено 5 изолятов бактериофагов, активных в отношении бактерий A. hydrophila. Выделенные бактериофаги на газоне индикаторной культуры имели округлые прозрачные негативные колонии диаметром 0,5–1,0 мм. Литическая активность селекционированных фагов по методу Аппельмана составила от 10–5 до 10–8, по методу Грациа от 3,0(±0,2)·105 до 2,0(±0,1)·108 БОЕ/мл.
Для изучения спектра литической активности выделенных нами фагов мы использовали 15 имеющихся у нас штаммов бактерий A. hydrophila. Для этого исследуемые бактериофаги в концентрации 107–109 БОЕ/мл наносили на газон изучаемой бактериальной культуры. По результатам исследований спектр литической активности выделенных нами бактериофагов составил от 13,3 до 86,7 % из 15 имеющихся у нас штаммов бактерий вида Aeromonas hydrophila (рисунок).
Для изучения температурной устойчивости выделенных бактериофагов фаголизаты прогревали в ультратермостате при температуре от 58 до 66 °С с интервалом 2 °С в течение 30 минут [2]. По результатам проведённых исследований все изучаемые бактериофаги являлись термолабильными.
Для определения устойчивости выделенных бактериофагов к воздействию хлороформа разведения фагов обрабатывали хлороформом в соотношении 1:10 в течение 15, 30, 45 минут с обязательной постановкой контроля и определения количества негативных колоний методом агаровых слоев по Грациа [2, 3].
Исходя из результатов, приведённых в таблице 1, выделенные бактериофаги являются не устойчивыми к воздействию хлороформа в соотношении 1:10 до 45 минут (сроки наблюдения).
Для определения специфичности выделенных бактериофагов были использованы гетерологичные штаммы бактерий родов Yersinia, Pseudomonas, Streptococcus, Klebsiella, Enterococcus, Citrobacter, Enterobacter, Proteus, Bacillus, а также штаммы бактерий рода Aeromonas: Aeromonas veronii biogroup sobria ATCC 9071, Aeromonas caviae ATCC 15468, Aeromonas salmonicida ATCC 33658, полученные из музея кафедры. Специфичность определяли методом нанесения бактериофагов в концентрации 108–109 БОЕ/мл на газон исследуемой культуры [2]. Отсутствие лизиса на газоне бактерий гетерологичных родов и видов свидетельствовало о видовой специфичности выделенных бактериофагов по отношению к Aeromonas hydrophila.
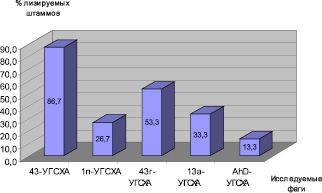
Спектр литической активности выделенных бактериофагов
Таблица 1
Результаты исследования устойчивости выделенных бактериофагов к обработке хлороформом
|
№ п/п |
Штаммы бактериофагов |
Титр исследуемых бактериофагов по Грациа, БОЕ/мл |
|||
|
Контроль |
Время обработки хлороформом, мин |
||||
|
15 |
30 |
45 |
|||
|
1 |
Фаг43-УГСХА |
2,0·108 |
4,0·105 |
– |
– |
|
2 |
Фаг1п-УГСХА |
4,0·106 |
5,0·102 |
– |
– |
|
3 |
Фаг43г-УГСХА |
3,0·107 |
5,0·103 |
4,0·102 |
– |
|
4 |
Фаг13-УГСХА |
5,0·105 |
7,0·102 |
– |
– |
|
5 |
ФагAhD-УГСХА |
1,0·108 |
3,0·104 |
3,0·102 |
– |
Таблица 2
Литическая активность выделенных бактериофагов
|
Фаги |
Литическая активность |
|
|
по Аппельману (степень разведения) |
по Грациа, БОЕ/мл |
|
|
43-УГСХА |
10–8 |
2,0·108 |
|
1п-УГСХА |
10–5 |
4,0·106 |
|
43г-УГСХА |
10–7 |
3,0·107 |
|
13а-УГСХА |
10–5 |
5,0·105 |
|
AhD-УГСХА |
10–7 |
1,0·108 |
По результатам проведённых исследований в целях разработки биопрепарата для детекции A. hydrophila наиболее приемлемым явился бактериофаг Ф-43 УГСХА, обладающий всеми необходимыми для проведения РНФ свойствами: титр 2,0·108 (табл. 2), спектр литической активности 86,7 %, строгая специфичность по отношению к бактерии A. hydrophila.
В результате серии исследований была разработана схема постановки РНФ с использованием биопрепарата бактериофага Ф-43 УГСХА для детекции бактерий A. hydrophila.
Исследуемый материал весом 5 г растирается в фарфоровой ступке и вносится в колбы, содержащие по 50 мл питательного бульона (МПБ). Содержимое колб культивируется в течение 5 часов при 35 °С для предварительного подращивания бактерий. На каждую исследуемую пробу отводится три пробирки: № 1 – предназначена для опытной пробы, № 2 – является контролем на свободный фаг, № 3 – контроль титра индикаторного фага. Исследуемый материал разливается по 9 мл в пробирки № 1 и № 2, пробирки № 3 содержат 9 мл МПБ. В пробирки № 1 и № 3 добавляется по 1 мл бактериофага Ф43- УГСХА в рабочем разведении (титр бактериофага 104), а пробирки № 2 – 1 мл МПБ. Все пробы инкубируются в термостате при температуре 35 °С 7 часов. Параллельно ставится контроль стерильности сред. После инкубации из пробирок берутся пробы по 0,25 мл, вносятся в пробирки с 4,5 мл МПБ и обрабатываются фильтрованием через бактериальные фильтры. Далее содержимое пробирок исследуется методом агаровых слоев по Грациа. Чашки инкубируют 12 часов при 35 °С.
Реакция считается положительной при нарастании титра фага в 5 и более раз. Результаты апробации разработанных параметров РНФ на образцах рыбы, искусственно контаминированной бактериями A. hydrophila представлены в табл. 3.
Таблица 3
Результаты РНФ
|
Концентрация индикаторной культуры, м. к./мл |
Количество негативных колоний, шт. |
Нарастание титра, раз |
Результат РНФ |
||
|
Чашка № 1 |
Чашка № 2 |
Чашка № 3 |
|||
|
101 |
10 |
– |
8 |
– |
– |
|
102 |
20 |
– |
10 |
2 |
– |
|
103 |
98 |
– |
12 |
более 5 |
+ |
|
104 |
лизис |
– |
18 |
более 20 |
+ |
|
105 |
лизис |
– |
20 |
более 20 |
+ |
Заключение
В результате проведённых исследований были выделены и изучены бактериофаги, активные в отношении бактерий Aeromonas hydrophila. Разработаны параметры реакции нарастания титра фага с бактериофагом Ф-43 УГСХА. Разработанная схема РНФ позволяет проводить фагодетекцию Aeromonas hydrophila в различных объектах в количестве от 103 м.к./мл в течение 24 часов.
Рецензенты:Алешкин А.В., д.б.н., профессор, директор КИПКО, ФБУН «Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н. Габричевского Роспотребнадзора», г. Москва;
Золотухин С.Н., д.б.н., профессор, декан факультета ветеринарной медицины ФГБОУ ВПО «Ульяновская ГСХА», Ульяновская область, Чердаклинский район, пос. Октябрьский.
Работа поступила в редакцию 26.02.2014.



