В настоящее время уделяется большое внимание изучению различных видов пищевых растений, с точки зрения их использования в качестве сырьевых источников для получения фармакологически активных субстанций.
В этом отношении большой интерес представляет широко распространенная культура – тут, или шелковица, надземная часть которой в настоящее время изучена очень мало.
Нами проведены химические исследования листьев шелковицы черной (Morus nigra L.). Установлено, что в спиртовом экстракте, полученном экстракцией 40 % водным этанолом присутствуют танин, галловая, хлорогеновая, кофейная кислоты, рутин, оксиметоксикумарин. Количественное содержание хлорогеновой кислоты – 0,14 % и рутина – 0,058 %.
В ходе работы были определены такие физико-химические характеристики водорастворимых полисахаридов и пектинов, выделенные по методу Кочеткова, как молекулярная масса, константа Хаггинса, степень набухания. Результаты показали, что значения средних М.м. исследуемых полисахаридов лежат в пределах от 2700 до 19000. Проведено фракционирование углеводов из листьев шелковицы черной и шелковицы белой и ягод шелковицы черной. Содержание водорастворимых полисахаридов (ВРПС) – 3,59 %, 4,29 % соответственно, пектинов (ПВ) – 0,87 %, 0,575 соответственно в листьях, в ягодах содержание ВРПС составляет 8,92 %, пектинов – 10,23 %. У всех водорастворимых полисахаридов и пектинов с увеличением молярной массы возрастала степень набухания, но уменьшалась величина константы Хаггинса. Выявлена также корреляционная зависимость между величинами средней молекулярной массы ВРПС и ПВ, константами Хаггинса и степенью набухания всех полисахаридов выделенных из изучаемых видов [3, 4, 5].
Изучена сорбционная активность водорастворимых полисахаридов листьев шелковицы черной (Morus nigra L.) и шелковицы белой (Morus alba L.), а также водорастворимых полисахаридов и пектинов, полученных из ягод шелковицы черной (Morus nigra L.) по отношению к ионам свинца. В течение одного часа максимальное извлечение ионов свинца водорастворимыми полисахаридами шелковицы черной составило 43,8 %, шелковицы белой – 52,1 %, водорастворимыми полисахаридами из ягод – 22,1 %, а пектинами – 67,7 % от равновесной концентрации. Характер полученных изотерм доказывает, что функциональная зависимость величины адсорбции от равновесной концентрации к ионам Pb2 + во всех случаях подчиняется уравнению Ленгмюра [3, 5].
Проведен спектральный анализ микро- и макроэлементного состава; наибольшее содержание калия, кальция, магния и фосфора [2, 3, 5].
Целью настоящей работы явилось изучение качественного и количественного состава аминокислот, содержащихся в листьях шелковицы черной, шелковицы белой и шелковицы красной.
Материал и методика исследования
При изучении растительного сырья анализ качественного и количественного состава аминокислот является одной из обязательных и важных задач. Объектом наших исследований явилась широко распространенная древесная культура – шелковица. Предварительный анализ аминокислот осуществляли в трех образцах экстрактов листьев шелковицы белой (Morus alba L.) (образец № 1), листьев шелковицы черной (Morus nigra L.) (образец № 2) и листьев шелковицы красной (Morus rubra L.) (образец № 3).
Идентификация свободных аминокислот. Изучение состава свободных аминокислот в образцах проводили с применением в качестве «свидетелей» индивидуальных аминокислот. В качестве неподвижной фазы использовали хроматографические пластины «Kiselgel» размером 15×20 см; в качестве подвижной фазы смесь растворителей: н-пропанол- ледяная уксусная кислота–вода в соотношении 80:20:20. Смесь растворителей помещали в стеклянную камеру для хроматографии, которую насыщали в течение 2-х часов [1, 2].
Для анализа использовали растворы экстрактов в разведенной хлористоводородной кислоте: к 0,05 г каждого образца прибавляли по 3 мл исходной кислоты, перемешивали (исследуемый раствор) и далее подвергали определению.
В качестве растворов сравнения использовали 0,05 % растворы рабочих стандартных образцов аминокислот: аргинина, аспарагиновой кислоты, глицина, серина, глутаминовой кислоты, треонина, валина, метионина, триптофана, фенилаланина, тирозина, пролина, лейцина, гистидина.
Для приготовления рабочих стандартных растворов аминокислот 0,05 г (точная навеска) каждой из них помещали в мерные колбы объемом 100 мл, прибавляли по 50 мл воды дистиллированной, помещали в ультразвуковую баню, перемешивали до растворения при температуре 50 °C и доводили до метки тем же растворителем.
На линию старта хроматографической пластины наносили 5 мкл образца № 1, 20 мкл образца № 2 и 10 мкл образца № 3 исследуемых растворов и по 5 мкл рабочих стандартных образцов аминокислот. Длина пробега растворителей составила 15 см. Хроматограмму высушивали при комнатной температуре до полного улетучивания растворителей, опрыскивали 0,2 % раствором нингидрина в 95 % этаноле (1,0 г нингидрина, 2,5 г ацетата кадмия, 10 мл уксусной кислоты ледяной растворяют в 500 мл спирта этилового) и нагревали в сушильном шкафу при температуре 100–105 градусов в течение 5 минут. На хроматограммах после проявления 0,2 % раствором нингидрина обнаружены окрашенные зоны (табл. 1) [4, 7].
Подготовка проб для изучения свободных аминокислот осуществляют следующим образом: 50,0 г (точная навеска) сырья исчерпывающе экстрагируют смесью хлороформ-бензол (1:1) в аппарате Сокслета (в течение 28 часов).
После удаления растворителя сырье количественно переносят в круглодонную колбу, добавляют 300 мл горячей воды (80–90 °С) и кипятят с обратным холодильником в течение 1 часа. Данную операцию проводят трехкратно, используя каждый раз свежий экстрагент. Объединенные извлечения упаривают до сиропообразной консистенции и добавляют пятикратное количество метанола для осаждения высокомолекулярных соединений. Осадок центрифугируют, и полученный фильтрат упаривают досуха (порошок).
12 мг порошка растворяют в 2,2 мл натрий-цитратного раствора и вводят в колонку аминокислотного анализатора. Качественный состав аминокислот в образце определяют по времени удерживания. В качестве стандарта используют стандартную смесь, состоящую из 18 аминокислот.
Для определения суммы аминокислот в экстрактах исследуемых видов была использована методика, основанная на реакции взаимодействия аминокислот с раствором нингидрина и последующем спектрофотометрировании полученного окрашенного комплекса при длине волны около 570 нм. В ходе эксперимента нами была уточнена длина волны максимума поглощения окрашенного комплекса с нингидрином глютаминовой кислоты и водного извлечения из экстрактов. Комплекс и раствор для исследования получали по приведенной ниже методике (рисунок).
Для исследования около 0,0500 (точная навеска) экстрактов помещали в мерную колбу вместимостью 250 мл, прибавляли 150 мл воды очищенной и перемешивали до растворения с использованием ультразвуковой бани. Охлаждали, объем доводили до метки водой очищенной, перемешивали и извлечение фильтровали через обеззоленный фильтр. Далее анализировали фильтрат.
Около 0,0500 г (точная навеска) кислоты глютаминовой (ВФС 42-2722-96) помещают в мерную колбу вместимостью 100 мл, растворяют в 20–30 мл воды и доводят раствор водой до метки (РСО).
2 мл исследуемого раствора помещали в мерную колбу вместимостью 50 мл прибавляли 1 мл 0,25 % раствора натрия карбоната. 2 мл спиртового раствора нингидрина и нагревали 10 минут на кипящей водяной бане. После охлаждения раствор доводили водой до метки. Параллельно в мерную колбу вместимостью 50 мл помещали 2 мл раствора РСО кислоты глютаминовой и далее поступали, как указано выше. Оптическую плотность полученных растворов измеряли на спектрофотометре при длине волны 568 нм в кювете с толщиной слоя жидкости 10 мм относительно воды. Содержание суммы аминокислот в сырье в % Х, в пересчёте на кислоту глютаминовую, рассчитывали по формуле:
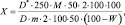
где D* – оптическая плотность испытуемого раствора; D – оптическая плотность РСО глютаминовой кислоты; М – масса РСО глютаминовой кислоты в граммах; m – масса экстракта в г; W – потеря массы при высушивании сырья в % [2, 6].
Результаты исследования приведены в табл. 2.
Результаты исследования и их обсуждение
На основании данных ТСХ установлено, что в исследуемых образцах № 1 и № 2 проявляется 6 окрашенных зон, из которых идентифицировано 4, в образце № 3 обнаружены 5 зон, из которых идентифицированы 4. Испытание проводилось в нескольких системах растворителей, наилучшее разделение достигается в системе н-пропанол-уксусная кислота-вода (80:20:20)
Таблица 1
Результаты хроматографического исследования аминокислотного состава экстрактов листьев шелковицы белой, черной и красной
|
Образцы № 1 и № 2 |
Образец № 3 |
||
|
Номер зоны, значения Rf около |
Идентифицировано |
Номер зоны, значения Rf около |
Идентифицировано |
|
1) 0,35 (розовая) 2) 0,40 (фиолетовая) 3) 0,48 (розовая) 4) 0,56 (розовая) 5) 0,60 (розовая) 6) 0,69 (розовая) |
Глицин Неидентифицировано Глутаминовая кислота Неидентифицировано Метионин Тирозин |
1) 0,35 (розовая) 2) 0,40 (фиолетовая) 3) 0,48 (розовая) 4) 0,60 (розовая) 5) 0,69 (розовая) |
Глицин Неидентифицирован Глутаминовая кислота Метионин Тирозин |
Дальнейшее определение проводили на аминокислотном анализаторе АА-33. Наибольшее содержание аминокислот наблюдается в экстракте листьев шелковицы белой (13,12 С, г/ %). Все три объекта исследования содержат в своем составе 15 аминокислот, из которых, в наибольшем количестве содержатся: глутаминовая кислота, глицин, метионин и тирозин.
Таблица 2
Аминокислотный состав экстрактов листьев шелковицы белой, черной и красной
|
№ п/п |
Аминокислоты |
Шелковица черная |
Шелковица белая |
Шелковица красная |
|
С, г/ % |
С, г/ % |
С, г/ % |
||
|
1. |
Аспарагиновая кислота |
1,02 |
0,97 |
0,98 |
|
2. |
Треонин |
0,45 |
0,38 |
0,34 |
|
3. |
Серин |
0,28 |
0,19 |
0,12 |
|
4. |
Глутаминовая кислота |
2,88 |
2,26 |
2,01 |
|
5. |
Глицин |
1,31 |
1,02 |
1,12 |
|
6. |
Аланин |
0,61 |
0,48 |
0,43 |
|
7. |
Валин |
0,74 |
0,54 |
0,52 |
|
8. |
Метионин |
1,57 |
1,34 |
1,18 |
|
9. |
Изолейцин |
0,40 |
0,26 |
0,18 |
|
10. |
Лейцин |
0,68 |
0,57 |
0,19 |
|
11. |
Тирозин |
1,11 |
0,96 |
0,84 |
|
12. |
Фенилаланин |
0,57 |
0,41 |
0,37 |
|
13. |
Гистидин |
0,27 |
0,24 |
0,21 |
|
14. |
Лизин |
0,36 |
0,21 |
0,17 |
|
15. |
Аргинин |
0,87 |
0,75 |
0,68 |
|
Всего: |
13,12 |
10,58 |
9,34 |
Спектрофотометрическим методом проводили определение суммы аминокислот по реакции с нингидрином:
Установлено, что содержание аминокислот в листьях шелковицы черной составляет 11,8; шелковицы белой – 11,7 % и шелковицы красной – 11,3 % (в пересчете на глутаминовую кислоту).
Выводы
На аминокислотном анализаторе АА-33 исследован качественный и количественный аминокислотный состав в экстрактах листьев шелковицы черной, шелковицы белой и шелковицы красной. В значительном количестве в экстрактах листьев (от общей суммы аминокислот) содержится аспарагиновая кислота, глутаминовая кислота, глицин, метионин, тирозин. Всего обнаружено 15 свободных аминокислот. По реакции с нингидрином разработана методика спектрофотометрического определения аминокислот. Наибольшее содержание аминокислот наблюдается в экстракте листьев шелковицы белой, которое составляет 13,12 С, г/ %.
а 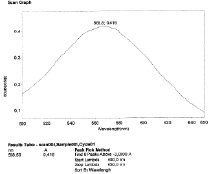 б
б 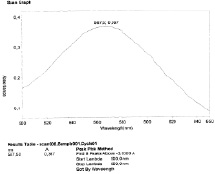
в 
Спектр поглощения комплекса водного раствора экстракта шелковицы черной (а), шелковицы белой (б), шелковицы красной (в) с раствором нингидрина
Рецензенты:
Кодониди И.П., д.фарм.н., доцент кафедры органической химии Пятигорского медико-фармацевтического института филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Попова О.И., д.фарм.н., профессор кафедры фармакогнозии Пятигорского медико-фармацевтического института филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Работа поступила в редакцию 06.03.2014.



