Метод исследования количественных соотношений между структурой и физико-химическим свойством является инструментом в прогнозировании ключевых свойств химических молекул: липофильности (log P) [1, 2, 3], ионизации [4] и других. Липофильность влияет на проникновение биологически активных веществ через клеточные мембраны и является одним из ключевых детерминантов фармакокинетических свойств, значения которого позволяют предсказывать биологическую активность веществ [10, 5].
Цель данной работы заключается в прогнозировании констант липофильности (log Pрассч) с использованием квантово-химических параметров и исследовании зависимости величины противовоспалительной активности (ПВА) от рассчитанных значений log P. Объектом исследования являются производные антраниловой кислоты, при атоме азота которых содержатся ароильные и алкилфенильные заместители под общим названием N-арилзамещенные производные антраниловой кислоты.
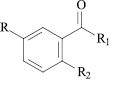
R = H, R1 = NHCH2CH = CH2, R2 = NHCO(2-фурил) (I); R = H, R1 = OH, R2 = NHCH2C6H5 (II); R = H, R1 = OH, R2 = NHCOC6H4(2-OCH3) (III); R = Br, R1 = NH2, R2 = NHCOC6H5 (IV); R = Br, R1 = NH2, R2 = NHCOC6H4(4-NO2) (V); R = Br, R1 = NH2, R2 = NHCOC6H4(2-COOH) (VI); R = I, R1 = NHCH2C6H5, R2 = NHCOCH2C6H5 (VII); R = I, R1 = NHCH2CH2OH, R2 = NHCOCH2C6H5 (VIII); R = I, R1 = NHCH2CH2OH, R2 = NHCOC6H5 (IX); R = I, R1 = NHCH3, R2 = NHCOC6H5 (X); R = I, R1 = NHNH2, R2 = NHCOC6H5 (XI); R = I, R1 = NHCH3, R2 = NHCO(2-фурил) (XII); R = I, R1 = NHCH2CH2OH, R2 = NHCO(2-фурил) (XIII); R = H, R1 = OH, R2 = NHCOC6H4(3-NO2) (XIV); R = H, R1 = OH, R2 = NHCOC6H3(2,4-Cl2) (XV).
В проводимом нами исследовании связи структуры с константами липофильности мы использовали, из рассчитанных электронных параметров, суммарные значения напряженности электрического поля Σ(Е), потенциала Σ(φ) и абсолютной величины заряда Σ(|q|) на атомах кислорода, азота, углерода и гидрофобного фрагмента Σ(Н). Структура гидрофобного фрагмента получена с помощью программы Ligand Scout 3,01. Указанный подход позволяет учесть структурные особенности исследуемого класса соединений и сводится к оценке влияния отдельных элементов структуры на липофильность. Квантово-химические параметры рассчитаны полуэмпирическими методами РМ3 и АМ1 с полной оптимизацией геометрии молекул, с использованием программы Gaussian 03.
В исследуемых рядах соединений с использованием программы Statistica 6 рассчитаны коэффициенты линейной корреляции Пирсона, отражающие зависимость log P от квантово-химических параметров: ΣС(E), ΣО(E), ΣN(E), ΣC(φ), ΣО(φ), ΣN(φ), ΣC(|q|), ΣO(|q|), ΣN(|q|), ΣH(E), ΣH(φ) и ΣH(|q|). Для дальнейшего изучения связи констант липофильности с квантово-химическими характеристиками были отобраны суммарные параметры, дающие наибольшие коэффициенты корреляции: ΣN(E), ΣО(φ), ΣO(|q|) и ΣН(φ). Проведен множественный регрессионный анализ, в ходе которого было использовано 4 переменных. Отбор переменных для уравнения регрессии проводили методом пошагового включения параметров, удовлетворяющих заданным уровням значимости статистических критериев. Всего было сгенерировано свыше 30 уравнений регрессии, из которых были отобраны по 2 уравнения для методов PM3 и AM1 с одинаковыми квантово-химическими параметрами (табл. 1).
Таблица 1
Уравнения регрессии связи констант липофильности (log Pрассч) с квантово-химическими параметрами N-арилзамещенных производных антраниловой кислоты
|
№ п/п |
Уравнение регрессии |
R |
F |
N |
|
Метод РМ3: |
||||
|
1 |
logPрассч1 = 2,558 – 0,320⋅ΣN(E) + 0,051⋅ΣO(φ) – 1,917⋅ΣO(|q|) |
0,810 |
7,04 |
15 |
|
2 |
logPрассч2 = 2,317 + 0,046⋅ΣО(φ) – 1,781⋅ΣO(|q|) + 0,00040⋅ΣH(φ) |
0,792 |
6,21 |
15 |
|
Метод АМ1: |
||||
|
3 |
logPрассч3 = 2,962 – 0,274⋅ΣN(E) + 0,125⋅ΣO(φ) – 5,670⋅ΣO(|q|) |
0,808 |
6,91 |
15 |
|
4 |
logPрассч4 = 2,777 + 0,128⋅ΣО(φ) – 5,811⋅ΣO(|q|) + 0,00033⋅ΣH(φ) |
0,798 |
6,44 |
15 |
Полученные регрессионные уравнения были использованы для расчёта значений log P шести новых соединений из ряда N-арилзамещенных производных антраниловой кислоты (XVI – XXI) и проведена сравнительная характеристика log Pрассч с log Pэксп.
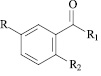
R = H, R1 = OH, R2 = NHCOCH2C6H5 (XVI); R = I, R1 = N(CH3)2, R2 = NHCO(2-фурил) (XVII); R = H, R1 = NHC6H4(4-Br), R2 = NHCH2C6H5 (XVIII); R = H, R1 = NHC6H4(4-Br), R2 = N(COCH3)CH2C6H5 (XIX); R = H, R1 = NHC6H4(4-CH3), R2 = NHCH2C6H5 (XX); R = H, R1 = NHC6H4(4-CH3), R2 = N(COCH3)CH2C6H5 (XXI).
Для проведения сравнительной оценки прогнозирования log Pрассч с помощью полученных уравнений (1)–(4) (табл. 1) и рассчитанных квантово-химических параметров вычислены значения средней квадратичной ошибки прогноза: S1 = 0,63, S2 = 0,83, S3 = 1,04 и S4 = 1,18 (табл. 2). Величина средней квадратичной ошибки свидетельствует о том, что использование уравнения (1) (S1 = 0,63) и квантово-химических параметров, рассчитанных методом PM3, приводит к более точным результатам прогнозирования log P.
Таблица 2
Экспериментальные и теоретически рассчитанные константы липофильности N-арилзамещенных производных антраниловой кислоты (XVI – XXI)
|
Соединение |
PM3, log Pрассч |
АМ1, log Pрассч |
log Pэксп |
||||||
|
1 |
S1 |
2 |
S2 |
3 |
S3 |
4 |
S4 |
||
|
XVI |
2,65 |
0,63 |
2,47 |
0,83 |
2,87 |
1,04 |
2,77 |
1,18 |
1,99 |
|
XVII |
2,50 |
2,47 |
2,30 |
2,31 |
2,90 |
||||
|
XVIII |
2,46 |
2,57 |
2,75 |
2,93 |
2,28 |
||||
|
XIX |
2,73 |
2,81 |
3,04 |
3,19 |
2,52 |
||||
|
XX |
2,46 |
2,55 |
2,75 |
2,94 |
2,33 |
||||
|
XXI |
2,72 |
2,80 |
2,99 |
3,15 |
2,40 |
||||
С целью изучения взаимосвязи структура – противовоспалительная активность мы использовали рассчитанные с помощью уравнения (1) (табл. 1) значения констант липофильности log Pрассч1 25 соединений (XXII – XXXXVI) N-арилзамещенных производных антраниловой кислоты (табл. 3).
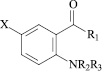
X = H, R1 = OH, R2 = H, R3 = COC6H4(3-CH3) (XXII); X = H, R1 = NHC6H4(4-Br), R2 = H, R3 = CH2C6H5 (XXIII); X = H, R1 = NHCH(C6H5)(1H-бензоимидазол-2-ил), R2 = H, R3 = C6H3(2,3-(CH3)2) (XXIV); X = H, R1 = NHNHCOCH2(1-пиперидинил), R2 = H, R3 = C6H3(2,3-(CH3)2) (XXV); X = H, R1 = NHNHCOCH2(1-морфолил), R2 = H, R3 = C6H3(2,3-(CH3)2) (XXVI); X = H, R1 = NHN = CH-C6H4(4-OCH3), R2 = H, R3 = C6H3(2,3-(CH3)2) (XXVII); X = H, R1 = NHCH2CH = CH2, R2 = H, R3 = COC6H4(4-OCH3) (XXVIII); X = H, R1 = NHCH2CH = CH2, R2 = H, R3 = COC6H4(4-Br) (XXIX); X = I, R1 = OC2H5, R2 = H, R3 = COC6H5 (XXX); X = I, R1 = OC2H5, R2 = H, R3 = CO(2-фурил) (XXXI); X = Br, R1 = NHCH2CH = CH2, R2 = H, R3 = COC6H5 (XXXII); X = I, R1 = NHCH2C6H5, R2 = H, R3 = CO(2-фурил) (XXXIII); X = I, R1 = N(CH3)2, R2 = H, R3 = CO(2-фурил) (XXXIV); X = H, R1 = OH, R2 = COCH2C6H5, R3 = CH2CH = CClCH3 (XXXV); X = H, R1 = NH2, R2 = COC6H5, R3 = CH2CH = CH2 (XXXVI); X = H, R1 = NH2, R2 = COC6H5, R3 = CH2CH = CClCH3 (XXXVII); X = H, R1 = NHC6H4(4-CH3), R2 = H, R3 = CH2C6H5 (XXXVIII); X = Br, R1 = OH, R2 = H, R3 = COCH2C6H5 (XXXIX); X = Br, R1 = OH, R2 = H, R3 = COCH(C6H5)2 (XXXX); X = I, R1 = OH, R2 = H, R3 = COC6H5 (XXXXI); X = I, R1 = OH, R2 = H, R3 = COC6H4(4-Cl) (XXXXII); X = Br, R1 = NH2, R2 = H, R3 = COC6H4(4-Br) (XXXXIII); X = Br, R1 = NHC6H5, R2 = H, R3 = COCH2C6H5 (XXXXIV); X = I, R1 = NHCH3, R2 = H, R3 = COC6H5 (XXXXV); X = I, R1 = NHCH3, R2 = H, R3 = CO(2-фурил) (XXXXVI).
Таблица 3
ПВАэксп (4 часа), квантово-химические параметры и log Pрассч1 N-арилзамещенных производных антраниловой кислоты (XXII–XXXXVI)
|
Соединение |
ПВАэксп 4ч, % |
N(E) |
O(φ) |
O(|q|) |
log Pрассч1 |
|
XXII |
25,40 |
0,55 |
42,0 |
1,03 |
2,55 |
|
XXIII |
14,60 |
0,74 |
15,9 |
0,34 |
2,48 |
|
XXIV |
8,10 |
2,34 |
18,1 |
0,36 |
2,04 |
|
XXV |
21,40 |
1,88 |
34,2 |
0,68 |
2,40 |
|
XXVI |
30,30 |
2,13 |
51,5 |
0,95 |
2,68 |
|
XXVII |
41,80 |
1,31 |
32,6 |
0,54 |
2,77 |
|
XXVIII |
36,50 |
1,08 |
45,9 |
0,90 |
2,83 |
|
XXIX |
33,60 |
1,12 |
30,1 |
0,71 |
2,37 |
|
XXX |
48,15 |
0,51 |
44,2 |
0,89 |
2,94 |
|
XXXI |
48,90 |
0,47 |
57,5 |
0,99 |
3,44 |
|
XXXII |
40,85 |
0,91 |
30,4 |
0,69 |
2,49 |
|
XXXIII |
60,05 |
0,94 |
45,8 |
0,72 |
3,21 |
|
XXXIV |
51,50 |
0,78 |
43,1 |
0,70 |
3,16 |
|
XXXV |
46,85 |
0,11 |
46,7 |
1,02 |
2,95 |
|
XXXVI |
35,05 |
0,78 |
31,3 |
0,76 |
2,45 |
|
XXXVII |
42,40 |
0,80 |
31,4 |
0,72 |
2,52 |
|
XXXVIII |
16,50 |
0,89 |
16,6 |
0,36 |
2,43 |
|
XXXIX |
31,30 |
0,49 |
41,9 |
1,02 |
2,58 |
|
XXXX |
28,60 |
0,57 |
46,6 |
1,02 |
2,80 |
|
XXXXI |
37,35 |
0,53 |
41,1 |
1,02 |
2,53 |
|
XXXXII |
26,90 |
0,53 |
41,1 |
1,02 |
2,53 |
|
XXXXIII |
20,95 |
1,14 |
28,1 |
0,69 |
2,30 |
|
XXXXIV |
44,45 |
0,96 |
32,5 |
0,70 |
2,57 |
|
XXXXV |
32,70 |
0,70 |
29,7 |
0,71 |
2,49 |
|
XXXXVI |
36,15 |
0,62 |
42,7 |
0,78 |
3,04 |
Для исследования связи структура-активность использовали значения ПВАэксп (%), определенные через 4 часа, а для соединений ПВАэксп которых определено через 3 и 5 часов, среднее значение (табл. 3).
Соотношение ПВАэксп и log P рассчитанной наглядно иллюстрирует диаграмма линейной зависимости (рисунок).
Представленная кривая показывает высокую взаимосвязь значений log P рассчитанных и ПВА с коэффициентом корреляции R = 0,768 и критерием Фишера равным 33,21.
Таким образом, можно сделать вывод, что константы липофильности производных антраниловой кислоты оказывают влияние на величину ПВА. Полученные результаты показывают перспективность использования log P в прогнозировании веществ с высокой противовоспалительной активностью.
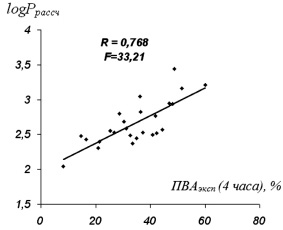
Соотношение log Pрассч и ПВАэксп (4 часа), %
Экспериментальная часть
Экспериментальное определение величин констант липофильности производных N-арилзамещенных антраниловой кислоты проводилось спектрофотометрическим методом в системе октанол – вода [8, 9].
Противовоспалительное действие соединений (XXII–XXXXVI) (табл. 3) исследовали на белых нелинейных крысах массой 200–220 г на модели каррагенинового отёка. Изучаемые вещества вводили внутрибрюшинно в дозе 50 мг/кг в виде водной суспензии, стабилизированной твином-80, за 1 ч до инъекции флогогена. Крысам контрольной серии вводили эквивалентное количество раствора твина. Объем лап животных измеряли онкометрически до и через 3, 4 и 5 ч после инициации воспаления [6]. Эффект оценивали по уменьшению прироста отека лап в сравнении с контрольной группой крыс.
Статистическую обработку данных проводили с использованием коэффициента Стьюдента [7].
Рецензенты:
Игидов Н.М., д.фарм.н., профессор кафедры общей и органической химии, ГБОУ ВПО ПГФА Министерства здравоохранения Российской Федерации, г. Пермь;
Михайловский А.Г., д.фарм.н., профессор кафедры общей и органической химии, ГБОУ ВПО ПГФА Министерства здравоохранения Российской Федерации, г. Пермь.
Работа поступила в редакцию 18.02.2014.



