Одним из ключевых этиологических факторов в патогенезе рака на сегодняшний день признаны микробные агенты, ассоциированные с канцерогенезом, хотя в материалах, опубликованных Международной Ассоциацией исследований рака (МАИР), содержится указание на более чем 60 вероятных и 150 возможных веществ, факторов и производств, контакт с которыми сопряжен с реальным риском развития новообразований [18, 38]. Lehoux M., D’Abramo C.M., Archambault J. (2009) считают, что приблизительно 20 % всех случаев рака связаны с инфекционными агентами [24]. Для желудочно-кишечного тракта (ЖКТ) таковым является, по признанию ВОЗ, HbP, для шейки матки – HPV, который в настоящее время с помощью молекулярно-генетических исследований найден практически во всех видах опухолей в различных системах органов человека [5, 47]. В настоящее время учёными мира рассматривается вопрос патогенеза ЯБ ЖКТ и онкогенеза на фоне HbP в зависимости от его штамма, наличия генов cagA, vacA, babA, ассоциированных с опухолями желудка, и определённых штаммов HPV, чаще встречающихся при раке шейки матки, а в настоящее время выявленные практически во всех опухолях кожи, мозга и других органов [7, 22, 41]. По мнению Zur Hausen H. (2008–2012), вирусы папилломы человека (HPV) занимают центральное место и в настоящее время признаются в качестве главного этиологического агента рака шейки матки [43-49]. Narisawa-Saito M., Kiyono T. Et al., (2007-2012) указывают на высокую смертность от HPV-инфекции и считают, что вирусы папилломы человека являются основной причиной развития неопластических и злокачественных новообразований шейки матки, а 16 и 18 типы, высокого риска канцерогенеза, присутствуют в более чем 90 % всех карцином шейки матки [35-36]. Многие авторы предполагают, что гены Е6 и Е7 HPV играют главную роль в малигнизации эпителия, поскольку они способствуют деградации p53 и нарушают комплекс формирования транскрипционных факторов, индуцируя многоступенчатый канцерогенез [34].
Авторы инфекционных концепций также учитывают, что есть различные канцерогены, в роли которых могут выступать физические факторы (УФЛ), химические (анилиновые красители и т.д.), гормональные (эстрогены), но считают, что их роль, как и микробных агентов, главным образом сводится к изменению или повреждению генома клеток [1, 3, 40]. Вся мировая наука на сегодняшний день направлена на решение вопроса, какие же клетки подвергаются канцерогенезу: вступающие в дифференцировку дочерние клетки с повреждениями генома после образования из материнских клеток, или собственные тканевые камбиальные клетки, в которых уже много лет безуспешно ищут индуцированные повреждения генома, или встроившиеся вирусные белки [8, 39]. Активно прорабатываются вопросы о существовании циркулирующих раковых клеток, сущности повышения пролиферативной активности в зоне повреждения покровного эпителия, как инфекционной природы при HPV и HbP, так и физико-химической [2]. Индукция запуска канцерогенеза отводилась онкогенам, кодируемым семейством генов ras, затем протоонкогенам, которые включают гены, кодирующие белки, играющие центральную роль в регуляции процессов роста и развития организма, такие как факторы роста (ФР), рецепторы ФР, транскрипционные факторы и белки, вовлечённые в трансдукцию сигналов, а также антионкогенам, например, гену р53 – супрессору опухолей [17]. Этот ген кодирует ядерный фосфопротеин с молекулярной массой 53 кД, который препятствует вхождению клеток в S-фазу, амплификации и мутациям ДНК. Полагают, что физиологическая функция белка Р53 состоит в том, чтобы задерживать в G1- и G2-фазах клетки, имеющие повреждения в структуре ДНК до тех пор, пока эти повреждения не будут устранены [4]. В том случае, если регенераторные системы не способны устранить дефекты в структуре ДНК, этот белок обеспечивает включение механизма апоптоза, уничтожающего повреждённую клетку [23]. Установленные в многочисленных работах данные об отсутствующем или подавляемом апоптозе при канцерогенезе в наших исследованиях не подтвердились, как и в работах многочисленных авторов, показавших апоптоз и атрофию процессами, предшествующими малигнизации [2, 15].
Несмотря на имеющиеся сведения о контроле над процессом пролиферации и апоптоза в тканях эффекторными иммуноцитами, анализ взаимодействия иммунокомпетентных клеток с помощью цитокинов в зоне лейкоцитарной инфильтрации, механизмы неоплазии и роли в ней эффекторных иммуноцитов изучены недостаточно [4, 21]. Отсутствие доказательных данных об участии онкогенов, протоонкогенов и антионкогенов в малигнизации клеток направило усилия учёных на поиск геномных изменений, связанных с нарушениями в последовательности нуклеотидов [6]. Поэтому разрабатываемый на современном этапе метод вакцинации дендритными клетками для активации макрофагов, направленной на фагоцитоз клеток опухоли по методу Steinman Ralph M. (2010) [37], пока не эффективен в связи с отсутствием детерминант несовместимости на клеточной поверхности опухолевых клеток. Механизм HPV-индуцированного канцерогенеза, несмотря на широко распространенный характер этой инфекции, до сих пор не раскрыт и не обоснован. Следует отметить, что за 20–21 век множество микроорганизмов имели лавры пускового источника в патогенезе рака, но отсутствие 100 % онкогенеза у всех носителей данных микроорганизмов [11], а также спонтанное выздоровление в 98 % при наличии, например, papilloma virus, который в настоящее время признан пусковым в развитии рака шейки матки, носительство HbP в 95 % при 10 % развитии язв и 3 % раке свидетельствуют о том, что ключевым патогенетически значимым в онкогенезе является неизвестный сегодня процесс [11]. Вопрос вакцинации при HPV, штаммов которого на современном этапе насчитывается более 150, с учётом спонтанного выздоровления при заражении папилломавирусом в 98 % случаев остаётся открытым и по большому счёту спекулятивным. Также непонятно, почему вирус, при котором клинические проявления практически отсутствуют, способен изменить геном клеток, а тяжёлые инфекции, вызванные антибиотикорезистентными золотистыми стафилококками, как и другими высоко патогенными антигенами, вызывающими опасные инфекции, рак не вызывают [16]. Chiariotti L., Angrisano T., Keller S., et al. (2013), утверждают, что эпигеномный ответ на экологические воздействия может привести к адаптивным изменениям генома из стабильного состояния к потенциально наследственным изменениям или в некоторых случаях может способствовать появлению дифферонов клеток с выраженными изменениями в генах с нарушениями в последовательности ДНК, ведущими к прогрессированию различного рода заболеваний [10 ].
Отмечено, что успехи эрадикационной терапии язвенного процесса в ЖКТ происходят на фоне увеличения канцерогенеза и смертности от рака желудка. На изучение механизмов канцерогенеза тратятся во всём мире огромные деньги [14]. Но отсутствие решающих успехов теоретической онкологии, отсутствие концепции онкогенеза, которая привела бы все механизмы канцерогенеза к общему знаменателю, диктуют пересмотреть существующие на современном этапе гипотезы и попытки разработки общей теории рака. Незнание механизмов только HPV-индуцированного канцерогенеза приводит ежегодно к 274 000 смертей вследствие инвазивного рака шейки матки, а диагностируется примерно 493000 новых случаев рака шейки матки, несмотря на доступность профилактических вакцин [9]. Возникшая тупиковая ситуация в диагностике, лечении и профилактике рака свидетельствует о необходимости изменения стратегии научного поиска для исчерпывающего решения вопросов этиологии и механизмов канцерогенеза.
Целью нашего исследования является анализ концепций онкогенеза и разработка авторской модели на основе существующего алгоритма неоплазии по Correa (1998) [12].
Материалы и методы исследования
Материалом для анализа послужили данные исследований с 2000 по 2013 год, содержащие сведения о канцерогенезе в различных органах. Также использованы результаты собственных исследований кожи при папилломавирусной инфекции и при репаративной регенерации после ожога, слизистых оболочек желудочно-кишечного тракта человека при язвенном процессе, метаплазии и раке.
Результаты исследования и их обсуждение
Наши наблюдения за процессом регенерации в зоне ожоговой раны показали, что миграция лейкоцитов и недифференцированных клеток, трансформирующихся в фибробласты, с защитной и синтетической функцией для образования матрикса и подложки для миграции эпителия, способствуют закрытию дефекта ткани. Восстановление эпителиального пласта происходит путём реституции из краёв ожоговой раны и за счёт камбия волосяных фолликулов и потовых желёз (рис. 1, а, б). По нашему мнению, реституцию обеспечивают клетки крови в составе инфильтрата на поверхности ожога. Часть клеток инфильтрата имеет морфологические признаки гранулоцитов, лимфоцитов и моноцитов (рис. 2). Они вырабатывают факторы, предупреждающие разрастание соединительной ткани и формируют подложку для миграции кератиноцитов. При этом идёт полная регенерация по клеточному типу с закрытием дефекта и выполнением функции. Эффективным является также закрытие больших дефектов при обширных ожогах аутодермотрансплантатами (рис. 3). При этом формируется рубцовая ткань, которая не является идентичной той ткани, которую заменяет, и обладает более низкими функциональными свойствами.
Инфицирование ожоговой раны стафилококками, несмотря на их высокую патогенность и гнойное расплавление ткани, заканчивается репаративной регенерацией с закрытием поверхности ожогов эпидермисом даже при значительном снижении иммунитета у больного. При этом репаративная регенерация может носить выраженный гипертрофический характер или сопровождаться формированием нормотрофического, слабо визуализируемого рубца, если площадь ожоговой раны была незначительной.
При инфицированном и неинфицированном ожоге репаративная регенерация идёт по физиологическим механизмам, только с большей скоростью за счёт повышенной пролиферативной активности кератиноцитов.
а 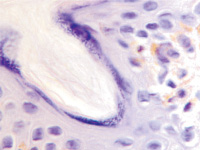 б
б 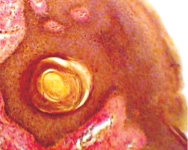
в 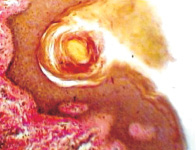 г
г 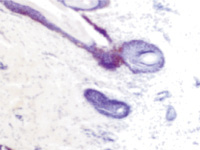
Рис. 1. Ожоговая рана. Пролиферация кератиноцитов волосяных фолликулов (а, б, в) и потовых желёз (г). Окраска гематоксилин-эозином. Ув.: а – х200; б, в – х400; г – х100
а 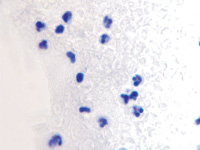 б
б 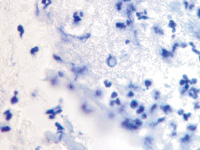
Рис. 2. Инфильтрат на поверхности ожоговой раны. Идентифицируются гранулоциты и пролиферирующие лимфоциты. Окраска гематоксилин-эозином. Микрофото. Ув.х200
По нашим данным, при HPV-инфекции сначала происходит увеличение митотической активности камбиальных кератиноцитов базального и шиповатого слоёв (рис. 4), что согласуется с обнаруженным Borgogna C., Lanfredini S., Peretti A., et al. (2014) повышением процессов регенерации в верхних слоях эпидермиса при бородавчатой эпидермодисплазии и раке кожи, которые наблюдались у реципиентов после трансплантации почки, как общей черты для всех изученных HPV-положительных образцов на фоне подавления генерализованного иммунитета [5].
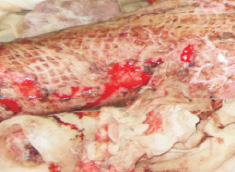
Рис. 3. Ожог у мужчины 24-х лет. Аутодермотрансплантация. Фото
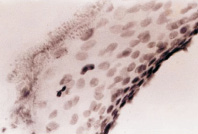
Рис. 4. Экспрессия гена Ki-67 в кератиноцитах кожи базального и шиповатого слоёв. Иммунная гистохимия на выявление белка гена Ki-67. Микрофото. Ув. х400
Адаптация эпителиального пласта к HPV-повреждению заключается в усилении пролиферативной активности эпителиоцитов и соединительной ткани, гиперкератозу, образованию папиллом, представленных выростами эпидермиса и подлежащей соединительной ткани. Тропность HPV к камбиальным клеткам и запуск апоптоза в эпидермисе, последующая гибель камбиальных клеток приводят к невозможности реституции в зоне повреждения. В отсутствие спонтанного выздоровления, при длительном инфицировании HPV происходит формирование очагов некроза, формирование кист с инфильтратом крови. Киста характеризуется тем, что на апикальной поверхности сохраняется блестящий и роговой слои. Зернистый слой, шиповатый и базальный слои отсутствуют. Повреждены камбиальные слои, обладающие регенераторным потенциалом. Базальная мембрана эпидермиса отсутствует, т.к. она является производным базальных клеток и клеток подлежащей соединительной ткани. Поэтому базальная часть кисты не имеет чётких очертаний. В эпидермисе, прилежащем к кисте, запускается тотальный апопотоз (рис. 5, а, б, в, г).
Клетки кисты представлены пулом клеток, морфологически идентичных клеткам крови при лейкозе, имеют многочисленные фигуры аномальных митозов: амитозов, полицентрических митозов (рис. 6). Затем часть фибробластоподобных клеток кисты продуцирует волокна, организующие структуру кисты. Ткань кисты из жидкой приобретает более плотную консистенцию, заполняется недифференцированными клетками и межклеточным веществом (рис. 7). Результат регенерации – закрытие дефекта без выполнения барьерной и защитной функции, присущей эпителиальной ткани. Отсутствует камбий, вырабатывающий факторы роста дифференцировки лимфоцитов, а также специализированные клетки, поддерживающие равновесие в системе «кейлоны-некрогормоны».
Наблюдаются уменьшение количества СD68 клеток в зоне разрастающейся опухоли и увеличение в периферической крови, миграция СD68 клеток из эпидермиса в прилежащую к зоне повреждения соединительную ткань (рис. 8), а также утрата эпителиоцитами эпидермиса свойств реституции, что свидетельствует о явной дисрегуляции в процессах регенерации эпидермиса. Кистозное образование, формирующееся в зоне повреждения эпидермиса, заполненное клетками мигрантами с многочисленными аномальными митозами и появление клеток с морфологическими признаками фибробластов, показывают, что ключевая роль в канцерогенезе не связана с нарушением регуляции экспрессии генов и накоплением эпигеномных аномалий в камбиальных кератиноцитах.
а 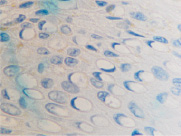 б
б 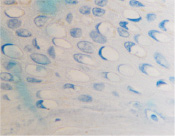
в 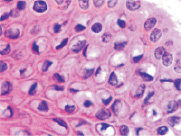 г
г 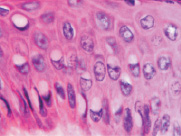
Рис. 5. Апоптоз в эпидермисе кожи при HPV-инфекции. Окраска: а, б – иммунная гистохимия на выявление CD клеток; в, г – гематоксилин-эозином. Микрофото. Ув. х800
а 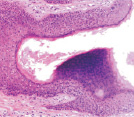 б
б 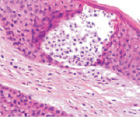 в
в 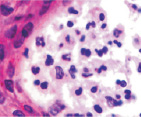
Рис. 6. Некроз и инфильтрация клеток-мигрантов в эпидермисе в зоне повреждения HPV. Окраска гематоксилин-эозином. Микрофото. Ув.: а – 100; б – х400; в – 800
В процессе локальной малигнизации структур кожи при HPV происходят:
1. Нарушение антигенпредставления в эпидермисе, миграция CD68 в соединительную ткань сосочкового слоя дермы, затем повышение пролиферативной активности камбиальных клеток и истощение регенераторного потенциала ткани.
2. Миграция стволовых клеток в зону повреждения для обеспечения барьерных функций в месте гибели эпидермиса. В условиях апоптоза кератиноцитов, вырабатывающих фактор дифференцировки лимфоцитов, стволовые клетки-мигранты не способны созревать. Они защищены от включения программы апоптоза, не распознаются макрофагами, проявляют аномальную пролиферативную активность, защищены от лучевого и химиотерапевтического воздействия.
а  б
б 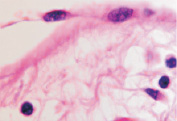 в
в 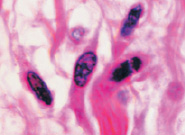
Рис. 7. Структурная организация инфильтрата в зоне повреждения HPV. Окраска гематоксилин-эозином. Микрофото. Ув.: а, б – х400; в – х800
а 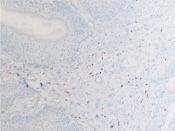 б
б 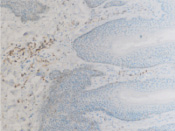
в  г
г 
Рис. 8. а – АПК при папилломовирусе идентифицируются только в соединительной ткани дермы кожи человека; б – CD4 в больших количествах идентифицируются в эпидермисе, и только на ранних стадиях инфекционного процесса в незначительных количествах присутствуют среди кератиноцитов эпидермиса, мигрируя до шиповатого слоя (в, г). Микрофото. ИГХ. Ув. х100
По мнению большинства авторов, HPV-инфекция приводит прямо и косвенно к геномной нестабильности в пользу преобразования и прогрессирования злокачественности клеток [45]. Суммированные представления о молекулярных механизмах HPV индуцированной неоплазии, с указанием роли 2 вирусных онкобелков: E6 и E7, дали возможность авторам считать, что на основе глубокого понимания роли этих белков HPV в неопластических процессах будет основана противовирусная терапия, направленная на выключение запущенных общих механизмов онкогенеза. Наши результаты с участием пришлых клеток в канцерогенезе при HPV инфекции не согласуются с мнением Lehoux M., D’Abramo C.M., Archambault J. (2009) и Zur Hausen H. (2011), концепции канцерогенеза которых базируются на малигнизации собственных камбиальных клеток ткани при HPV, и которые имеют глубокое убеждение, что канцерогенез как сложный и многоступенчатый процесс требует приобретения нескольких генетических или эпигенетических изменений под влиянием HPV для индуцированной неоплазии, однако при частичном посредничестве внутренних функций вирусных белков [10, 42].
Патогенетические аспекты, связывающие влияние HPV и модулирование клеточного цикла, во время развертывания которого нарушаются механизмы иммунного контроля за пролиферацией, развивается старение клеток и включается апоптоз, несмотря на то, что совпадают с нашими результатами, тем не менее принципиально отличаются, так как опухоль, по нашим данным, развивается не из камбиальных кератиноцитов, а из клеток-мигрантов. Jian Y., Van Tine B.A., Chien W.M., Shaw G.M., Broker T.R., Chow L.T. (1999) в отличие от многих авторов, указывающих на тропность папилломавирусов к камбиальным клеткам эпителия, утверждают, что вирус папилломы человека (ВПЧ) встречается только в дифференцированных кератиноцитах многослойного плоского эпителия. В специализированных кератиноцитах белок Е7 HPV повторно активирует механизм репликации ДНК для поддержки репликации вирусной ДНК, поэтому дальнейший синтез ДНК в кератиноцитах не происходит [20].
Современные проблемы патологии различных систем органов, в состав которых входят покровные эпителии, диктуют необходимость перехода от хирургических аспектов к молекулярно-генетическим как в плане этиотропного лечения, так и патогенетически обоснованных методов диагностики и лечения. Malinowski D.P. (2007) считает, что своевременная диагностика канцерогенеза во многом зависит от разработки критериев гистологической оценки образцов биоптатов [25], так как на повестке дня основными являются не только вопросы изучения генерализованных сдвигов в иммунной системе, но и методы коррекции локальных иммунных барьеров эпителиальных пластов для обеспечения восстановления физиологических запросов барьерных функций эпителия. Структурный и иммунофагоцитарный гомеостаз являются одними из важнейших факторов адаптации организма к различным условиям окружающей среды. Поддержание тканевого гомеостаза обеспечивается сохранением баланса между вновь образующимися и гибнущими клетками: эпителиоцитами и эффекторными клетками воспаления (гранулоцитами, лимфоцитами, макрофагами). Регуляция пролиферативных процессов – важнейшего компонента поддержания тканевого гомеостаза – имеет многоуровневый характер и достигается взаимодействием внутриклеточных, межклеточных, гормональных, иммунных и других факторов.
Важнейшими условиями, определяющими состояние покровных тканей, являются не только характер регенераторных процессов в эпителиальной пластинке и прилежащей соединительной ткани, но и взаимодействие между клеточными дифферонами эпителиальной пластинки, местными иммуноцитами и стромальными клетками, их состав и функциональная активность. Нарушения в системе этих взаимоотношений приводят к развитию воспалительного процесса и активации иммунных реакций с вовлечением продукции цитокинов. В настоящее время механизмы эпителиально-мезенхимальных взаимодействий в условиях патологического процесса и возникновения эпителиального дефекта в слизистых оболочках остаются невыясненными. Единичные работы о влиянии регуляторных факторов на состояние клеточного звена иммунитета не создают цельной картины механизмов межклеточного взаимодействия между лимфоцитами и эпителиоцитами в иммунном ответе. Всё это диктует необходимость более углублённого исследования функциональной активности иммунокомпетентных клеток слизистых оболочек и кожи с учётом сложной взаимосвязи между состоянием различных звеньев иммунной системы.
Изучение нами HbP-инфекции при язвенном процессе в желудке, а также на фоне кишечной метаплазии и онкогенеза показали, что штаммы HbP Приморского края имеют происхождение от европейских штаммов, а не азиатских, как предполагали ранее. Это имеет большое значение в условиях современных масштабов мировой миграционной активности населения (рис. 9).
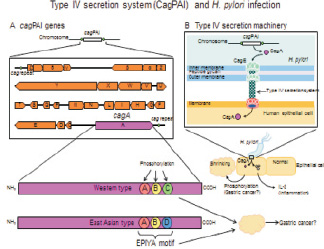
Рис. 9. Характеристика генома HbP у пациентов с диагностированным канцерогенезом. IV тип секреции (CagPAI) при HbP-инфекции
Одна из гипотез Chiariotti L., Angrisano T., Keller S., Florio E., Affinito O., Pallante P., Perrino C., Pero R., Lembo F. (2013), предполагает, что HвР при взаимодействии с клетками желудочного эпителия инициирует эпигеномные перепрограммирования, которые впоследствии ведут к опухолевому росту [10]. Обилие экспериментальных доказательств показало, что некоторые эпигенетические изменения лежат в основе канцерогенеза желудка и что эти изменения представляют собой один из основных признаков рака желудка. Однако некоторые важные вопросы остаются без ответа и доказательств: провоцирует ли HвР непосредственно эпигеномные изменения? Какие механизмы лежат в основе этих явлений? Основываясь на имеющихся в настоящее время данных, часто бывает трудно различить эпигеномные изменения, непосредственно вызванные HвР в желудочных эпителиоцитах, и те изменения, которые опосредованы воспалительным процессом в сопровождении многих других молекулярных и генетических событий, происходящих во время канцерогенеза в желудке. Методом сканирующей электронной микроскопии и иммуногистохимического выявления HbP нами установлено, что микрооганизмы идентифицируются в просвете желёз желудка на поверхности эпителиоцитов (рис. 10).
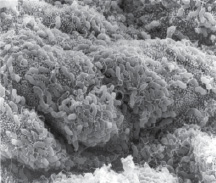
Рис. 10. HbP в просвете желудка. Сканограмма. Ув. х50000
Изучение зависимости развития язвы желудка и малигнизации от штаммов, ассоциированных с канцерогенезом, имеющих гены высокой патогенности cagA и vacA, показали одинаковые сдвиги в локальном иммунном гомеостазе слизистой оболочки в пилорическом, фундальном и кардиальном отделах желудка. Это может свидетельствовать, по нашему мнению, о том, что главную ключевую роль в патогенезе язвы желудка и канцерогенезе играет не патогенность возбудителя, а состояние локального иммунного гомеостаза слизистой оболочки желудка (рис. 11). B. Marshall (2013) [26-33], Iacovides D., Michael S., Achilleos C., Strati K. (2013) также считают преждевременным заключение об исключительной роли HbP в канцерогенезе [19]. Выявленная нами, как и другими авторами, предшествующая канцерогенезу атрофия слизистой оболочки желудка свидетельствует об общих механизмах канцерогенеза в тканях различных органов.
а 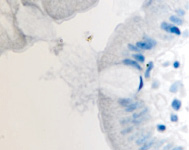 б
б 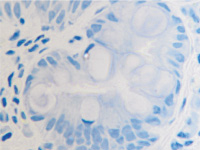
в 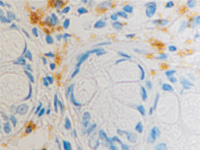 г
г 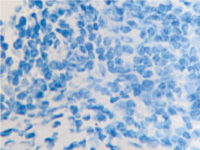
Рис. 11. Стенка желудка человека: а, б, в – кишечная метаплазия; г – рак. Иммунная гистохимия. Иммуноциты идентифицируются в соединительной ткани собственной пластинки слизистой оболочки желудка. При раке АПК клетки отсутствуют (в). Микрофото. Ув. х 200.
Если учесть, что первая эмбриональная стволовая клетка – зигота, на определённом этапе даёт общую стволовую клетку для всех тканей внутренней среды (кровь, соединительная ткань, костная ткань и т.д.), а также пул клеток, заселяющих эпителиальные пласты и представляющих собой самоподдерживающуюся тимусонезависимую популяцию, нарушения в дифференцировке этих клеток могут являться гипотетической причиной их участия в канцерогенезе.
Истощение или гибель стволовых клеток любой ткани под влиянием тропных к камбию микрорганизмов, включение тотального апоптоза, нарушение системы микроокружения, влияющей на дифференцировку камбиальных клеток, свидетельствуют о начале канцерогенеза. Апоптоз-фагоцитоз дают сигнальные молекулы для повышения пролиферации камбия ткани, а затем ведут к истощению регенераторного потенциала. Включается каскад изменений клеточных взаимодействий в ткани, вызванный влиянием факторов канцерогенеза (микрорганизмы, эстрогены, УФЛ и т.д.). За этим процессом следует миграция из ткани АПК клеток в прилежащие к зоне повреждения слои с последующим нарушением антигенпрезентации контаминирующих микроорганизмов, нарушением алгоритма защитной иммунной реакции в отсутствие эффекторных иммуноцитов, а также прекращение реституции, физиологической и нормальной репаративной регенерации. Сигнальные белковые молекулы гибнущих камбиальных клеток индуцируют повышение пролиферации, а в связи с неполноценностью клеток, способных закрыть дефект в отсутствие выполнения функций, развивается тотальный апоптоз. Повышение репаративной пролиферации, образование пула неэффекторных клеток, отсутствие фактора дифференцировки (для красного костного мозга – клеток крови, для других органов – стволовых вне- и интратканевых полипотентных клеток. Попытка полипотентной стволовой клетки для репарации повреждённого участка и отсутствие фактора дифференцировки, который вырабатывают клетки ткани, включают неограниченную пролиферацию стволовых клеток-мигрантов. Дочерние клетки не дифференцируются и тем более не специализируются. Репродукция клеток приобретает патологические черты с неравномерным распределением хроматина. Часть клеток в начале канцерогенеза может приобретать свойства нормальных, но в отсутствие полной дифференцировки, функция их направлена на секрецию патологических и неполноценных производных, не соответствующих реальному физиологическому запросу ткани.
Учитывая то, что стволовая клетка защищена от включения апоптоза, от лучевой и химиотерапии, зато обладает высоким пролиферативным потенциалом, не распознаётся макрофагами как чужая, или повреждённая, идентифицированные нами клетки в зоне малигнизации соответствуют этим критериям. При этом неконтролируемая пролиферативная активность выявленных клеток с аномальными митозами может повлиять на концентрацию ДНК, но не на последовательность нуклеотидов в клетке или мутации. Из этого следует, что применение методов с подавлением микроРНК длиной 21–25 нуклеотидов, активирующей онкогены и контролирующей экспрессию генов, гипотетически бессмысленно в подавлении канцерогенеза.
Учитывая факт отсутствия реакции стволовых клеток на химиотерапию и лучевые воздействия, придётся пересмотреть вопрос патогенетической обоснованности этих методов лечения рака. Стратегия в решении проблемы канцерогенеза заключается в поиске сигнальных молекул, вызывающих миграцию АПК из зоны повреждения, сигналов от гибнущих камбиальных клеток, а также в определении общей стволовой полипотентной клетки для различных тканей. Что касается вопроса разработки вакцины на основе дендритных клеток, активирующих макрофаги к фагоцитозу раковых клеток по методу Steinman Ralph M. (2010), вряд ли решение будет иметь перспективы в ближайшее время, поскольку раковая клетка не несёт на своей поверхности детерминант несовместимости [13].
Выводы
1. Процесс онкогенеза в организме при любой и предполагаемой инфекционной этиологии можно разделить на 2 стадии:
I – изменения местного локального иммунного гомеостаза (повышение пролиферативной активности – метаплазия – инфильтрация эффекторными клетками крови зоны повреждения кератиноцитов – апоптоз – перераспределение АПК – деструкция базальной мембраны);
II – генерализованный процесс в организме – нарушения в системе кроветворения и иммуногенезе – миграция стволовых клеток крови в зону повреждения кожи – вторичный иммунодефицит.
2. В онкогенезе участвуют не камбиальные клетки повреждённой ткани, а стволовые клетки крови или стволовые тканевые мигранты. Это объясняет, почему даже при малых размерах меланоцитарной опухоли идёт стремительный канцерогенез: включается генерализованный процесс сбоя системы кроветворения и иммуногенеза.
3. «Точка невозврата» при канцерогенезе возникает раньше, чем появляются клинические признаки патологии. Стратегия разработки ранней диагностики должна быть направлена на поиск сигналов гибнущего камбия, не обязательно биохимической природы, возможно, электрической или магнитной сенсорной природы.
Работа выполнена при поддержке Научного фонда ДВФУ и Международного гранта ДВФУ (соглашение № 13-09-0602-м_а от «6» ноября 2013 г.).
Рецензенты:
Храмова И.А., д.м.н., профессор, Приморский краевой диагностический центр, г. Владивосток;
Шульгина Л.В., д.б.н., профессор, заведующая лабораторией микробиологии, ФГУП ТИНРО-Центр (Тихоокеанский научно-исследовательский рыбохозяйственный центр), г. Владивосток.
Работа поступила в редакцию 04.02.2014.



