Цель исследования – изучить патоморфологическую картину сосудистого русла у больных с тромбоэмболией мелких ветвей легочной артерии.
Тромбоэмболия мелких ветвей легочной артерии является одной из ведущих причин внезапной смерти наряду с инфарктом миокарда, инсультом [1, 3]. Диагностика тромбоэмболия мелких ветвей легочной артерии трудная задача, поскольку ее клиническая картина не имеет строгой специфичности [3, 7] и часто ассоциируется с обострением основного заболевания (ИБС, ХОБЛ, пневмония, хирургическая патология и т.д.). В связи с чем в 60–80 % случаев диагноз «тромбоэмболия мелких ветвей легочной артерии» устанавливается при патологоанатомическом исследовании. Летальность при этом без патогенетической терапии составляет более 40 %, а при своевременно начатой терапии колеблется от 2 до 8 % [7].
Несмотря на большое количество работ, посвященных тромбоэмболии мелких ветвей легочной артерии, нет единого мнения об уровне и характере повреждения приводящих сосудов микроциркуляторного русла, наиболее часто встречающихся зон и процент повреждения легочной ткани, их значимость в механизме данного осложнения.
Материалы и методы исследования
Исследованы легкие и сосуды микроциркуляторного русла малого круга кровообращения, а также венозные сосуды нижних конечностей у 19 умерших больных с диагностированной прижизненно и/или посмертно тромбоэмболией мелких ветвей легочной артерии, находившихся на лечении в ОРИТ ОКБ г. Саратова с 01.03.2012 по 01.03.2013 г., из них 13 женщин и 6 мужчин Эпидемиологическая характеристика больных представлена в табл. 1.
Возраст пациентов составил от 24 до 87 лет. В 89 % случаев тромбоэмболические осложнения возникали при известных факторах риска (артериальная гипертензия, ожирение, атеросклероз, сахарный диабет, варикозная болезнь нижних конечностей). В 95 % случаев у всех больных имелась тенденция к избыточной массе тела, о чем свидетельствовал высокий индекс массы тела (И.М.Т.). При проведении системного патологоанатомического исследования использовался метод полного извлечения органов (метод Г.В. Шора 1925). Учитывая частоту причин тромбообразований последовательно производился поиск тромбов в системе поверхностных и глубоких вен нижних конечностей, начиная с дистальных отделов и заканчивая подвздошными венами. Вскрытие сердца осуществлялось «по току крови». При детальном осмотре полостей сердца особое внимание обращалось на состояние эндокарда (наличие пристеночных тромбов между трабекулами и в ушках предсердий). Также тщательным образом были осмотрены легкие и сосуды малого круга кровообращения с целью выявления факта тромбоэмболических осложнений. Следует отметить, что при использовании этого и других методов патологоанатомического исследования в 1–2 % случаев источников тромбоэмболии мелких ветвей легочной артерии обнаружить не удается (В.С. Савельев 2003). Для окончательного подтверждения патологоанатомического диагноза образцы выявленных участков легких и сосудов направлялись в гистологическую лабораторию, где после соответствующей обработки, методом ОКГ – что соответствует названиям основных красителей: оранжевый – Ж, кислотный красный – 2С и водный голубой – (Д.Д. Зербино., Л.Л. Лукасевич 1989), исследовались под микроскопом. При изучении истории болезни умерших пациентов от тромбоэмболии мелких ветвей легочной артерии анализировались результаты всех лабораторных и инструментальных методов исследования, проводившихся в стационаре.
Таблица 1
Эпидемиологическая характеристика больных
|
№ п /п |
Пол |
Возраст |
Масса тела (кг) |
Рост (м) |
И.М.Т. |
|
1. |
М. |
79 |
75 |
1,7 |
22 |
|
2. |
Ж. |
24 |
80 |
1,6 |
25 |
|
3. |
Ж. |
41 |
82 |
1,6 |
26 |
|
4. |
М. |
24 |
55 |
1,6 |
17 |
|
5. |
Ж. |
58 |
92 |
1,6 |
28 |
|
6. |
Ж. |
61 |
88 |
1,6 |
27 |
|
7. |
Ж. |
52 |
70 |
1.6 |
21 |
|
8. |
М. |
53 |
90 |
1,7 |
26 |
|
9. |
Ж. |
75 |
98 |
1,6 |
30 |
|
10. |
М. |
52 |
76 |
1,7 |
22 |
|
11. |
М. |
63 |
98 |
1,5 |
32 |
|
12. |
М. |
74 |
88 |
1,6 |
44 |
|
13. |
Ж. |
74 |
96 |
1,6 |
29 |
|
14. |
Ж. |
32 |
64 |
1,6 |
20 |
|
15. |
Ж. |
87 |
96 |
1,6 |
30 |
|
16. |
Ж. |
58 |
98 |
1,6 |
30 |
|
17. |
Ж. |
85 |
62 |
1,5 |
20 |
|
18. |
Ж. |
72 |
84 |
1,5 |
28 |
|
19. |
Ж. |
68 |
80 |
1,5 |
26 |
Примечание. И.М.Т. – индекс массы тела.
Результаты исследований и их обсуждение
В структуре заболеваний умерших от тромбоэмболии мелких ветвей легочной артерии наибольший удельный вес имели больные с различной хирургической патологией (острый холецистит – 30 % случаев, заболевания опорно-двигательного аппарата – 20 % случаев). В связи с чем всем выполнялись хирургические вмешательства (холецистэктомия, остеосинтез, имплантация тазобедренного сустава), а также терапевтическая группа больных (острый инфаркт миокарда – 35 % больных, ХОБЛ – 10 %).
Сопутствующая патология, локализация и зона повреждения легочной ткани отражены в табл. 2.
Как видно из представленной табл. 2, из сопутствующих заболеваний преобладали: артериальная гипертензия 2 стадии, риск 3, которую имели 17 (89 %) пациентов, у 11 (57 %) пациентов имелась варикозная болезнь нижних конечностей, у 13 (68 %) больных фоновая патология – ожирение 2–3 степени. Характерными клиническими признаками при эмболии мелких ветвей легочной артерии, были синусовая тахикардия до 110 ударов в минуту, желудочковая экстрасистолия, блокада правой ножки пучка Гиса, артериальная гипотензия со снижением уровня АД до 80–70/50 мм рт.ст., одышка в покое до 25–28 ударов в минуту, цианоз лица и шеи. Диагностическая значимость ЭКГ при эмболии мелких ветвей легочной артерии значительно возрастала при сопоставлении ее результатов с данными других методов исследования (рентгенографией органов грудной клетки) и клинической симптоматикой. Патологические изменения на рентгенограммах органов грудной клетки при жизни были выявлены у 15 (78,9 %) больных. Наиболее часто выявлялись признаки инфильтрации легочной ткани, расширение корней легких, плевральный выпот, высокое стояние купола диафрагмы.
Таблица 2
Сопутствующая патология, локализация и зона повреждения (%) легочной ткани
|
№ п/п |
Варикозная болезнь |
Артериальная гипертензия |
Ожирение |
Пневмония |
Сахарный диабет |
ИБС |
Инсуль |
Зона повреждения легочной ткани |
% повреждения доли легкого |
|
1. |
+ |
+ |
– |
– |
– |
– |
– |
– |
– |
|
2. |
– |
+ |
+ |
– |
+ |
– |
– |
– |
– |
|
3. |
+ |
+ |
+ |
– |
– |
– |
– |
– |
– |
|
4. |
– |
– |
– |
+ |
– |
– |
– |
– |
– |
|
5. |
+ |
+ |
+ |
– |
– |
– |
– |
S6,7,9,10 |
~70 % |
|
6. |
+ |
+ |
+ |
– |
+ |
+ |
– |
S6,7,9,10 |
~70 % |
|
7. |
+ |
+ |
– |
– |
– |
+ |
– |
– |
– |
|
8. |
– |
+ |
– |
– |
– |
+ |
– |
S6,9,10 |
~60 % |
|
9. |
– |
+ |
+ |
– |
– |
+ |
– |
– |
– |
|
10 |
+ |
+ |
– |
– |
– |
– |
– |
S6,7,9,10 |
~70 % |
|
11 |
+ |
+ |
+ |
– |
– |
– |
– |
– |
– |
|
12 |
– |
+ |
+ |
– |
– |
+ |
+ |
– |
– |
|
13 |
– |
+ |
+ |
– |
– |
+ |
– |
– |
– |
|
14 |
+ |
– |
– |
– |
– |
– |
– |
– |
– |
|
15 |
– |
+ |
+ |
– |
– |
+ |
– |
S 7,9,10 |
~60 % |
|
16 |
+ |
+ |
+ |
– |
– |
+ |
– |
S7,9,10 |
~60 % |
|
17 |
+ |
+ |
+ |
– |
– |
+ |
– |
– |
– |
|
18 |
+ |
+ |
+ |
– |
– |
– |
– |
– |
– |
|
19 |
- |
+ |
+ |
– |
– |
+ |
– |
– |
– |
|
Итого |
11(57 %) |
17(89 %) |
13(68 %) |
1(1,9 %) |
2(3,8 %) |
11(57 %) |
1(1,9 %) |
Диагностика эмболии мелких ветвей легочной артерии в большинстве случаев была трудной в связи с многообразием симптоматики и наличием других послеоперационных осложнений. При этом возможности использования специальных методов исследования (синтиграфия, ангиография легких) были крайне ограничены из-за тяжести состояния больного. В связи с чем у больных с неустойчивыми показателями кровообращения выполнялась ЭхоКГ-исследование, что позволяло обнаружить признаки легочной гипертензии, перегрузку правого желудочка, а также исключить острый инфаркт миокарда, расслаивающуюся аневризму аорты. Положительный результат ЭхоКГ был основанием для постановки диагноза эмболии мелких ветвей легочной артерии. Во всех других случаях было необходимо проведение компьютерной томографии. Ангиография легких нами не использовалась в связи с высоким риском летальности у больных с неустойчивыми показателями кровообращения, высоким риском кровотечения на фоне антикоагулянтной терапии.
Для сопоставления клеточного состава эмбола в сосудах микроциркуляторного русла легких и тромба в венозной системе нижних конечностей нами был исследован их клеточный состав. Формирование регионарного тромба, очевидно, начинается с замедления кровотока, в том числе в сосудах нижних конечностей или как результат воспалительного процесса или травмы. При исследовании клеточного состава тромба в венозных сосудах нижних конечностей было выявлено: фрагментация тромба, большое количество эритроцитов, составляющих основную массу тромба (рис. 2), скопление лейкоцитов, тромбоцитов с волокнами фибрина, значительное количество периваскулярно расположенных лимфоцитов, что позволяет считать тромб, эмбол смешанным на фоне воспалительного процесса (рис. 4). По результатам наших исследований смешанный характер тромбов встречался в 96 % случаев.
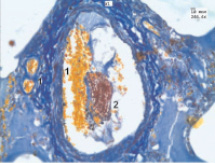
Рис. 1. Эмбол в просвете правой легочной артерии: 1 – эритроциты; 2 – фибрин
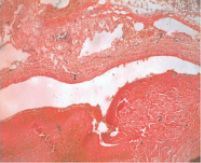
Рис. 2. Тромб в просвете левой подвздошной вене: 1 – стенка бедренной вены; 2 – тромб
Морфологические исследования сосудов легких показали, что помимо эмболов, находившихся в приводящих сосудах микроциркуляторного русла, образуются конгломераты различного клеточного состава, отличающиеся плотной упаковкой эритроцитов с формированием так называемых монетных столбиков, обтурирующих просвет сосудов и вызывающих нарушения вентиляционно-перфузионных отношений и тяжелую артериальную гипоксемию. Обтурация сосудов микроциркуляторного русла составляла не менее 70–80 %. Уже на ранних этапах формирования артериального тромба наблюдали набухание эндотелиальных клеток приводящих сосудов микроциркуляторного русла, что приводило к нарушению перемещения жидкости через альвеолярно-капиллярную мембрану и развитию отека последней. У всех больных были выявлены типичные, полностью сформированные эмболы. Указанные агрегаты тромбоцитов, эритроцитов и единичных лейкоцитов располагались не только пристеночно, но и свободно в просвете сосудов. Эмболы часто оказывались уже пристеночно организованными (рис. 1).
В отдельных артериолах кровоток вообще прекращается, о чем можно судить по структуре и взаимному расположению нитей фибрина. Как результат изменения текучих свойств крови происходит аксиальное смещение эритроцитов. На вышеописанном микроциркуляторном фоне обнаруживаются эмболы, находящиеся в различных периодах их формирования. Тромбы, эмболы имеют разнообразный состав и архитектонику (рис. 3).
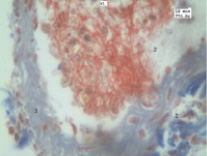
Рис. 3. Эмбол в просвете мелкой ветви правой нижней легочной артерии: 2 – эмбол; 3 – сосудистая стенка
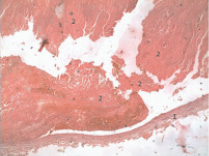
Рис. 4. Фрагментированный тромб в просвете левой подвздошной вены; 1 – сосудистая стенка; 2 – фрагментированный тромб
Механизм развития данного осложнения представляется следующим образом: в результате фрагментации тромба формируется эмбол, который с током крови попадает в приводящие сосуды микроциркуляторного русла легких. Раздражение рецепторного аппарата в сосудах легких приводит к острому рефлекторному спазму легочных сосудов (2, 3), значительному повышению давления в малом круге кровообращения, (7), отеку легкого, (3) прогрессированию артерио-венозного шунта, (6) выраженной сердечно-легочной недостаточности (2).
Заключение
Таким образом, установлено, что патоморфология образования тромботических и эмболических осложнений в легких происходит на уровне прекапилляров. Обтурация достигает 70–80 % диаметра сосуда. Выяснено, что в 97,6 % обтурируют приводящие сосуды микроциркуляторного русла эмболы. В 25 % случаев эмболические осложнения преобладали в задне-базальных отделах правого легкого, на уровне 6, 7, 9, 10 сегмента, на уровне 7, 9, 10 сегмента – 10 % случаев, процесс локализовался в нижней доле левого легкого. Общий процент повреждения легочной ткани в каждой доле легкого составил от 60 до 80 %. Выяснено, что клеточный состав тромба в подвздошной вене сопоставим с клеточным составом эмбола в мелких ветвях легочной артерии, а именно эритроциты, тромбоциты, единичные лейкоциты, фибринные сгустки. Полученные данные подтверждают эмболический характер тромба найденного в легких, с первичной локализацией тромба, в венозных сосудах нижних конечностей. В альвеолярной ткани преобладали выраженный интерстициальный отек с примесью эритроцитов, единичных сегментоядерных лейкоцитов, что приводило к повышенной проницаемости сосудистых стенок на уровне притекающих сосудов микроциркуляторного русла, нарушению перемещения жидкости через альвеолярно-капиллярную мембрану и развитию отека последней с клиническими проявлениями тяжелой артериальной гипоксемии.
Рецензенты:
Кулигин А.В., д.м.н., профессор кафедры скорой неотложной анестезиолого-реанимационной помощи ФПК ППС, ГБОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» Минздрава РФ, г. Саратов;
Щуковский В.В., д.м.н., профессор, главный научный сотрудник отдела инновационных проектов в нейрохирургии и вертебрологии, ФГБУ СарНИИТО Минздравсоцразвития России, г. Саратов.
Работа поступила в редакцию 04.02.2014.



