Белки являются главными мишенями для активных форм кислорода и азота из-за своей высокой чувствительности к свободным радикалам [9] и распространенности в биологических материалах [10, 11], а также они ответственны за большинство функциональных процессов клетки, вследствие чего их окислительная модификация представляет значительный интерес. Карбонильные производные белков являются стабильными продуктами, которые образуются не только за счет окисления активными формами кислорода и азота, но и при взаимодействии продуктов свободно-радикального окисления липидов с остатками аминокислот в составе белков [2, 14].
В свою очередь оксид азота, с одной стороны, способен замедлять Fe2+-индуцируемое перекисное окисление липидов [13], проявляя антиоксидантные свойства, а с другой стороны, при взаимодействии NО с анион-радикалом (О2–) образуется высокоактивное соединение пероксинитрит (ОNОО–), оказывающее повреждающее действие [17]. Угнетение синтеза оксида азота, возможно, способно оказывать как прооксидантный, так и антиоксидантный эффект. Одним из антагонистов синтеза окcида азота является N-нитро-L-аргининметиловый эфир (L-NAME), представляющий собой неселективный ингибитор индуцибельной NO-синтазы.
Оксид азота (II) проявляет не только токсическое и защитное действие [20], но и является центральной молекулой иммунной системы [12], в формировании которой принимает участие периферический иммунокомпетентный орган – селезенка [5].
В связи с этим актуальным является изучение окислительной модификации белков селезенки крыс в условиях моделирования дефицита синтеза оксида азота (II).
Цель исследования: провести комплексную оценку продуктов спонтанной окислительной модификации белков селезенки крыс под действием L-NAME в дозе 25 и 200 мг/кг, определив глубину окислительного повреждения белков по концентрации стабильных модификаций триптофана и тирозина в белках, и оценить резервно-адаптационный потенциал клеток селезенки.
Материалы и методы исследования
Исследование проводили на 24 конвенциональных половозрелых крысах-самцах линии Wistar массой 280–320 граммов, которые были разделены на контрольную и экспериментальные группы. Первой экспериментальной группе (n = 8) ежедневно, в течение 7 дней внутрибрюшинно вводили L-NAME в дозе 25 мг/кг [4], второй экпериментальной группе (n = 8) внутрибрюшинно вводили L-NAME в дозе 200 мг/кг [19]. Контрольной группе животных (n = 8) в те же сроки осуществляли внутрибрюшинное введение физиологического раствора.
Содержание животных в виварии соответствовало «Санитарным правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник» от 06.04.1993. Все манипуляции с животными, в том числе и выведение из эксперимента осуществляли в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приказ Минздрава СССР № 755 от 12.08.1977 г.).
Немедленно после выведения животного из эксперимента ткань селезенки помещали в холодный 0,25 М раствор сахарозы в соотношении 1/10 и гомогенизировали в течение 35 секунд при 900 об/мин в гомогенизаторе Potter S. Описанные процедуры проводили при температуре не выше 4 °С.
Полученный гомогенат центрифугировали 10 мин при 1000 g для осаждения не полностью разрушенных клеток и ядер. Надосадочную жидкость центрифугировали 15 мин при 14000 g для удаления митохондрий, а затем полученный супернатант – дополнительно при 20000 g в течение 30 мин для получения чистой цитоплазматической (неседиментируемой) фракции, в которой и определяли окислительную модификацию белков.
Окислительную модификацию белков оценивали по методу R.L. Levine в модификации Е.Е. Дубининой [1], после осаждения нуклеиновых кислот 10 %-м раствором стрептомицина сульфата. Карбонильные производные окисленных белков регистрировали на спектрофотометре при следующих длинах волн: 254, 270, 280, 356 нм (альдегид-динитрофенилгидразоны нейтрального характера – АДНФГн), 363 и 370 нм (кетон-динитрофенилгидразоны нейтрального характера – КДНФГн), 428 и 430 нм (альдегид-динитрофенилгидразоны основного характера – АДНФГо) и 434, 524, 530, 535 нм (кетон-динитрофенилгидразоны основного характера КДНФГо). Перечисленные длины волн выбраны в соответствии с диапазонами, в которых регистрируются динитрофенилгидразоны. Из данных литературы известно, что для АДНФГн. спектр поглощения зарегистрирован в диапазоне 230–558 нм, АДНФГо – в диапазоне 258–264 и 428–520 нм, для КДНФГн спектр поглощения 363–367 нм, КДНФГо – 430 – 434 и 524–535 нм [1].
По полученным значениям экстинкций строили спектр окислительной модификации белков и подсчитывали площадь под кривой [8], выраженной в условных единицах на грамм белка (у.е./г белка).
Содержание битирозина и окисленного триптофана определяли флуориметрическим методом. Окислительная модификация тирозиновых остатков белков измерялась по образованию битирозина, который обладает характерной флуоресценцией [7]. Окисление триптофановых остатков сопровождается снижением флуоресценции, характерной для триптофана [18].
Для каждой выборки вычисляли характеристики: медиану (Me), квартиль 1 и квартиль 3 [Q1; Q3]. Поскольку отмечалось отсутствие согласия данных с нормальным распределением, для оценки достоверности различий независимых выборок использовали ранговый критерий Манна‒Уитни (U-тест).
Результаты исследования и их обсуждение
Из данных, приведенных на рис. 1, следует, что под действием L-NAME в дозе 25 мг/кг уровень карбонильных производных увеличивается по сравнению с контролем. Важно отметить, что статистически значимое увеличение динитрофенилгидразонов отмечено в диапазонах 428–430, 434–520 нм что составит площадь АДНФГо; 430–434, 520–535 нм – площадь КДНФГо. Из этого следует, что образование карбонильных производных белков под действием L-NAME в малой дозе происходит преимущественно за счет окисления остатков аминокислот, обладающих основными свойствами, о чем свидетельствует преобладание АДНФГ и КДНФГ основного характера.
Что же касается влияния L-NAME в дозе 200 мг/кг, то отмечалось также повышение окислительной модификации белков по сравнению с контролем: достоверно значимые различия отмечались для КДНФГ нейтрального характера и АДНФГ и КДНФГ основного характера (рис. 2). Данный факт позволяет предположить, что мишенью помимо основных становятся и нейтральные остатки аминокислот.
В дозе 200 мг/кг L-NAME способствует преобладанию вторичных маркеров окислительного стресса – КДНФГ нейтрального характера по сравнению с дозой 25 мг/кг (рис. 3). Таким образом, L-NAME в дозе 200 мг/кг способствует усугублению окислительных процессов, о чем свидетельствует активный переход первичных маркеров окислительного стресса во вторичные.
Известно, что существует несколько путей образования карбонильных производных белков, одним из которых является прямое воздействие на аминокислотные остатки боковых цепей активных форм кислорода [2, 10], генерация которых в условиях угнетения синтеза оксида азота (II) может происходить за счет подавления антиоксидантной системы, а именно каталазы и α-токоферола [16]. Известно, что перекисное окисление липидов также ингибируется благодаря взаимодействию NO с алкилпероксильными и алкоксильными радикалами [6]. А именно поэтому в условиях моделирования дефицита синтеза оксида азота (II) образование карбонильных производных может происходить за счет взаимодействия продуктов свободно-радикального окисления липидов с остатками аминокислот в составе белков [1, 15].
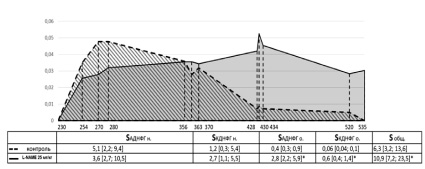
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05)
Рис. 1. Спектр окислительной модификации белков и значения площадей под кривыми групп контроля и L-NAME 25 мг/кг селезенки крыс
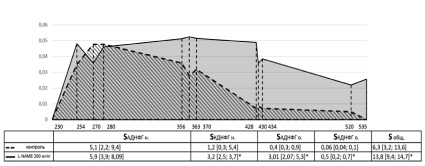
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05)
Рис. 2. Спектр окислительной модификации белков и значения площадей под кривыми групп контроля и L-NAME 200 мг/кг селезенки крыс
Следует отметить, что при взаимодействии активных форм кислорода со сложными белками происходит модификация полипептидной цепи и небелкового компонента, который чаще всего имеет в своем составе негемовое железо [1], данный процесс получил название металл-катализируемого окисления [9]. Однако избыток NO способен связываться с ионами Fe2+, а именно низкомолекулярные динитрозильные комплексы негемового железа (ДНКЖ) являются переносчиками NO, а белковые ДНКЖ – стабильными депо оксида азота [6]. В условиях модуляции дефицита синтеза оксида азота возможна деструкция связанных с белком ДНКЖ, в результате чего образуются ассоциированные с белковой цепью свободные радикалы [6], способные оказывать повреждающее действие.
В результате окислительной модификации белков происходит не только формирование карбонильных групп, но и изменение флуоресценции белков [9].
Из результатов, приведенных в таблице, следует, что в экспериментальных группах происходит снижение образования битирозина. Незначительный уровень окисленного тирозина свидетельствует о том, что процессы агрегации белковых молекул не преобладают. О снижении процессов фрагментации в условиях данных экспериментальных моделей свидетельствует понижение образования окисленного триптофана, так как наблюдается статистически значимое повышение флуоресценции данной аминокислоты (таблица).
Показатели изменения флуоресценции белков в гомогенате селезенки крыс контрольной и экспериментальных групп (Ме [Q1; Q3])
|
Показатель |
Контроль (n = 8) |
L-NAME 25 мг/кг (n = 8) |
L-NAME 200 мг/кг (n = 8) |
|
Битирозин, интенсивность флуоресценции, ед. на 1 г белка |
0,15 [0,14; 0,17] |
0,11 [0,09; 0,13]* |
0,12 [0,10; 0,13]* |
|
Триптофан, интенсивность флуоресценции, ед. на 1 г белка |
0,31 [0,29; 0,33] |
0,71 [0,69; 0,73]* |
0,71 [0,61; 0,76]* |
Примечание. * – статистически значимые отличия от контрольной группы (р < 0,05).
Опасность формирования белковых фрагментов и агрегатов заключается в том, что они способны ингибировать протеолитическую систему [14]. Снижение присутствия нерепарируемых стабильных модификаций триптофана и тирозина в белках в условиях модуляции дефицита синтеза NO можно считать позитивной ролью влияния L-NAME в дозе 25 и 200 мг/кг на селезенку. Таким образом, можно выделить потенциально важную роль карбонильных производных белков, которые более чувствительны к протеолизу, чем их нативные аналоги [14]. Карбонильные производные протеинов способны направляться в протеолитическую систему, что будет способствовать обновлению белков и утилизации поврежденных. Для оценки данного процесса можно использовать параметр резервно-адаптационного потенциала.
Оценка резервно-адаптационного потенциала производилась путем подсчета соотношения площадей под кривой карбонильных производных белков при спонтанном окислении протеинов к индуцированному по реакции Фентона, предполагая, что КДНФГинд и АДНФГинд равно 100 % [3]. График зависимости полученных данных от вводимой дозы L-NAME представлен на рис. 4 и 5.
Примечание. * – статистически значимые отличия от контрольной группы (р < 0,05)
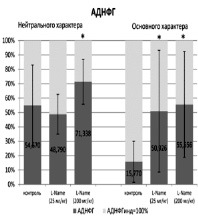
Рис. 3. Отношение площади под кривой альдегид-динитрофенилгидразонов, полученных при спонтанном окислении, к площади, полученной при индуцированном окислении белка
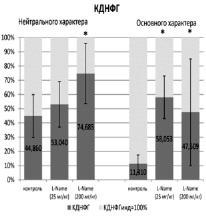
Рис. 4. Отношение значений кетон-динитрофенилгидразонов, полученных при спонтанном окислении, к значениям, полученным при индуцированном окислении белка
Из представленных рис. 4 и 5 следует, что статистически значимые различия между резервно-адаптационным потенциалом контрольной и экспериментальных групп отмечено для АДНФГ и КДНФГ основного характера, при этом между экспериментальными группами статистически значимые различия не отмечаются. Следовательно, внутрибрюшинное введение L-NAME в дозе 25 и 200 мг/кг приводит к накоплению АДНФГ и КДНФГ основного характера независимо от дозы, и еще АДНФГ и КДНФГ нейтрального характера при введении дозы 200 мг/кг. Полученная тенденция отражает снижение возможности обновления белков селезенки крыс, что приводит к накоплению поврежденных, имеющих слабую функциональную активность белков.
Выводы
1. L-NAME способствует образованию карбонильных производных белков по сравнению с контролем: в дозе 25 мг/кг АДНФГ и КДНФГ основного характера, а в дозе 200 мг/кг дополнительно КДНФГ нейтрального характера, при этом отмечается снижение резервно-адаптационного потенциала клеток иммунокомпетентных органов.
2. L-NАME в дозе 200 мг/кг способствует усугублению окислительных процессов по сравнению с дозой 25 мг/кг за счет преобладания вторичных маркеров (КДНФГ нейтрального характера).
3. Моделирование дефицита синтеза оксида азота препятствует образованию битирозина и окисленного триптофана, изменения не зависят от вводимой дозы.
4. Под действием N-нитро-L-аргининметилового эфира происходит независимое от дозы накопление АДНФГ и КДНФГ основного характера, накопление АДНФГ и КДНФГ нейтрального характера происходит под действием дозы 200 мг/кг, что свидетельствует об истощении резервно-адаптационного потенциала белков селезенки крыс.
Рецензенты:
Емельянова А.С., д.б.н., профессор кафедры технологии производства и переработки продукции животноводства, ФГБОУ ВПО «Рязанский государственный агротехнологический университет имени П.А. Костычева», г. Рязань;
Рябков А.Н., д.м.н., доц. кафедры фармакологии с курсом фармации и фармакотерапии, ФДПО ГБОУ ВПО «Рязанский государственный медицинский университет имени академика И.П. Павлова» Минздрава России, г. Рязань.
Работа поступила в редакцию 17.01.2014.



