Острый инфаркт миокарда (ИМ) остается одной из актуальных проблем современной практической кардиологии и занимает печально лидирующее положение среди всех летальных исходов, обусловленных кардиологической патологией [5]. Количество факторов риска развития ИМ постоянно возрастает [9], они приводят к эндотелиальной дисфункции и инициируют воспалительную реакцию [4]. Воспаление сопровождается активацией процессов свободнорадикального окисления [8]. Активация перекисного окисления липидов является начальной и постоянной составной частью основных звеньев патогенеза ИМ [2]. Участие свободнорадикальных процессов в развитии различных патологических состояний ставит вопрос о возможности профилактики и коррекции таких нарушений фармакологическими средствами [7]. На сегодняшний день нет сомнений в важности и актуальности поиска новых химических соединений, которые обладают антиоксидантными свойствами, на основе которых могут быть созданы лекарственные препараты [6]. К одному из наиболее перспективных классов синтетических антиоксидантов относятся кардиопротекторы-антиоксиданты из класса 3-оксипиридинов [3]. Поэтому целесообразно исследовать новые производные 3-оксипиридина.
Целью нашей работы явилась оценка эффективности 3-оксипиридина ацетилцистеината и 3-оксипиридина сукцината при острой сердечной недостаточности в эксперименте.
Материалы и методы исследования
Эксперименты проводились на 24 нелинейных белых крысах, содержащихся в стандартных условиях вивария. Моделирование острого инфаркта миокарда проводилось, после подключения наркотизированных (уретаном 800 мг/кг) животных к аппарату искусственной вентиляции легких. Производили левостороннюю торакотомию в четвертом межреберье, рассекали перикард, обнажали сердце и при помощи атравматичной иглы подводили лигатуру и перевязывали нисходящую ветвь левой коронарной артерии. Продолжительность окклюзии сосуда составляла 40 мин.
Исследовано 3 группы животных, по 8 крыс в каждой группе: 1-я – контроль с острым инфарктом миокарда без коррекции, 2-я – с коррекцией 3-оксипиридина сукцинатом в дозе 50 мг/кг и 3-я – с коррекцией 3-оксипиридина ацетилцистеинатом 50 мг/кг, вводимыми внутрибрюшинно, за 30 минут до формирования модели. По окончании эксперимента проводили оценку размеров анатомической зоны риска и зоны инфаркта с помощью методики «двойного окрашивания» синим Эванса и трифенилтетразолия хлоридом (ТТС). Подсчет площадей зоны риска и зоны инфаркта проводили на оцифрованных снимках поперечных срезов сердец, на персональном компьютере, с помощью программы ImageJ 1.45s. Для гистологического исследования кусочки миокарда фиксировали в 10 % растворе нейтрального формалина. Срезы окрашивали гематоксилином и эозином. На светооптическом уровне оценивали качественное состояние миокарда. Статистическая обработка материала осуществлялась с помощью пакета статистических программ «Excel» на персональном компьютере, расчеты достоверности различия средних арифметических велись с помощью t-критерия Стьюдента при 5 % уровне значимости.
Результаты исследования и их обсуждение
При «двойном окрашивании» синим Эванса и трифенилтетразолия хлоридом (ТТС) было выявлено, что объем зоны ишемии в контроле составил 54,9 ± 0,19 % от общего объема сердца, при коррекции 3-оксипиридина сукцинатом, данный показатель достоверно уменьшился по сравнению с контролем на 33 % (рк < 0,005), а при коррекции 3-оксипиридина ацетилцистеинатом на 10,11 %. Объем зоны некроза в контроле составил 37,59 ± 0,9 % по отношению к объему сердца, на фоне коррекции 3-оксипиридина сукцинатом, зона некроза уменьшилась на 36,95 % по сравнению с контролем, а на фоне коррекции 3-оксипиридина ацетилцистеинатом данный показатель был близок к показателям контрольной группы животных. Отношение площади некроза к площади ишемии в контроле составило 65 ± 4,09 %, при коррекции 3-оксипиридина сукцинатом значение данного отношения приближалось к таковым в контроле, а при коррекции 3-оксипиридина ацетилцистеинатом доставерно возросло на 20 % преимущественно за счет уменьшения объема зоны ишемии (рк < 0,005).
При микроскопическом исследовании миокарда, в контрольной группе животных отмечались изменения преимущественно дисциркуляторного характера в виде стромального отека ткани, неравномерного кровенаполнения интрамиокардиальных сосудистых ветвей: полнокровие венозных сосудов и капилляров с их дистонией и периваскулярным отеком, на фоне малокровия артериол и участков кровоизлияний в ткань миокарда. Поперечная исчерченность мышечных волокон нечеткая, а местами и вовсе пропадает. Межмышечные и периваскулярные пространства неравномерно расширены. Отмечалось набухание кардиомиоцитов с выраженной гомогенной эозинофилией цитоплазмы, приобретающий «лаковый» вид, с базофильными пикнотичными ядрами. Отмечались участки миофибриллярной дегенерации и участки волокнистых, извилистых волокон с фрагментами миоцитолиза, глыбчатого распада миофибрилл кардиомиоцитов. А также отмечались участки контрактурного повреждения кардиомиоцитов. В просвете кровеносных сосудов и в тканях миокарда прилегающих к сосудистой сети, наблюдалась начинающаяся лейкоцитарная инфильтрация преимущественно нейтрофильного характера (рис. 1). На фоне введения 3-оксипиридина сукцината стромальный отек ткани и периваскулярный отек выражены в меньшей степени. Очаговые кровоизлияния не наблюдались, хотя сохранялась дистония кровеносных сосудов, преимущественно венозного компонента с единичными эритроцитарными экстравазатами. Клеточная инфильтрация также обнаруживалась, но была менее интенсивной. Однако сохранялось набухание кардиомиоцитов с выраженной эозинофилией цитоплазмы, без пикноза ядер и глыбчатого распада миофибрилл (рис. 2). На фоне применения 3-оксипиридина ацетилцистеината стромальные и перицеллюлярные отеки были близки к контролю. Набухание кардиомиоцитов с эозинофилией цитоплазмы и пикнозом ядер менее выражено по сравнению с другими исследуемыми группами животных. Поперечная исчерченность мышечных клеток миокарда смазана, наблюдались зоны ее отсутствия. Сохранялись участки контрактурного повреждения кардиомиоцитов в меньшей степени, чем в контрольной группе. Дистония венозных сосудов и малокровие артериол были близки к таковым во 2-й группе животных. Клеточная инфильтрация выражена незначительно. Кровоизлияний и эритроцитарных экстравазатов не отмечено (рис. 3).
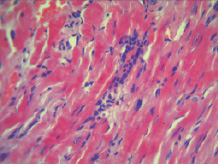
Рис. 1. Морфология миокарда при ОСН, контрольная группа. Окраска гематоксилином и эозином Ув. х400
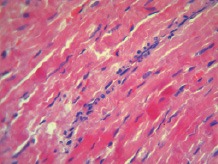
Рис. 2. Морфология миокарда при ОСН на фоне введения 3-оксипиридина сукцината. Окраска гематоксилином и эозином. Ув. х 400
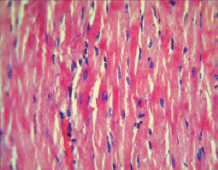
Рис. 3. Морфология миокарда при ОСН на фоне введения 3-оксипиридина ацетилцистеината. Окраска гематоксилином и эозином. Ув. х400
Заключение
3-оксипиридина сукцинат в дозе 50 мг/кг показал положительное действие на сердечную мышцу при остром инфаркте миокарда в эксперименте, выражающееся в достоверном уменьшении зоны риска в миокарде и уменьшении очага некроза кардиомиоцитов по сравнению со всеми остальными группами животных, что связано с его антиоксидантными и мембранпротекторными свойствами [1]. 3-оксипиридина сукцинат также эффективно корригировал морфологическую картину миокарда, что выражалось в значительном уменьшении межуточного и периваскулярного отека, отсутствии кровоизлияний и меньшей клеточной инфильтрацией по сравнению с контрольными животными.
3-оксипиридина ацетилцистеинат в дозе 50мг/кг оказывал менее выраженный кардиопротекторный эффект при остром инфаркте миокарда в эксперименте, что выражалось в меньшем по сравнению с применением 3-оксипиридина сукцинатом уменьшении площади ишемии и некроза и сохранении нарушений гемодинамики в миокарде.
Таким образом, более перспективно использовать 3-оксипиридина сукцинат в дозе 50 мг/кг по сравнению с 3-оксипиридина ацетилцистеинатом в дозе 50 мг/кг при остром инфаркте миокарда.
Рецензенты:
Сиприов А.В., д.м.н., профессор кафедры фармакологии и клинической фармакологии с курсом фармацевтической технологии, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарева», г. Саранск;
Столярова В.В., д.м.н., профессор кафедры госпитальной терапии, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарева», г. Саранск.
Работа поступила в редакцию 17.01.2014.



