Твердые диэлектрики с ионной проводимостью в последние десятилетия стали предметом интенсивных исследований в связи с появлением литий-ионных аккумуляторов, быстро завоевавших мировой рынок. Они нашли широкое применение как миниатюрные источники тока для питания сотовых телефонов, портативных компьютеров, фотоаппаратов и других мобильных устройств. Совершенствование известных и разработка новых материалов для подобных устройств составляют одну из важнейших задач современной физической химии твердого тела, причём центральное место здесь занимают твёрдые материалы с подвижными ионами для электродов и электролитов – основной объект нового направления – ионики твёрдого тела [1].
Следующим аспектом этого направления является получение композитных твердых электролитов, включая нанокомпозиты, имеющих важное практическое значение при создании миниатюрных газовых сенсоров и других электрохимических устройств [2].
Объектами исследования данной работы являются кристаллы сульфата калия и смешанные кристаллы K2SO4–CuSO4. Анализ литературных данных показал, что ионный транспорт в сульфате калия экспериментально изучен недостаточно, результаты и их интерпретация противоречивы. Особый интерес представляет температурный диапазон, предшествующий переходу в суперионную стадию. Это так называемая структурно-чувствительная область. Понимание физических процессов в этом температурном диапазоне является базовым для разработки модельных представлений особенностей перехода в суперионную фазу данного соединения. Поскольку сульфат калия по типу химической связи и строению кристаллической решетки подобен огромному числу соединений, открывается возможность для поиска новых суперионных кристаллов.
Объекты и методика эксперимента
Общее число соединений со структурой типа K2SO4 превышает 130, а число ожидаемых – 2000. Элементарная ячейка K2SO4 содержит четыре формульные единицы. Размеры элементарной ячейки следующие: a = 0,5731 нм; b = 1,008 нм; c = 0,7424 нм. Ось «с» является осью псевдогексагональной симметрии. Группа 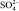 в кристаллах сульфата калия образует жесткий тетраэдр с ионом серы в центре и ионами кислорода в вершинах. Если рассматривать центр ячейки как начало координат, то ионы серы, калия и по два кислорода из тетраэдра SO4 расположены на двух параллельных плоскостях отражения (100)1/4 и (100)–1/4. Расстояние между плоскостями: а/2. В тетраэдре SO4 расстояние S–O порядка 0,15 нм. Ионы К+ находятся в кристалле сульфата калия в двух неэквивалентных положениях К1 и К2, различающихся окружением. Кристаллы сульфата калия имеют заметное преобладание повторного двойникования в виде трех компонент, взаимопроникновение которых приводит к наблюдаемой форме в виде простых гексагональных призм. b-К2SO4 имеет ромбическую (псевдогексагональную) решетку с пространственной группой симметрии
в кристаллах сульфата калия образует жесткий тетраэдр с ионом серы в центре и ионами кислорода в вершинах. Если рассматривать центр ячейки как начало координат, то ионы серы, калия и по два кислорода из тетраэдра SO4 расположены на двух параллельных плоскостях отражения (100)1/4 и (100)–1/4. Расстояние между плоскостями: а/2. В тетраэдре SO4 расстояние S–O порядка 0,15 нм. Ионы К+ находятся в кристалле сульфата калия в двух неэквивалентных положениях К1 и К2, различающихся окружением. Кристаллы сульфата калия имеют заметное преобладание повторного двойникования в виде трех компонент, взаимопроникновение которых приводит к наблюдаемой форме в виде простых гексагональных призм. b-К2SO4 имеет ромбическую (псевдогексагональную) решетку с пространственной группой симметрии 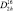 – Pmcn.
– Pmcn.
Схематическое изображение структуры типа b-К2SO4 приведено на рис. 1. Направление Z на рисунке совпадает с направлением оси псевдогексагональной симметрии «с». На рис. 1 показано расположение атомов К1, К2 и Т-групп (SO4) в двух соседних плоскостях. Упорядочение Т-групп легко представить из рис. 2. Одна из вершин каждой Т-группы направлена вдоль ±Z, а остальные три вершины тетраэдра SO4 лежат в одной плоскости (00Z) с Z = 0,20; 0,70; 0,30; 0,80 при выбранном на рисунке начале координат.
Ориентации оснований Т-групп в плоскости (001) одинаковы в каждом из слоев катионных полиэдров и противоположны в соседних слоях. Вершина одного из тетраэдров каждого слоя направлена по +Z, а другого по –Z, так что в ячейке общее число Т-групп, обращенных по Z и –Z, одинаково.
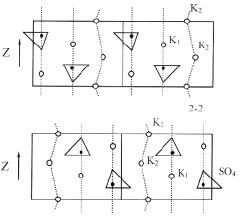
Рис. 1. Схематическое изображение структуры β-K2SO4. Расположение атомов K1, K2 и Т-групп в двух соседних плоскостях
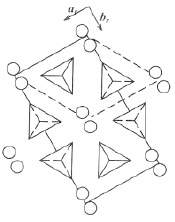
Рис. 2. Структура β-K2SO4
Выращивание кристаллов К2SO4 осуществлялось на созданной нами установке методом изотермического испарения водного раствора при температуре 50 °С.
Для кристаллов К2SO4, при росте из водных растворов характерными формами являются {010}; {110}; {011}; {001}; {100}; {130}; {111}; {112}; и {021}, причем последняя преобладает.
Выращивание смешанных кристаллов K2SO4–CuSO4 осуществлялось также методом изотермического испарения водного раствора при температуре 50 °С. Определение концентрации ионов двухвалентной меди в смешанных кристаллах проводилось оптическим методом по спектрам поглощения.
Для измерения электропроводности кристаллов использовалась трехэлектродная схема с охранным кольцом. Напыление алюминиевых и медных электродов производились на установке ВУП-5 при остаточном давлении 10–4 мм рт.ст. Кольцевой и центральный электроды напылялись на кристалл через специальную маску с двух точечных испарителей либо с одного неточечного испарителя. через маску. За один этап напыления получали сплошной замкнутый кольцевой электрод сложной формы.
Результаты эксперимента и их обсуждение
Мы провели измерения вольт-амперных характеристик монокристалла K2SO4 при 83 и 130 °С при наложении внешнего электрического поля вдоль разных кристаллографических направлений, которые определялись на установке ДРОН-УМ1. Измерения проводились в перпендикулярном кристаллографической грани (021) направлении и вдоль двух взаимно перпендикулярных направлениях в плоскости исходной грани.
Результаты измерений приведены на рис. 3. Из рисунка видно, что в интервале приложенных напряжений вольт-амперные характеристики линейны. Анизотропия проводимости наблюдается при разных температурах. При температуре 130 °С вольт-амперные характеристики сульфата калия, измеренные вдоль разных направлений, практически параллельны в пределах доверительного интервала измерений. Отношение электропроводности вдоль разных кристаллографических направлений из этих данных составляет 3.3:1.7:1, что хорошо согласуется с теоретическими результатами.
Вольт-амперные характеристики кристалла K2SO4, измеренные при 83 °С, также линейны и практически параллельны таковым при 130 °С. Отношение электропроводности вдоль разных направлений при 150 В составляет 3.2:1.6:1. Следовательно, отношение проводимости вдоль разных кристаллографических направлений практически не зависит от температуры. Анализ полученных результатов позволяет утверждать, что электропроводность сульфата калия в температурной области до 350 °С определяется одним доминирующим механизмом, который является структурно-чувствительным. Он связан с прыжковой диффузией ионов. Частотный фактор и энергия активации перескока, которые определяют вероятность этого процесса, слабо зависят от ориентации, приложенного напряжения и температуры. Это следует из параллельности полученных вольт-амперных характеристик.
На рис. 4 приведены зависимости удельной объемной проводимости кристаллов K2SO4 и K2SO4–Cu2+. Из рис. 4 видно, что примесные ионы меди слабо влияют на проводимость монокристалла сульфата калия. Энергия активации проводимости чистого кристалла K2SO4 составляет 0,8 эВ, а K2SO4–Cu2+ – 0,82 эВ.
Для кристалла на рис. 4 концентрация примесных ионов двухвалентной меди составляет 7·103 ppm. Следовательно, в кристалле имеется такое же количество дополнительных катионных вакансий. Простые оценки показывают, что это существенно больше количества равновесных дефектов Шоттки в данном температурном интервале. Однако наблюдаемые изменения в проводимости не соответствуют изменениям в количестве катионных вакансий.
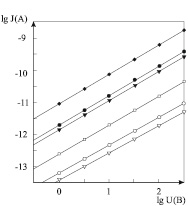
Рис. 3. Вольт-амперная характеристика кристалла K2SO4 вдоль разных направлений
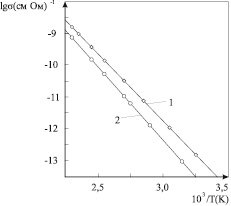
Рис. 4. Аррениусовские зависимости удельной объемной проводимости кристаллов K2SO4 (1) и K2SO4-Cu2 + (2) вдоль направления С
Из классической теории следует, что электропроводность пропорциональна концентрации носителей заряда. Следовательно, при активации сульфата калия ионами меди величина электропроводности должна увеличиться на порядки, что не происходит. При активации сульфата калия ионами двухвалентной меди проводимость, наоборот, уменьшается. Это объясняется, если предположить, что в изучаемом температурном диапазоне проводимость в сульфате калия определяется миграцией междоузельных катионов. Появление дополнительных вакансий приводит к уменьшению их концентрации. Для проверки полученного результата были выращены монокристаллы сульфата калия с гетеровалентными примесными анионами: Br–, I– и 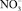 . Сравнение результатов измерения проводимости кристаллов с гетеровалентными примесными катионами или анионами показывает: по абсолютной величине проводимости всех исследованных кристаллов близки во всем температурном диапазоне 20–250 °С; энергия активации проводимости для всех кристаллов практически одинакова и равна 0,8 эВ.
. Сравнение результатов измерения проводимости кристаллов с гетеровалентными примесными катионами или анионами показывает: по абсолютной величине проводимости всех исследованных кристаллов близки во всем температурном диапазоне 20–250 °С; энергия активации проводимости для всех кристаллов практически одинакова и равна 0,8 эВ.
Как показано выше, исследованный температурный диапазон попадает в структурно-чувствительную область. Вклад в проводимость кристаллов в структурно-чувствительной области могут дать либо катионные вакансии, либо междоузельные ионы. В качестве последних могут быть ионы калия и ионы катионов-гомологов малого радиуса, следы которых всегда имеются в изучаемом соединении. Анализ различных механизмов проводимости исследованных кристаллов показал, что наиболее вероятной причиной незначительного вклада катионных вакансий является их малая подвижность в изучаемом температурном диапазоне.
Термодинамический анализ ионной проводимости
Рассмотрим сначала гомогенную изотропную среду, которая содержит 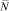 электронов или ионов проводимости и характеризуется термодинамическим потенциалом Гиббса G°. Возникновение тока плотностью j в среде является откликом системы невзаимодействующих электронов или ионов на внешнее поле Е и имеет вид [3]:
электронов или ионов проводимости и характеризуется термодинамическим потенциалом Гиббса G°. Возникновение тока плотностью j в среде является откликом системы невзаимодействующих электронов или ионов на внешнее поле Е и имеет вид [3]:
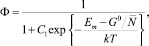 (1)
(1)
где 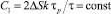 (смысл входящих в это выражение величин такой же, как и в [3]), Em = eE, e – заряд электрона.
(смысл входящих в это выражение величин такой же, как и в [3]), Em = eE, e – заряд электрона.
После линеаризации (1) при Φ = j получаем:
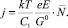 (2)
(2)
Когда 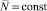 , мы из (2) имеем закон Ома в дифференциальной форме:
, мы из (2) имеем закон Ома в дифференциальной форме:
j = σE, (3)
где 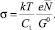 (4)
(4)
В случае идеальных твердых растворов:
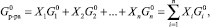 (5)
(5)
где Xi – мольная концентрация i-й компоненты.
В таблице приведены энергии Гиббса использованных нами веществ при выращивании смешанных кристаллов [4].
Как видно из таблицы, энергия Гиббса сульфата калия значительно превосходит энергию Гиббса вторых компонент в смешанном кристалле. Учитывая, что концентрация этих компонент в смешанном кристалле не превосходит 10 %, тогда из (5) следует, что 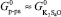 и, в соответствии с формулой (4), изменения в величине проводимости не будет. Это и наблюдается в эксперименте.
и, в соответствии с формулой (4), изменения в величине проводимости не будет. Это и наблюдается в эксперименте.
Энергия Гиббса некоторых веществ [4]
|
Вещество |
–ΔG, кДж/моль |
Вещество |
–ΔG, кДж/моль |
|
KBr |
392, 470 |
CuSO4 |
661,070 |
|
KNO3 |
493, 620 |
K2SO4 |
1377,780 |
Заключение
Хотя термодинамический анализ ионной проводимости и объясняет отсутствие влияния двухвалентной меди и гетеровалентных примесей на проводимость сульфата калия, однако нужны дополнительные исследования, чтобы поставить точку в этом вопросе.
Рецензенты:
Портнов В.С., д.т.н., профессор, начальник УМУ, Карагандинский государственный технический университет, г. Караганда;
Турсунбаева А.К., д.т.н., профессор кафедры ММиН, Карагандинский государственный технический университет, г. Караганда.
Работа поступила в редакцию 30.12.2013.



