Ненуклеозидные ингибиторы обратной транскриптазы занимают важное место среди химиотерапевтических средств, угнетающих репродукцию ВИЧ. Среди соединений данной группы ключевое значение имеют аналоги урацила, содержащие заместители в положениях 1 и 6 гетероциклического фрагмента [2]. Синтез большинства производных данного типа предусматривает получение аналогов урацила, содержащих арильный радикал в шестой позиции гетероцикла с последующим синтезом их силилпроизводных и их алкилированием с применением хлорметиловых эфиров [1, 7] или реагентов, способных генерировать α-хлорэфиры in situ [1, 3].
Цель исследования – синтез новых потенциальных противовирусных агентов – 1,6-бис[(бензилокси)метил]производных урацила и изучение факторов, влияющих на образование конечных продуктов.
Материалы и методы исследования
В работе использовались коммерчески доступные растворители и реактивы («Sigma-Aldrich», «Merck», «Acros Organics»). Безводный дихлорметан был получен путём перегонки над оксидом фосфора (V).
Спектры ЯМР 1H- и 13С-регистрировали на спектрометре Bruker Avance-400 (400 МГц для 1H-, 100 МГц для 13С) в ДМСО-D6 и CDCl3, внутренний стандарт ТМС. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада). Тонкослойную хроматографию выполняли на пластинах Merck TLC Silica gel 60 F254, проявление в парах йода и УФ-свете с помощью УФ-лампы VL-6.LC (Франция). Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
Результаты исследования и их обсуждение
6-[(Бензилокси)метил]производные урацила 9-16 были получены по описанным в литературе методикам в две стадии. Исходные этил-4-бензилокси-3-оксобутаноаты 1-4 конденсацией с тиомочевиной в среде метанола в присутствии в качестве основания метилата натрия [5] переводили в соответствующие 2-тиопроизводные 5-8, которые при десульфурировании 10 %-м водным раствором монохлоруксусной кислоты давали соответствующие урацилы 9-12 [3]. 5-Бромзамещённые 6-[(бензилокси)метил]урацилы 28-30 были получены обработкой соответствующих урацилов раствором брома в диметилформамиде (ДМФА), а введение атомов хлора и йода в пятое положение урацильного фрагмента соединения 23 осуществлялось с использованием N-галогенсукцинимимдов в ДМФА [4,6]. Алкилирование полученных соединений проводилось в условиях силильной модификации реакции Гилберта‒Джонсона и заключалось в обработке силилпроизводных 6-[(бензилокси)метил]урацила, полученных кипячением соответствующих урацилов в избытке 1,1,1,3,3,3-гексаметилдисилазана в присутствии каталитических количеств хлорида аммония, хлорметиловыми эфирами (17-22) при комнатной температуре в среде безводного дихлорметана в течение 10 часов [7] (схема).
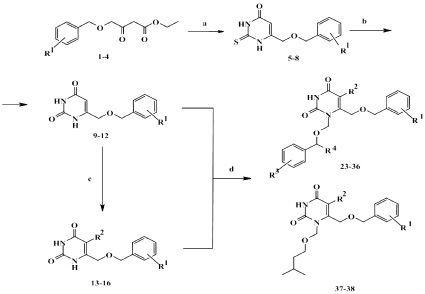
где R1 = H, 4–Cl, 4–CH3, 3,5–Cl2; R2 = H, Cl, Br, I; R3 = H, 4–CN, 3,5–Cl2, 3,5-(CH3)2; R4 = H, CH3
Реагенты и условия: a – CH3ONa, CH3OH, (NH2)2CS; b – монохлоруксусная кислота, вода, ДМФА; c – Br2, ДМФА/NIS/NCS; d – 1) ГМДС, NH4Cl; 2) R3–Bn–OCH(R4)Cl (17-21) или (CH3)2–CH–(CH2)2–OCH2Cl (22), ДХМ
Полученные целевые N1-(бензилокси)- и (алкокси)метилпроизводные подвергали очистке путём препаративной колоночной хроматографии на силикагеле.
Следует отметить, что продуктами реакции во всех случаях явились исключительно N1-замещённые соединения, а образования N3- и N1,N3-дизамещённых продуктов отмечено не было. Обнаружено, что за счёт стерического препятствия со стороны (бензилокси)метильной группы в положении 6 гетероцикла выходы продуктов алкилирования составляли 15–55 % в случае 1,6-бис[(бензилокси)метил]производных (23-36) и 46–51 % в случае их алкоксиметильных аналогов (37-38). Заместители в положениях R1 и R2 не оказывали существенного влияния на выход целевого продукта, за исключением 6-[(3,5-дихлорбензилокси)метил]производного, в случае которого выход продукта алкилирования составил лишь 15 %, что может объясняться препятствием для атаки карбкатиона со стороны атома хлора. Применение разветвлённого 1-(фенилэтил)хлорметилового эфира в качестве алкилирующего агента приводит к существенному снижению выхода (32–35 %), что можно объяснить стерическим отталкиванием между дополнительной метильной группой у sp3-гибридного атома углерода в хлорэфире и радикалом при атоме С6 в силилированном основании.
Структуры синтезированных веществ и их чистота подтверждены ЯМР-спектроскопией и ТСХ-анализом. Физико-химические данные и выходы конечных продуктов приведены в таблице.
Физико-химические данные N1-алкокси- и N1-бензилоксиметилпроизводных 6-[(бензилокси)метил]урацила
|
Соединения |
R1 |
R2 |
R3 |
R4 |
Выход, % |
Тпл, °С |
Rf* |
|
23 |
H |
H |
H |
H |
55 |
88–90 |
0,40 |
|
24 |
4–Cl |
H |
H |
H |
50 |
119–122 |
0,38 |
|
25 |
4–CH3 |
H |
H |
H |
51 |
111–112 |
0,46 |
|
26 |
3,5–Cl2 |
H |
H |
H |
15 |
118–119 |
0,39 |
|
27 |
H |
Cl |
H |
H |
48 |
125–126,5 |
0,66 |
|
28 |
H |
Br |
H |
H |
46 |
136–137,5 |
0,74 |
|
29 |
4–Cl |
Br |
H |
H |
48 |
126–127 |
0,73 |
|
30 |
4–CH3 |
Br |
H |
H |
44 |
149–151 |
0,76 |
|
31 |
H |
I |
H |
H |
49 |
138,5–139,5 |
0,68 |
|
32 |
H |
H |
3,5–Cl2 |
H |
41 |
112–113 |
0,36 |
|
33 |
H |
H |
3,5–(CH3)2 |
H |
42 |
107–109 |
0,48 |
|
34 |
H |
H |
4–CN |
H |
49 |
109–110,5 |
0,37 |
|
35 |
H |
H |
H |
CH3 |
35 |
116–119 |
0,50 |
|
36 |
4–Cl |
H |
H |
CH3 |
32 |
143–145 |
0,48 |
|
37 |
H |
– |
– |
– |
51 |
60–62 |
0,57 |
|
38 |
4–Cl |
– |
– |
– |
46 |
84–86 |
0,47 |
Примечание. * этилацетат-гексан 1:1.
1,6-Бис[(бензилокси)метил]урацил (23). Смесь 0,70 г (3,00 ммоль) 6-[(бензилокси)метил]урацила (9), 0,30 г (5,61 ммоль) хлорида аммония и 25 мл (120,00 ммоль) 1,1,1,3,3,3-гексаметилдисилазана нагревали с обратным холодильником в течение 8 часов, избыток гексаметилдисилазана упарили в вакууме, остаток растворили в 20 мл безводного 1,2-дихлорэтана и добавили раствор 0,47 г (3,00 ммоль) бензилхлорметилового эфира (17) в 20 мл безводного дихлорметана. Полученный раствор перемешивали при комнатной температуре в течение 6 часов, после чего упарили, остаток очищали путём колоночной хроматографии на силикагеле, элюент – смесь гексан-этилацетат (3:2). Получили 0,58 г (выход 55 %) продукта в виде белого мелкокристаллического вещества. Rf = 0,40 (гексан-этилацетат 1:1). Тпл = 88–90 °С. 1Н ЯМР-спектр (ДМСО–D6, 400 МГц), δ, м.д., J (Гц): 4,51 c (2H, CH2–С6); 4,53 c (2H, CH2–C1’); 4,56 c (2H, CH2–C1’’); 5,28 c (2H, CH2–N1); 5,71 c (1H, H-5); 7,25–7,36 м (10H, ароматические H); 11,36 с (1H, NH). 13C ЯМР-спектр (ДМСО-D6, 100 МГц), δ, м.д.: 66,3; 70,7; 71,9; 72,4; 101,3; 127,9; 128,0; 128,0; 128,1; 128,6; 128,7; 137,8; 137,8; 152,1; 153,0; 162,9.
Соединения 24-38 были получены аналогично из соответствующих 6-[(бензилокси)метил]урацилов 9-16 и α-хлорметиловых эфиров 17-22.
Выводы
В ходе проведённой работы осуществлён синтез 14 новых 1,6-бис[(бензилокси)метил]производных урацила и двух их алифатических аналогов. Показано, что на выход продуктов оказывают важное влияние стерические факторы как со стороны радикала при атоме C6 гетероциклического фрагмента, так и со стороны алкилирующего агента. Полученные соединения представляют интерес как потенциальные агенты для терапии ВИЧ-инфекции.
Рецензенты:Симонян А.В., д.фарм.н., профессор кафедры фармацевтической технологии и биотехнологии Волгоградского государственного медицинского университета, г. Волгоград;
Ганичева Л.М., д.фарм.н., доцент кафедры управления и экономики фармации, медицинского и фармацевтического товароведения Волгоградского государственного медицинского университета, г. Волгоград.
Работа поступила в редакцию 05.12.2013.



