Существуют различные модели гипотиреоза у крыс. В литературе рассматриваются как медикаментозные, так и хирургические модели. Так, Кулимбетов М.Т. и соавт. [4] разработали модель гипотиреоза с применением йододефицитной диеты у крыс. При создании экспериментальной модели с дефицитом йода в питании крыс ими были использованы продукты местного происхождения с низким содержанием йода. Как основной продукт питания использовался комбикорм с добавкой премикса, не содержащего йод. Ряд авторов моделируют гипотиреоз путем применения тиреостатиков, например, путем введения через специальный зонд в желудок мерказолила в дозе 10 мг/кг в течение 8 недель [3, 9, 10]. Цвиркун Д.В. вызывала гипотиреоз у крыс мерказолилом («Акрихин», Россия), который давали животным с питьевой водой: первые 2 недели − 0,02 %-й раствор, затем 0,01 % [15]. Щеглакова Г.Ю. и соавт. [16] предлагают моделировать гипотиреоз путем введения через пищевой зонд сечением 4 мм водно-крахмальной суспензии мерказолила 1 раз в сутки на протяжении 30 дней из расчета 25 мг/кг. Некоторые авторы для моделирования дисфункции щитовидной железы животным в течение 2-х месяцев вводили с питьевой водой 0,005 %-й раствор препарата «Мерказолил» (ООО «Фармацевтическая компания «Здоровье», Украина) [17]. Некоторые исследователи вызывают гипотиреоз ежедневным внутрижелудочным введением тиамазола в дозе 2,5 мг на 100 г массы тела в течение 3 недель [2]. При всех нехирургических моделях экспериментальный гипотиреоз характеризовался снижением концентрации свободного тироксина (Т4), повышением содержания общего трийодтиронина (Т3) и тиреотропного гормона (ТТГ). Обращает на себя внимание тот факт, что в литературе описано немного хирургических моделей этого состояния [7, 11]. Однако эта модель является наиболее сходной с клинической ситуацией, так как она воспроизводит механизм послеоперационного гипотиреоза и нивелирует влияние тиреостатиков на организм животного, что позволяет более информативно изучить патофизиологические последствия тиреоидэктомии. Кроме того, в описанных нами моделях гипотиреоза последний моделируют путем удаления части органа или всей щитовидной железы, что может осложняться кровотечением, асфиксией, гипопаратиреозом [7]. Поэтому нами предпринята попытка создания модели хирургического гипотиреоза без удаления органа, за счет коагуляции верхней и нижней щитовидной артерии справа.
Целью работы было создание технически несложной, адекватной модели хирургического гипотиреоза у крысы. На предложенной модели предполагается исследовать комплексное влияние ТЭС-терапии на течение гипотиреоза, в частности, на баланс провоспалительных и противовоспалительных цитокинов, а также показатели опиоидергической стресс-лимитирующей системы [5, 6].
Материалы и методы исследования
Все эксперименты были проведены в лаборатории кафедры общей и клинической патофизиологии ГБОУ ВПО КубГМУ Минздрава России.
В эксперимент включены 10 нелинейных крыс-самцов средней массой – 250 ± 50 г. Содержание животных и постановка экспериментов проведена в соответствии с требованиями приказов № 1179 МЗ СССР от 11.10.1983 года и № 267 МЗ РФ от 19.06.2003 года, а также международными правилами «Guide for the Care and Use of Laboratory Animals». В экспериментах использован общий комбинированный наркоз (0,03 мг – золетила, 0,4 мг – ксиланита и 0,01 мл – 0,1 % раствора атропина на 100 г веса животных) [14]. Препараты для наркоза, использованные в экспериментах, доступны. Они в меньшей степени угнетают функцию дыхания и гемодинамику (по сравнению с другими видами наркоза с включением барбитуратов и хлоралгидрата). Их совокупное применение обеспечивает продолжительный глубокий наркоз с редкими осложнениями в отличие от других видов обезболивания, описанных в литературе [18].
Регистрацию ЭКГ крысам проводили на электрокардиографе ЭК 1Т- 1/3- 07 «АКСИОН» в I стандартном отведении (двухполюсные отведения от конечностей: I – левая и правая передние конечности, II – левая задняя и правая передняя конечности, III – левая задняя и левая передняя конечности) в положении на спине с использованием игольчатых электродов, помещаемых подкожно на конечности [1, 13]. Запись ЭКГ осуществляли сразу же после введения в наркоз, во время разреза кожи, до и после коагуляции артерий и через один час после операции.
Техника операции представлена следующими этапами. После обработки операционного поля производили разрез кожи и разводили края раны на держалках. Тупым способом раздвигали мышцы и обнажали трахею [8, 12, 19], открывая доступ к щитовидной железе. Далее электрокоагулятором производили коагуляцию верхней и нижней щитовидной артерии справа.
После прекращения кровотока появлялись признаки ишемии – железа становилась синюшной. Затем по возможности послойно восстанавливали топографию мышц и мягких тканей.
Из 10 животных, не выходя из наркоза, умерло 3, примерно через 12 часов по окончании операции. Оставшиеся 7 животных легко вышли из наркоза и через 6 часов уже подходили к корму и воде.
После смерти у умерших животных выделяли ГМ и сердце, ополаскивали их 2-кратно в холодном 0,9 % растворе хлорида натрия, далее проводили фиксацию органов в 10 % нейтральном формалине, с последующей проводкой в изопропаноле, заливкой образцов в парафин и приготовлением срезов и стекол. Окрашивание полученных стекол выполняли гематоксилином-эозином.
Результаты исследования и их обсуждение
Умерших животных с моделью гипотиреоидного состояния подвергали аутопсии. Ниже представлена патологоанатомическая (увеличение объектива в 4, 10 и 100 раз) картина изменений головного мозга животных и сердца. При внешнем осмотре головного мозга крысы обращает внимание его выраженная отечность, сглаженность поверхности и полнокровие сосудов, кроме того, артериальные сосуды на поверхности «пустые», что свидетельствует о гипоксическом повреждении (рис. 1, а). При гистологическом исследовании ткани мозга (рис. 1, б, в, г) на рис. 1, б при 4-кратном увеличении обращает на себя внимание неоднородность ткани мозга (А), полнокровные сосуды (Б), что, вероятно свидетельствует об ишемическом стазе. На рис. 1, в при десятикратном увеличении обнаруживаем деградацию ткани мозга (В) и резкое полнокровие сосудов с формированием истинных стазов и образованием «монетных столбиков» (Г). Эти факты свидетельствуют об остром генерализованном гипоксическом поражении головного мозга с нарушением перфузии органа. Данные изменения возможны при шоке, который связан с уменьшением эффективного сердечного выброса. Наконец, на рис. 1, г мы видим формирование эритроцитарных «монетных столбиков» (Г) и инфильтрацию мозговой ткани нейтрофилами (Д), что опять же характерно для ишемического повреждения ткани мозга с характерными ишемическими проявлениями – ткани по периферии сосуда резко бледные (Е).
а 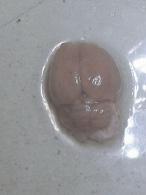 б
б 
 г
г 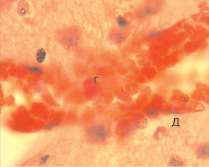
Рис. 1. а – патоморфологическая картина головного мозга умершей крысы; б – гистологическая картина ткани мозга (х4); в – гистологическая картина ткани мозга (х10); г – гистологическая картина ткани мозга (х100)
При внешнем осмотре сердца (рис. 2, а) крысы обращает внимание на себя изменение тканей желудочков: они бледные, дряблые. Кроме того, в полости предсердий обнаруживаются тромбы и их венозное полнокровие. При увеличении в 4 раза (рис. 2, б) мы видим разволокнение миокарда (А), полнокровие сосудов (Б), что свидетельствует об ишемии миокарда. При 10-кратном увеличении (рис. 2, в) также прослеживается разволокнение миокарда (А) и резко полнокровные сосуды со стазом (Б), здесь же обнаруживается инфильтрация ткани миокарда нейтрофилами (В). На рис. 2, г представлено 100-кратное увеличение ткани миокарда. Здесь ярко видно полнокровие сосудов и нарушение микроциркуляции по типу «монетных столбиков» (Е), деградация миофибрилл и их разнонаправленность (Ж). Все представленные выше гистологические данные свидетельствуют о повреждении миокарда в результате шокового состояния.
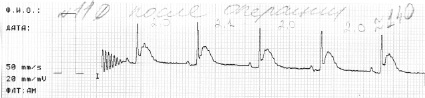
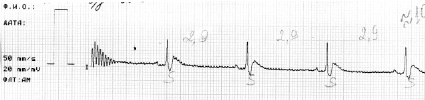
Ниже (рис. 3) представлена электрокардиограмма одного из умерших животных с моделированным гипотиреоидным состоянием. Обращает на себя внимание, что через час после операции имеет место выраженная брадикардия (ЧСС – 111 уд./мин). В норме у крыс ЧСС – 200–300 уд./мин [12]. У всех 3-х животных изменения на ЭКГ были аналогичными. Замедление сердечного ритма может быть связано с острым гипотиреоидным состоянием, генез которого до конца не ясен. Оно и привело к «эндокринному шоку».
а  б
б 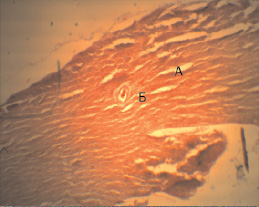
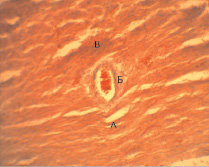 г
г 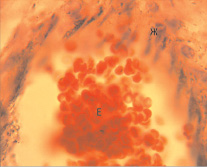
Рис. 2. а – патоморфологическая картина сердца умершей крысы; б – гистологическая картина ткани сердца (х4); в – гистологическая картина ткани сердца (х10); г – гистологическая картина ткани сердца (х100)
Таким образом, смерть животного наступила от полиорганной недостаточности, развившейся на фоне глубокой брадикардии, которая спровоцирована острым гипотиреоидным состоянием.
Выводы
Нами получена модель острого гипотиреоидного состояния у крысы, которая пригодна для использования в качестве модели для оценки эффектов ТЭС-терапии в комплексном лечении этой нозологии. Необходимо отметить, что полученная модель хирургического гипотиреоза имеет высокую летальность, однако может быть использована в качестве адекватной модели для изучения этой патологии. Нами продолжается поиск причин синдрома полиорганной недостаточности, возникающего при создании данной модели.

а
б

в
г
Рис. 3. ЭКГ умершей крысы: а – ЭКГ умершего животного (ЧСС – 176 ударов в минуту). Запись произведена после введения в наркоз; б – ЭКГ умершего животного (ЧСС – 146 ударов в минуту). Запись произведена сразу же после разреза кожи; в – ЭКГ умершего животного (ЧСС – 113 ударов в минуту). Запись произведена после коагуляции щитовидных сосудов справа; г – ЭКГ умершего животного (ЧСС – 111 ударов в минуту). Запись произведена через один час после эксперимента. Стрелками показана депрессия зубца S, что свидетельствует об ишемии миокарда
Рецензенты:
Шантыз А.Ю., д.б.н., профессор кафедры анатомии, ветеринарного акушерства и хирургии, ФГБОУ ВПО «Кубанский государственный аграрный университет», г. Краснодар;
Могильная Г.М., д.м.н., профессор, зав. кафедрой гистологии с эмбриологией, ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Работа поступила в редакцию 30.11.2013.



