Гиппокамповая формация мозга, имеющая большое значение для процессов обучения и памяти, состоит из собственно гиппокампа и зубчатой фасции. Гранулярные нейроны зубчатой фасции получают информацию из неокортекса и передают ее в гиппокамп через свои аксоны, так называемые мшистые волокна. Пучки тонких немиелинизированных аксонов следуют вдоль слоя апикальных дендритов пирамидных нейронов поля СА3 и образуют на них гигантские синаптические комплексы. Нервные элементы этой афферентной системы гиппокампа являются чрезвычайно пластичными и подвергаются структурной и функциональной перестройке в ответ на разные внутренние и внешние воздействия [11]. Способность нейронов зубчатой фасции к пластической реорганизации проявляется также в том, что они могут генерироваться в течение всей жизни и функционально встраиваться в уже существующие нейронные сети [15]. В условиях гетеротопической нейротрасплантации они формируют синаптические взаимодействия с нейронами, с которыми в норме не контактируют [3, 4]. По-видимому, столь высокая функциональная пластичность гранулярных нейронов зубчатой фасции обусловлена их сложным и гетерогенным нейрохимическим составом. Основным нейромедиатором синаптических окончаний гранулярных нейронов является глутамат. Во время постнатального развития и при повышенной активности дополнительно к глутамату в них экспрессируется гамма-аминомасляная кислота [9]. Гранулярные клетки, их аксоны и синаптические терминали имеют самое большое в мозге количество ионов цинка. Кроме того, они содержат нейропептидные ко-трансмиттеры и богаты ростовыми факторами [10]. Ранее мы показали, что при формировании синапсов мшистых волокон с несвойственными им в норме нейрональными мишенями роль нейропептидных котрансмиттеров значительно возрастает [3, 4]. Целью настоящей работы было изучение нейрохимических особенностей синапсов мшистых волокон в норме и после нейротрансплантации с помощью цинк-йод-осмиевой импрегнации.
Материал и методы исследования
Исследование проведено на крысах породы Вистар в соответствии с требованиями ГОСТ Р ИСО 10993-2-2009. Объектами для изучения были гиппокамповая формация интактного мозга и гетеротопические трансплантаты зубчатой фасции. Донорским материалом для трансплантации служили закладки фасции 20-дневных плодов, которые выделяли в растворе Игла под стереомикроскопом. В качестве реципиентов использовали крыс-самцов (n = 5) возрастом 3 мес. Трансплантацию производили в полость в соматосенсорной области неокортекса, где эмбриональная ткань развивалась в течение 5 месяцев. Более детально процедура нейротрансплантации описана ранее [1, 2]. Образцы ткани, взятые из нормального мозга (зона окончания мшистых волокон – str. lucidum) и из нейротрансплантатов, фиксировали 4 % раствором формальдегида на фосфатном буфере, разрезали его на кусочки объемом 1 мм³ и дофиксировали 6,25 % раствором глутарового альдегида. После промывки в трис-HCl буфере образцы импрегнировали в течение 16 час. при 4 °С в цинк-йод-осмиевой смеси, которую готовили следующим образом. Раствор А – 6 г цинка в порошке и 2 г перекристаллизованного йода растворяли в 40 мл дистиллированной воды. Раствор Б – 4 мл фильтрованного раствора А доводили 4 мл трис-HCl до рН 7,4. Перед употреблением к 8 мл полученной смеси добавляли 2 мл 2 % раствора четырехокиси осмия. Затем материал обезвоживали в спиртах восходящей крепости и абсолютном ацетоне и заливали в эпон 812. Ультратонкие срезы контрастировали цитратом свинца и просматривали в электронном микроскопе. Гигантские синапсы мшистых волокон идентифицировали благодаря большим размерам синаптической терминали (до 4–6 мкм) и другим структурным признакам, известным из литературы и собственных наблюдений [1, 14]. Сравнительный количественный анализ общего числа синаптических везикул и ЦИО-положительных органелл в гигантских синапсах гиппокамповой формации in situ и нейротрансплантатов проводили с помощью компьютерной программы UTHSCSA Image Tool. Для этого использовали отцифрованные электронно-микроскопические изображения гигантских синаптических бутонов и производили подсчет на площади 1 мкм² (по 25 квадратов в 4 разных вариантах эксперимента); достоверность различий определяли по критерию Стьюдента.
Результаты исследования и их обсуждение
При исследовании полутонких срезов под световым микроскопом было обнаружено, что цинк-йод-осмиевый реагент проник в кусочки ткани не на всю глубину. Поэтому для электронной микроскопии использовали только поверхностные участки образцов. Сохранность ткани была хорошей и гигантские синаптические окончания мшистых волокон легко распознавались среди других нервных элементов как в контрольном, так и в экспериментальном материале. Огромные аксонные расширения диаметром около 5–6 мкм, густо заполненные синаптическими пузырьками, широко распластывались по апикальным дендритам пирамидных нейронов гиппокампа, образуя с ними преимущественно симметричные адгезивные соединения. Вместе с тем мшистые волокна формировали синаптические контакты с асимметричными активными зонами на инвагинированных в терминали дендритных шипиках. Хотя в трансплантированной ткани зубчатой фасции наблюдались некоторые нетипичные для нормального гиппокампа функциональные взаимодействия, их изучение не входило в задачу настоящей работы. Основные особенности ультраструктуры гетеротопических нейротрансплантатов были нами описаны ранее [1]. Электронно-микроскопическое изучение обоих типов образцов после проведения ЦИО-импрегнации показало, что продукт реакции выявлялся не только в гигантских аксональных бутонах, но и в более мелких синаптических профилях. К сожалению, достоверно определить происхождение синаптических бутонов малого размера не представлялось возможным, и они для настоящего анализа не использовались, хотя и могли быть перерезанными фрагментами крупных терминалей мшистых волокон.
Характер распределения продукта импрегнации в гигантских синаптических окончаниях нормальной гиппокамповой формации и в нейротрансплантатах зубчатой фасции был аналогичен. При этом была выявлена определенная специфичность проведенной реакции, выражающаяся в том, что реакционный продукт четко ассоциировался с малыми (около 40 нм в диаметре) светлыми синаптическими пузырьками, в то время как митохондрии и постсинаптические плотности были всегда негативны (рисунок). Большие везикулы диаметром 80–120 нм с осмиофильной сердцевиной, которые в гигантских синапсах мшистых волокон являются вместилищем нейропептидных ко-трансмиттеров, также никогда не реагировали с ЦИО-реагентом. Гранулы ЦИО-преципитата по размеру варьировались от 20 до 60 нм в диаметре и распределялись по аксоплазме не равномерно, а формировали не очень выраженные скопления. Редкие везикулы с положительной реакцией наблюдались также в непосредственном контакте с плазматической мембраной. В некоторых синаптических окончаниях, как правило, имеющих более осмиофильный матрикс, окрашенные везикулы концентрировались в области активных зон. В большинстве синаптических везикул продукт реакции плотно заполнял внутренний объем, а особенно крупные, грубые конгломераты неправильной формы даже выходили за границу пузырьков. В то же время некоторые пузырьки были заполнены продуктом реакции только частично, а иногда ЦИО-окрашенные зерна точечного размера лишь контурировали везикулярные мембраны. Часть окрашенных пузырьков имела овальную форму, напоминая эллипсоидные синаптические везикулы, которые типичны для тормозных синапсов, хранящих гамма-аминомасляную кислоту. Возможно, окрашенные эллипсоидные везикулы в нашем материале также имеют отношение к хранению тормозного нейромедиатора. В пользу такого предположения говорят данные об обнаружении в системе мшистых волокон помимо основного нейромедиатора глутамата гамма-аминомасляной кислоты, количество которой увеличивается при развитии и функциональной нагрузке [9]. Визуальная оценка наших препаратов указывает на возрастание числа эллипсоидных везикул в гигантских синапсах трансплантированной зубчатой фасции. Взаимодействие ЦИО-реагента с везикулами разной нейромедиаторной природы свидетельствует о том, что он имеет химическое сродство не к самим трансмиттерам, а к неким субстратам, связанным с их метаболизмом или функционированием. Кроме синаптических пузырьков реакционный продукт выявлялся в тубулярных цистернах эндоплазматического ретикулума и лизосомоподобных телах, которые присутствуют в пресинаптических бутонах мшистых волокон и участвуют в рециклировании везикул.
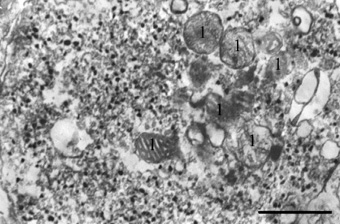
Гигантский синаптический бутон мшистого волокна из гиппокамповой формации in situ. Темные гранулы – ЦИО-положительные синаптические везикулы; 1 – ЦИО-негативные митохондрии. Масштаб – 0,5 мкм
Сравнительная количественная оценка везикулярного состава в расчете на 1 мкм² поперечных сечений гигантских окончаний в нормальном гиппокампе и в трансплантатах показала уменьшение числа как ЦИО-положительных, так и ЦИО-отрицательных органелл в трансплантированной ткани. Наиболее заметная разница средних величин была обнаружена при подсчете числа ЦИО-положительных гранул (101,1 ± 5,5 в норме и 83,0 ± 3,0 в нейротрансплантатах; p < 0,01). Менее значимые различия двух экспериментальных групп были выявлены при сравнении общего пула синаптических пузырьков (226,3 ± 9,0 в норме и 200,1 ± 6,1 в нейротрансплантатах; p ≤ 0,025). При этом доля ЦИО-положительных пузырьков в общей популяции синаптических везикул также была ниже в категории синапсов из трансплантатов зубчатой фасции. Если в синаптических окончаниях нормального гиппокампа она составляла 0,450 ± 0,012 (или 45 %), то в синапсах нейротрансплантатов – только 0,414 ± 0,013 (или 41,4 %); различия достоверны при p ≤ 0,05. Известно, что число везикул в терминальных бутонах наряду с другими параметрами синаптических окончаний коррелирует с функциональной активностью синапсов [13]. Проведенный нами анализ общего количества везикул свидетельствует о том, что гигантские синапсы, развивающиеся в гетеротопических трансплантатах зубчатой фасции, функционируют менее активно, чем таковые в мозге in situ. Кроме того, из полученных данных следует, что метаболиты синаптических везикул, вступающие в реакцию с ЦИО-смесью, также ответственны за интенсивность нейропередачи в этом типе синапсов.
Химическая основа окрашивания ЦИО-реагентом пока окончательно не ясна. Сначала его предлагали применять для обнаружения ацетилхолина в синаптических пузырьках нервно-мышечных синапсов [5]. Затем другие авторы обнаружили, что при определенных условиях в симпатических ганглионарных нервах он выявляет моноаминергические нейромедиаторы [7]. Рентгено-структурный анализ ЦИО-преципитата показал, что осмиевокислый цинк ассоциируется с субклеточными местами, обладающими высокой аффинностью к бивалентным ионам кальция. При этом ЦИО-смесь взаимодействует с этими локусами через сульфгидрильные группы, замещая ионы кальция в белковых макромолекулах [8]. В условиях наших экспериментов основными ЦИО-положительными субклеточными органеллами были синаптические везикулы малого размера. Из литературы известно, что в них присутствует несколько Са(2+)-связывающих белков, таких как синаптофизин, синаптотагмин, синаптобревин. Синаптотагмин 1, например, вовлекается в быстрый процесс везикулярного захвата и секвестирования ионов кальция, используя Са(2+)/Н(+) антипорт [6]. Этот белок также участвует в эндо-экзоцитозе синаптических пузырьков и в синхронизации синаптической передачи [12]. Однако следует отметить, что в нашем материале ЦИО-реакция затрагивает не все интраклеточные хранилища ионов кальция. Во-первых, продукт реакции не выявляется в главном депо кальция, синаптических митохондриях, осуществляющих основной гомеостатический контроль этих ионов в пресинаптических бутонах. Во-вторых, лишены преципитата постсинаптические отделы синаптических комплексов, содержащие кальций-связывающие белки потенциал-зависимых ионотропных каналов. Известно, что в гигантских синапсах гиппокамповой формации важные модулирующие влияния на синаптическую передачу оказывают ионы цинка, которые также локализуются в малых светлых глутаматергических везикулах [10]. Возможно, в условиях нашего эксперимента с реагентами ЦИО-смеси через сульфгидрильные группы могут взаимодействовать также бивалентные ионы цинка.
Заключение
Таким образом, данные ультраструктурного и цитохимического анализа показали, что окончания мшистых волокон гиппокамповой формации как в норме, так и после ее гетеротопической трансплантации в неокортекс, содержат гетерогенную популяцию синаптических пузырьков. При этом более 40 % малых светлых синаптических везикул реагировали с ЦИО-реагентом, остальные везикулы малого размера и крупные пузырьки с осмиофильной сердцевиной не содержали ЦИО-преципитата. Митохондрии и постсинаптические плотности также не взаимодействовали с реакционной смесью. Характер распределения ЦИО-позитивных везикул внутри синаптических бутонов был сходным в обеих экспериментальных вариантах. Вместе с тем количественный анализ везикулярного состава обнаружил между ними значительную разницу. В синаптических бутонах трансплантатов по сравнению с нормой было уменьшено не только общее количество пузырьков, но и число ЦИО-положительных органелл. Это свидетельствует о сниженной функциональной активности синапсов в трансплантатах. При сопоставлении полученных и литературных данных сделано заключение, что реагенты ЦИО-смеси взаимодействуют с локусами синаптических везикул, обладающими химическим сродством к бивалентным ионам, таким как кальций и цинк. В связи с этим можно заключить, что ЦИО-импрегнация субсинаптических органелл может быть одним из маркеров интенсивности функциональных процессов в гигантских синапсах мшистых волокон.
Работа выполнена при финансовой поддержке РФФИ (проект № 12-04-00812).
Рецензенты:
Куликов А.В., д.б.н., зав. сектором, ФГБУН «Институт теоретической и экспериментальной биофизики РАН», г. Пущино;
Павлик Л.Л., д.б.н., ведущий научный сотрудник, ФГБУН «Институт теоретической и экспериментальной биофизики РАН», г. Пущино.
Работа поступила в редакцию 30.11.2013.



