В постнатальном периоде тимус, являясь первичным органом иммунной системы, обеспечивает оптимальные условия для развития Т-лимфоцитов и формирует рециркулирующий пул этих клеток. В реализации этой функции участвует сложное микроокружение органа, основной клеточной популяцией которого являются эпителиальные клетки [1, 5]. Эпителиоциты образуют трехмерный каркас, секретируют ряд биологически активных веществ, участвуют в формировании гемато-тимического барьера, синтезируют и презентируют тканеспецифические антигены. Тимусные эпителиальные клетки (ТЭК) формируют прямой контакт с тимоцитами, что влияет на их состояние. Взаимоотношения этих клеток являются реципрокными [2, 5]. Уникальной особенностью ТЭК среди других популяций клеток тимуса является наличие в цитоплазме цитокератин-промежуточных филаментов, появляющихся на этапе дифференцировки. Качество сборки промежуточных филаментов влияет на механическую стабильность и целостность эпителия [7, 8]. Тип эпителиальных клеток определяет набор цитокератинов (СК), который зависит от условий роста и стадий гистогенеза [10, 11]. Развитие ТЭК происходит из энтодермы 3–4-глоточного кармана. Дальнейшее их становление идет под контролем каскада дифферецировочных факторов (Hoxa 3, Pax 1, Pax 9, Eya 1, Six 1, Foxn 1 и Gcm 2), экспрессируемых в глоточной энтодерме. В результате ТЭК одновременно экспрессируют цитокератины СК 5 и 8. В этот период на развитие ТЭК влияют мезенхимальные производные нервного гребня через продукты генов Fgf (Fibroblast growth factors), что определяет дифференцировку ТЭК в кортикальные (СК8+) и медуллярные (СК5+) эпителиальные клетки [2, 5].
На этапе эмбриогенеза ведущим механизмом направленного действия различных дифференцировочных факторов является формирование определенных путей миграции клеток в те участки зародыша, где впоследствии из них будут образовываться зрелые производные [4]. В краниальном отделе клетки нервного гребня помимо тимуса активно принимают участие и в развитии сердца, в частности, в становлении соединительнотканных структур сердца, его перегородок и сосудов [6, 9]. Дефект миграции клеток нервного гребня может явиться причиной внутриутробных аномалий развития. Важным является вопрос взаимосвязи морфогенетических особенностей эпителиальных клеток тимуса, по экспрессии в них цитокератинов, и врожденных пороков сердца (ВПС) разной степени сложности.
Целью исследования явилось изучение особенностей становления дифференцировки различных субпопуляций эпителиальных клеток коркового вещества дольки тимуса у детей 1 года жизни при эмбриональных нарушениях развития сердца.
Материалы и методы исследования
Исследование проведено на тимусах, полученных от детей в возрасте до 1 года жизни во время операций по коррекции врожденных пороков. Исследовано 47 биоптатов тимуса. Выделено 2 группы: 1-я – тимусы (n = 25) от детей с легкими пороками сердца (дефект межжелудочковой перегородки; дефект межпредсердной перегородки); 2-я – тимусы (n = 22) от детей со сложными пороками сердца (тетрада Фалло; аномалия Эбштейна; транспозиция магистральных сосудов). Образцы материала фиксировали в 10 % нейтральном формалине на фосфатном буфере (рН 7,2). Гистологические препараты приготовлены по стандартным гистологическим методикам [3]. Иммуногистохимическое исследование проводили на серийных срезах с моноклональными антителами к эпителию: панцитокератин AbsAE1/AE3 (PanCK), цитокератин 5/14 (СК 5+) и цитокератин 8/18 (СК 8+) (производство Daco, США) .
Для получения полутонких срезов кусочки тимуса размером 1–2 мм3 фиксировали в 10 % растворе глютарового альдегида и 1 % растворе OsO4, дегидратировали в этиловом спирте возрастающей концентрации и заключали в аралдитовые смолы. Готовили полутонкие срезы толщиной 1 мкм, окрашивали толуидиновым синим.
Съемку препаратов проводили на морфометрической установке «Olympus» с последующим анализом полученных изображений в программе IMAG PRO+ (free version). Полученные данные подвергали статистической обработке в программе Exel, 2007.
Результаты исследования и их обсуждение
Для верификации в тимусе стромального компонента использовали PanCK, включающий в себя широкий спектр цитокератинов, специфически реагирующих с нейтральными и кислыми кератинами эпителиальных клеток. В результате положительная экспрессия PanCK позволила идентифицировать весь эпителиальный компонент в тимусе. В корковом и мозговом веществе долек PanCK в эпителиальных клетках выявлялся с разной интенсивностью. Ярко накапливался в клетках, прилежащих к базальной мембране дольки тимуса. Клетки имели крупное светлое ядро, занимающее большую часть цитоплазмы. Отростки этих клеток формировали контакты друг с другом на всем протяжении базальной мембраны, формируя ровный непрерывный пласт продолжающийся в междольковые прослойки. Экспрессия PanCK в субкапсулярной и в основной части коры дольки отличалась и зависела от степени выраженности сердечного порока. В субкапсулярной зоне при слабо выраженных сердечных пороках PanCK накапливался равномерно. В большинстве долек эпителиальные клетки, соединяясь отростками, формировали подобие сети (кластеры), контактируя с лимфоцитами на этапе их развития (рис. 1).
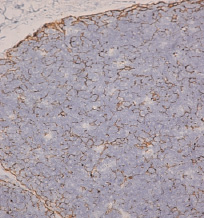
Рис. 1. Экспрессия PanCK в группе со слабыми пороками. Ув. ×400
В пределах коркового вещества доля кластеров составила 44,66 ± 2,29 %. Кластеры состояли из 325,34 ± 35,39 объектов, представленных тимусными эпителиальными клетками, экспрессирующими PanCK. В кортикальной зоне ТЭК не везде формировали кластеры. В части долек сеть местами была нарушена, клетки между собой теряли контакт, что приводило к формированию изолированных скоплений ТЭК (52,33 ± 4,08 %). В полутонких срезах эпителиальные клетки имели умеренные признаки дистрофических изменений, приводящие к потерям межклеточной связи и, как следствие, формированию зон клеточной дезорганизации. В глубокой коре, вблизи кортикомедулярной границы, экспрессия PanCK вновь интенсивно регистрировалась в отростчатых клетках, формирующих несколько слоев эпителиального ретикулума.
При сложных сердечных пороках положительная экспрессия PanCK верифицировалась преимущественно на уровне базальной мембраны и субкапсулярной части коры дольки тимуса. В основной части коры дольки экспрессия PanCK была резко снижена, выявлялась эпизодически, фрагментарно или вообще отсутствовала (рис. 2).
Количество кластеров достоверно снижалось по отношению к группе со слабыми пороками, составило 22,00 ± 2,25 % (p = 0,001). Кластеры были представлены из меньшего количества объектов – 195,81 ± 18,35 (p = 0,005), но доля одиночно расположенных эпителиальных клеток была больше (64,33 ± 3,79 %, p = 0,02), чем в группе со слабым развитием пороков. На полутонких срезах выявлялись выраженные признаки дистрофических изменений клеток стромы, что приводило к нарушениям их связи между собой и с лимфоцитами и гнездному опустошению коркового вещества долек (рис. 3).
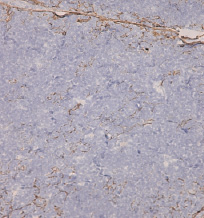
Рис. 2. Экспрессия PanCK в группе с сильными пороками. Ув. ×400
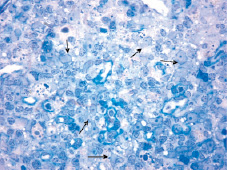
Рис. 3. Дистрофические изменения в ТЭК. Полутонкий срез. Окраска толуидиновым синим. Ув. ×900
В зависимости от локализации и выполняемой функции ТЭК отличаются по набору цитокератиновых полипептидов. Положительная экспрессия СК5+ и СК8+ в ТЭК позволила дифференцировать эпителиальные клетки стромы в пределах коры дольки. По иммуногистохимическим характеристикам СК5+ относят к нейтральным цитокератинам и выявляются на уровне клеток базальных слоев многослойных эпителий. Функционально популяцию этих клеток относят к малодифференцированным, являющимся камбием. Клетки, позитивные к СК 5+, имеют невысокий уровень экспрессии МНС II, что указывает на слабое вовлечение данной субпопуляции в процессы презентации антигенов [8].
Независимо от сложности порока экспрессию СК 5+ наблюдали в клетках, прилежащих к базальной мембране, и клетках субкапсулярной зоны. Формирование кластеров из ТЭК происходило при легких сердечных пороках, при сложных экспрессиях СК 5+ в основном выявлялась в лежащих поодиночке клетках, в некоторых дольках наблюдали только позитивно окрашенные фрагменты ТЭК. В целом интенсивность иммуногистохимического окрашивания ТЭК в базальной, субкапсулярной и кортико-медуллярной зонах зависела от сложности сердечного порока и определялась более интенсивно при слабых сердечных пороках.
СК 8+ относятся к кислым кератинам и выявляются преимущественно в плоских эпителиях. Клетки этой субпопуляции имеют высокий уровень экспрессии молекул МНСII, что указывает на их активное участие в селекции лимфоцитов на этапе их становления через прямой межклеточный контакт [7, 8]. Позитивная реакция ТЭК на СК 8+ существенно отличалась между группами. В группе со слабыми пороками экспрессию СК 8+ наблюдали в пределах основной части коры в ТЭК лежащих поодиночке и формирующих кластеры. Часть клеток теряли связь между собой, сеть разрывалась, отростки клеток выпрямлялись. Интенсивность окрашивания эпителиальных клеток (СК 8+) увеличивалась от субкапсулярной к кортикомедуллярной зоне, что отражает зрелость кортикальных ТЭК. При сложных пороках интенсивность накопления СК 8+ была резко снижена. В пределах коры экспрессия СК8+ выявлялась единично в виде фрагментов. В части долек эпителиальные клетки вообще не проявляли реакции на окрашивание. На полутонких срезах эпителиальные клетки коры имели особенности строения: округлая форма, короткие толстые отростки, крупное ядро занимает большой объем цитоплазмы. Клетки округлялись, втягивали отростки и группировались в кучки. В целом межклеточные связи и контакт с лимфоцитами были нарушены. Клетки на стадии гибели. Повсеместно выявлялись активные макрофаги (рис. 3). На наш взгляд, изменение формы ТЭК, нарушение межклеточных связей могло быть следствием отсутствия или нарушения в клетках сборки промежуточных филаментов, состоящих из цитокератинов.
У детей с нарушением развития сердца от рождения до 1 года была прослежена закономерность экспрессии цитокератинов. Независимо от сложности сердечного порока в течение года жизни (1, 5–6 и 9–10 мес.) наблюдали тенденцию к снижению экспрессии цитокератинов в ТЭК. При слабом сердечном пороке постепенно снижался процент кластеров. ТЭК лежали свободно или поодиночке. К 9–10 мес. в 30 % дольках одного органа формировались участки ТЭК, не экспрессирующих цитокератины. В этот возрастной период состояние тимуса соответствовало состоянию тимуса детей со сложными пороками одного месяца жизни. В дальнейшем, к 9–10 мес., у детей со сложными сердечными пороками экспрессия цитокератинов (PanCK, СК 5+) верифицировалась только на уровне базальной мембраны и единично, фрагментарно в субкапсулярной зоне коры. Экспрессия СК 8+ практически не проявлялась.
Таким образом, иммуногистохимические особенности состояния эпителиальных клеток тимуса коррелировали со степенью сложности врожденного порока сердца. На наш взгляд, наблюдаемая взаимосвязь явилась следствием эмбриональной особенности становления структур тимуса и сердца, в закладке которых участвуют клетки нервного гребня. Возможно, на этапе эмбрионального развития клетки нервного гребня не реализовали свой регуляторный потенциал, что привело к недоразвитию структур сердца и ТЭК. В тимусе при различных нарушениях развития сердца в течение первого года жизни ТЭК теряли контакты межу собой, нарушая архитектонику эпителиальной сети, особенно при сложных сердечных пороках. На фоне этого в ТЭК наблюдали исчезновение цитокератина 8/18. Полученные иммуногистохимические и морфологические особенности состояния клеток стромы отражают начальные признаки эпителио-мезенхимальной трансформации, проявляющиеся репрессией молекул межклеточной адгезии и потерей эпителиальных маркеров (цитокератинов). В результате ТЭК при врожденных пороках сердца не является полноценной дифференцированной популяцией клеток. Учитывая то, что в патогенезе ВПС лежит механизм нарушения системной гемодинамики, ведущий к развитию тканевой гипоксии, при сложных эмбриональных нарушениях развития сердца этот факт приводил к более выраженным морфологическим нарушениям в состоянии тимусного эпителия. В силу своей несостоятельности ТЭК в течение 1 года жизни существенно изменяли свои морфологические свойства что, несомненно, приведет к нарушению их функции по обеспечению организма Т-клеточным ресурсом и становления адаптивного иммунитета у данной категории детей.
Работа выполнена при финансовой поддержке РФФИ (грант 11-04-96023 p_урал_а).
Рецензенты:
Самоделкин Е.И., д.м.н., профессор, кафедра патологической физиологии, ГБОУ ВПО «Пермская государственная медицинская академия им. ак. Е.А. Вагнера» Минздрава России, г. Пермь;
Баландина И.А., д.м.н., профессор, зав. кафедрой нормальной топографической и клинической анатомии, оперативной хирургии, ГБОУ ВПО «Пермская государственная медицинская академия им. ак. Е.А. Вагнера» Минздрава России, г. Пермь.
Работа поступила в редакцию 30.11.2013.



