Известно, что длительная непрерывная гипоксия является одной из главных причин необратимого повреждения клеток мозга [12]. В отличие от длительной гипоксии повторяющиеся кратковременные гипоксические эпизоды, не вызывая необратимого повреждения пирамидных нейронов поля СА1 гиппокампа мозга крысы, способны индуцировать в этих нейронах такие долговременные формы функциональной нейропластичности, как быстрое гипоксическое прекондиционирование и устойчивая постгипоксическая гипервозбудимость нейронов [3, 7].
Наши предварительные эксперименты показали, что Са2+- и АТФ-зависимые мембранные калиевые каналы, являющиеся одними из основных мишеней действия гипоксии, играют важную роль в механизмах индуцируемых кратковременными эпизодами гипоксии перестройках в активности пирамидных нейронов поля СА1 гиппокампа. В частности, Са2+-активирумые калиевые каналы большой проводимости играют важную роль как в механизмах быстрого гипоксического прекондиционирования, так и развитии постгипоксической гипервозбудимости [7]. С другой стороны, АТФ-зависимые калиевые каналы, относящиеся к подтипу митохондриальных КАТФ каналов, достоверно не влияют на развитие постгипоксической гипервозбудимости, но также играют важную роль в механизмах быстрого гипоксического прекондиционирования в пирамидных нейронах поля СА1 гиппокампа [9].
Относительно недавно было обнаружено, что плазматическая мембрана различных нейронов мозга, в том числе и пирамидных нейронов поля СА1 гиппокампа, содержит особый тип калиевых каналов, субъединицы которых формируют четыре трансмембранные группировки и две трансмембранные поры (фоновые 2Р калиевые каналы) [6]. Эти каналы селективны для ионов калия, а их функция связана с поддержанием мембранного потенциала клетки в покое, а также регуляцией гомеостаза К+ и фоновой возбудимости нейронов. Результаты исследований показывают, что через фоновые 2Р калиевые каналы осуществляют свои модулирующие эффекты некоторые гормоны и нейромедиаторы, анестетики, полиненасыщенные жирные кислоты, а также такие физико-химические факторы, как гипоксия, изменения вне- и внутриклеточного рН, температура и механическое растяжение клеточной мембраны [6]. Эти калиевые каналы являются потенциал-независимыми, неинактивирующимися и постоянно-активными. Их блокада вызывает деполяризацию, а активация – гиперполяризацию мембраны нейронов. На основе анализа структуры и функциональных свойств семейство 2Р калиевых каналов млекопитающих подразделяется на 6 подсемейств, включающих 15 членов. В частности, в гиппокампе экспрессируются такие члены семейства 2Р калиевых каналов, как TASK, TREK, TRAAK и TWIK. Отмечается, что в поле СА1 гиппокампа крысы TASK тип каналов экспрессируется только в пирамидных клетках, но не интернейронах [14]. Однако в экспериментах на мышах было обнаружено, что данный тип каналов выявляется также в 30–50 % интернейронов stratum oriens поля СА1 гиппокампа [15].
В связи с тем, что TASK-1/TASK-3 типы фоновых 2Р калиевых каналов чувствительны к гипоксии и существенным образом влияют на возбудимость нейронов, целью настоящей работы было исследование влияния селективного блокатора этих каналов А-1899 [13] на индуцируемые кратковременными эпизодами гипоксии изменения в активности нейронов гиппокампа непосредственно во время эпизода гипоксии, прекондиционирующее действие первых двух эпизодов гипоксии на третий и постгипоксическую гипервозбудимость исследуемых нейронов.
Материалы и методы исследования
Работа осуществлялась с соблюдением принципов гуманного обращения с животными (директива Европейского сообщества 86/609/EC). В экспериментах использовали двухмесячных самцов крыс Вистар (n = 18). Срезы гиппокампа толщиной 250–300 мкм помещались в камеру погруженного типа и суперфузировались раствором Кребса–Рингера следующего состава (мМ): NaCl – 124, KCl – 3, MgSO4 – 2, CaCl2 – 2, NaHCO3 – 26, KH2PO4 – 1.24, глюкоза – 10, O2/CO2 – 95/5 % (pH = 7,4), при температуре раствора 32 °С и скорости его протока 2,4 мл/мин. Регистрацию активности начинали через 2,5 часа от начала суперфузии. Популяционные спайки (ПС) регистрировались от пирамидных нейронов поля СА1 гиппокампа в ответ на электрическую тестирующую стимуляцию коллатералей Шаффера до, во время и после предъявления трех 3-минутных эпизодов гипоксии, разделенных 10-минутными интервалами. На рисунке, а показаны расположение гиппокампа в мозге крысы, схема среза гиппокампа с локализацией регистрирующего и стимулирующего электродов, форма регистрируемых ПС ответов при нормальных условиях (до предъявления эпизодов гипоксии) и трансформация формы ПС ответов через 60 мин после предъявления эпизодов гипоксии. Эффективность гипоксического эпизода снижать амплитуду ПС оценивалась по следующей формуле:
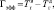
где Гэфф – эффективность эпизода гипоксии снижать амплитуду ПС (в секундах); 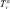 – время, через которое амплитуда ПС депрессируется до 50 % от ее прегипоксических значений от начала эпизода гипоксии;
– время, через которое амплитуда ПС депрессируется до 50 % от ее прегипоксических значений от начала эпизода гипоксии;  – время, через которое амплитуда ПС восстанавливается до 50 % от ее прегипоксических значений после окончания действия гипоксии. Оценка развития постгипоксической гипервозбудимости нейронов в срезах гиппокампа, проявляющейся в форме эпилептиформных ПС-разрядов, производилась по разработанной в нашей лаборатории оригинальной методике [2, 3]. Измерялось число ПС в разряде (ЧПС) на стимул, интенсивность которого приводила к появлению второго ПС в ответе. Быстрое гипоксическое прекондиционирование оценивалось по формуле
– время, через которое амплитуда ПС восстанавливается до 50 % от ее прегипоксических значений после окончания действия гипоксии. Оценка развития постгипоксической гипервозбудимости нейронов в срезах гиппокампа, проявляющейся в форме эпилептиформных ПС-разрядов, производилась по разработанной в нашей лаборатории оригинальной методике [2, 3]. Измерялось число ПС в разряде (ЧПС) на стимул, интенсивность которого приводила к появлению второго ПС в ответе. Быстрое гипоксическое прекондиционирование оценивалось по формуле
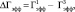
где 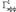 и
и 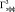 представляют собой значения Гэфф соответственно для первого и третьего эпизодов гипоксии. Электрическая активность нейронов измерялась на серии из 10 одиночных стимулов градуально увеличивающейся интенсивности. Частота импульсов в серии была 0,1 Гц, частота серий – 1 серия/10 мин. Гипоксические эпизоды предъявлялись без добавления в среду А-1899 или через 10 мин после его добавления в концентрации 0,5 мкМ, при которой происходила блокада как TASK-1, так и TASK-3 каналов [13]. А-1899 (фирма Santa Cruz, USA) растворялся в растворе DMSO, концентрация которого в суперфузирующем растворе (0,05 %) не влияла на параметры активности нейронов. Время приложения к срезам гиппокампа А-1899 составляло 40 мин. В отдельной серии экспериментов А-1899 добавлялся к срезам гиппокампа в отсутствии эпизодов гипоксии.
представляют собой значения Гэфф соответственно для первого и третьего эпизодов гипоксии. Электрическая активность нейронов измерялась на серии из 10 одиночных стимулов градуально увеличивающейся интенсивности. Частота импульсов в серии была 0,1 Гц, частота серий – 1 серия/10 мин. Гипоксические эпизоды предъявлялись без добавления в среду А-1899 или через 10 мин после его добавления в концентрации 0,5 мкМ, при которой происходила блокада как TASK-1, так и TASK-3 каналов [13]. А-1899 (фирма Santa Cruz, USA) растворялся в растворе DMSO, концентрация которого в суперфузирующем растворе (0,05 %) не влияла на параметры активности нейронов. Время приложения к срезам гиппокампа А-1899 составляло 40 мин. В отдельной серии экспериментов А-1899 добавлялся к срезам гиппокампа в отсутствии эпизодов гипоксии.
Ввод вызванных электрических ответов в компьютер, а также их обработка в режиме off-line осуществлялись с помощью соответствующего программного обеспечения. Данные представлялись в виде средняя ± ошибка средней. Оценку достоверности влияния исследуемых веществ на индуцируемые гипоксией изменения в регистрируемых параметрах осуществляли по критерию Стьюдента: непарный t-тест для одних и тех же моментов времени регистрации активности в «гипоксических» и «гипоксических + А1899» срезах гиппокампа и парный t-тест при сравнении пре- и постгипоксических значений амплитуды ПС. При значениях P ≤ 0,05 различия считались достоверными.
Результаты исследований и их обсуждение
В концентрации 0,5 мкМ А-1899 не влиял на амплитуду ПС, регистрируемых от исследуемых нейронов. Однако этот селективный блокатор TASK-1/TASK-3 каналов достоверно снижал эффективность угнетающего действия гипоксии на амплитуду ПС во время эпизода (рисунок, б). Значение Гэфф для первого эпизода гипоксии на фоне А-1899, равное 292 ± 19 с (n = 5), достоверно (Р = 0.03) отличалось от аналогичного значения Гэфф для первого эпизода гипоксии без добавления А-1899 (350 ± 12 с, n = 8). Известно, что кратковременный эпизод гипоксии вызывает в пирамидных нейронах поля СА1 гиппокампа начальную гиперполяризацию в течение первой минуты гипоксии, устраняющую спонтанную и вызванную активность нейронов, и последующую градуально увеличивающуюся деполяризацию мембранного потенциала [4, 5, 10]. Начальная гиперполяризация, связанная с увеличением мембранной проводимости к ионам калия, приводит к накоплению этих ионов во внеклеточной среде и нарушению их трансмембранного градиента. Известно, что в поддержании мембранного потенциал покоя нейронов основная роль принадлежит фоновым 2Р калиевым каналам, причем в отличие от других типов этих каналов TASK-1/TASK-3 каналы чувствительны к гипоксии [6]. По-видимому, устранение вызванного эпизодом гипоксии нарушения трансмембранного градиента ионов калия блокатором TASK-1/TASK-3 калиевых каналов способствует меньшему нарушению градиента этих ионов и более быстрому восстановлению амплитуды ПС после окончания действия кратковременной гипоксии.
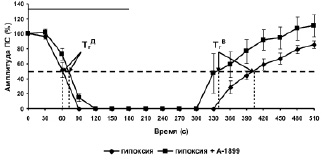
Влияние А-1899 на угнетающее действие трëхминутного эпизода гипоксии на амплитуду ПС: а – схема расположения стимулирующего (Stim) и регистрирующего (Reg) электродов в срезе гиппокампа и типичные формы ПС ответов до и после трёх 3-минутных эпизодов гипоксии. Sch – коллатерали Шаффера; rad – радиальный слой; pyr – пирамидный слой; б – динамика изменения амплитуды ПС во время эпизода гипоксии и гипоксии на фоне А-1899 (0,5 мкМ). По оси абсцисс – время в секундах, по оси ординат – амплитуда ПС в процентах от ее прегипоксических значений. Сплошная линия на графике – время приложения эпизода гипоксии или эпизода гипоксии с А-1899. Пунктирная линия отмечает 50 % снижение и 50 % восстановление амплитуды ПС после начала и окончания эпизода гипоксии
На фоне А-1899 (0,5 мкМ) наблюдалась также тенденция к снижению прекондиционирующего действия первых двух эпизодов гипоксии на эффективность третьего эпизода подавлять амплитуду ПС. Однако это снижение было недостоверным. Известно, что прекондиционирующие эффекты развиваются в двух временных диапазонах: в течение нескольких минут (быстрое прекондиционирование) и нескольких суток (задержанное прекондиционирование) [11]. Как показали наши предыдущие эксперименты, в механизмах быстрого гипоксического прекондиционирования важную роль играют митохондриальные АТФ-зависимые К+ каналы (9) и Са2+-активируемые К+ каналы большой проводимости [7]. Результаты настоящего исследования продемонстрировали, что TASK-1/TASK-3 типы фоновых 2Р калиевых каналов, по-видимому, не играют существенной роли в этих механизмах.
Анализ влияния А-1899 на развитие постгипоксической гипервозбудимости показал, что в концентрации 0,5 мкМ он не влияет на ее развитие. При нормальных физиологических условиях пирамидные нейроны поля СА1 гиппокампа генерируют одиночные потенциалы действия. Однако при определенных патологических условиях, в частности, после гипоксии, ишемии или действия потенциально эпилептогенных факторов эти нейроны способны генерировать пачки потенциалов действия. Генерация такой индуцируемой гипоксией пачечной активности (постгипоксическая гипервозбудимость) может быть связана как с входящими кальциевыми токами через потенциал- и лиганд-регулируемые мембранные каналы [3], так и входящим натриевым током через медленно-инактивирующиеся натриевые каналы [1]. Кроме того, наши предыдущие исследования показали, что в отличие от АТФ-зависимых калиевых каналов кальций-активируемые калиевые каналы также играют важную роль в развитии постгипоксической гипервозбудимости [7, 8]. Результаты настоящей работы позволяют сделать заключение, что чувствительные к гипоксии TASK-1/TASK-3 фоновые 2Р калиевые каналы не играют существенной роли в развитии постгипоксической гипервозбудимости.
Заключение
Результаты проведенных исследований позволяют заключить, что фоновые 2Р калиевые каналы TASK-1/TASK-3 типов играют важную роль в механизмах угнетающего действия гипоксии на активность пирамидных нейронов поля СА1 гиппокампа во время гипоксии, но не вносят существенного вклада в такие индуцируемые кратковременными эпизодами гипоксии формы функциональной нейропластичности, как быстрое гипоксическое прекондиционирование и развитие устойчивой постгипоксической гипервозбудимости.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 11-04-00013а).
Рецензенты:
Зинченко В.П., д.б.н., профессор, заведующий лабораторией внутриклеточной сигнализации, ФГБУН «Институт биофизики клетки Российской академии наук», г. Пущино;
Журавлева З.Н., д.б.н., в.н.с., лаборатория системной организации нейронов, ФГБУН «Институт теоретической и экспериментальной биофизики Российской академии наук», г. Пущино.
Работа поступила в редакцию 06.11.2013.



