В последние годы широко используется нозологическое понятие «хроническая болезнь почек», которое значительно шире понятия «хроническая почечная недостаточность» [10, 12]. Согласно рекомендациям NationalKidneyFoundation от 2007 года [12], идентификация ХБП осуществляется на основании следующих критериев:
1) существующее на протяжении трех и/или более месяцев заболевание почек с соответствующими изменениями в анализах мочи независимо от того, имеется снижение функции почек или нет;
2) существующее на протяжении трех и/или более месяцев снижение функции почек, при уровнях клубочковой фильтрации менее 60 мл/мин/1,73 м², независимо от наличия изменений в анализах мочи.
Хроническая болезнь почек (ХБП) занимает среди хронических неинфекционных заболеваний особое место, поскольку она встречается у не менее 10 % населения [9], связана с ухудшением качества жизни и в терминальной стадии приводит к необходимости применения дорогостоящих методов заместительной терапии – диализа и пересадки почки [6, 12]. К факторам риска развития ХБП относятся повышенное артериальное давление, гиперхолестеринемия, курение и алкоголь и многие другие [3, 6]. Результаты эпидемиологических исследований свидетельствуют, что субклинические нарушения функции почек являются независимым фактором риска развития сердечно-сосудистых осложнений [8]. Учитывая, что около 40 % взрослого населения в России имеют повышенный риск развития ХБП [4], значение данной патологии в общей смертности трудно переоценить. Многие ученые подчеркивают связь ХБП со значительным повышением сердечно-сосудистой смертности [4, 7].
Скорость клубочковой фильтрации (СКФ) – наиболее надежный показатель, характеризующий почечную функцию как при заболеваниях почек, так и у здоровых людей. Снижение СКФ рассматривается в качестве маркера неблагоприятного прогноза сердечно-сосудистых заболеваний [4], что вполне соответствует утвердившейся в последние годы концепции кардиоренального континуума [7]. У людей молодого возраста СКФ составляет примерно 120–130 мл/мин/1,73 м². Постепенное снижение СКФ отражает развитие почечной недостаточности. Классификация ХБП основана на СКФ, рассчитанной по формуле MDRD (ModificationofDietinRenalDiseaseStudy) [15], и наличии повреждения почек (таблица) [12]. Основной фактор, снижающий точность формулы, – это недостаточная надежность метода определения уровня креатинина в сыворотке крови.
В последние годы повышенное внимание уделяется методам ранней диагностики ХБП и поиску надежных скрининговых методов ее диагностики. Для оценки функции почек применяют определение креатинина сыворотки, СКФ, оценку экскреции альбумина с мочой и др.
Классификация стадий ХБП на основе СКФ [9]
|
Стадия ХБП |
Описание |
СКФ (мл/мин/1,73 м2) |
|
1 |
Повреждение почки с нормальной или повышенной СКФ |
≥ 90 |
|
2 |
Повреждение почки с незначительно сниженной СКФ |
60–89 |
|
3 |
Умеренное снижение СКФ |
30–59 |
|
4 |
Выраженное снижение СКФ |
15–29 |
|
5 |
Терминальная почечная недостаточность |
< 15 (или диализ) |
Одним из маркеров поражения почечного интерстиция является эритропоэтин [1], который секретируется тубулярными и перитубулярными клетками почек и является гуморальным регулятором эритропоэза [2, 5, 11, 14]. Синтез и секреция эритропоэтина в почках определяются уровнем обеспечения кислородом тканей этих органов [2]. Эритропоэтин регулирует пролиферацию и дифференциацию про- и эритробластов, ускоряет синтез гемоглобина в эритроидных клетках и ретикулоцитах, «запускает» в чувствительных к нему клетках синтез эритропоэтиновой и-РНК и энзимов, участвующих в формировании гема и глобина, цитоскелета эритроцитов, увеличивает кровоток в эритропоэтической ткани костного мозга и выход в кровь ретикулоцитов [2, 5, 11, 13, 14]. Отметим, что регуляция продукции эритроцитов эритропоэтином осуществляется с помощью механизма отрицательной обратной связи, при которой секреция гормона почками контролируется кислородным сенсором почки, реагирующим на парциальное давление кислорода в крови. При увеличении содержания кислорода в периферической крови уровень эритропоэтина снижается.
Целью данного исследования было определение возможности использования концентрации эритропоэтина сыворотки крови как раннего маркера ХБП.
Материалы и методы исследования
В исследование было включено 72 пациента (30 мужчин и 42 женщины) с ХБП в возрасте 51,7 ± 13,4 лет (min–max: 18–76 лет) и 10 здоровых добровольцев (5 мужчин и 5 женщин) в возрасте 49,6 ± 11,2 лет (min–max: 20–75 лет). Все пациенты проходили обследование и лечение в клинике Саратовского ГМУ им. В.И. Разумовского. Дизайн исследования одобрен Этической комиссией Саратовского государственного медицинского университета им. В.И. Разумовского.
Критерии включения в группу ХБН:
1) подтвержденный диагноз ХБП, согласно [9];
2) возраст от 18 до 80 лет.
Критерии исключения:
1) сахарный диабет;
2) онкологические заболевания и кисты почек;
3) трансплантация почек в анамнезе;
4) стеноз почечных артерий;
5) ревматоидный артрит;
6) синдром приобретенного иммуннодефицита;
7) язвенный колит;
8) прочие хронические заболевания в стадии обострения;
9) острые состояния любой этиологии.
Критерии включения в группу здоровых лиц:
1) подтвержденное отсутствие ХБП;
2) возраст от 18 до 80 лет.
Критерии исключения: наличие других хронических и острых заболеваний.
Всем пациентам выполнялись следующие виды исследований:
1) исследование концентрации эритропоэтина в крови (забор венозной крови выполнялся с 7.30 до 12.00 для снижения влияния суточной динамики эритропоэтина на результаты исследования) на автоматическом анализаторе IMMULITE / IMMULITE 1000 EPO (Siemens Healthcare DiagnosticsInc., USA);
2) биохимический анализ крови (креатинин).
СКФ рассчитывали по формуле MDRD [12].
Было выделено четыре группы пациентов по стадиям ХБП в соответствии с [3]. 8 больных (11,11 %) имели 1-ю стадию ХБП, 25 (34,72 %) – 2-ю стадию, 22 (30,55 %) – 3-ю стадию, 17 (23,61 %) – 4-ю стадию ХБП. Причинами ХБП были: гипертоническая болезнь – у 64 (88,8 %), хронический гломерулонефрит – у 14 (19,4 %), пиелонефрит – у 7 (9,72 %), прочие причины – у 27 (37,5 %). У большинства больных гипертонической болезнью встречался хронический пиелонефрит и гломерулонефрит. Средний уровень гемоглобина составлял 120,9 ± 23,2 г/л. Среди обследованных не было больных с терминальной почечной недостаточность, получавших почечную заместительную терапию.
Статистическая обработка данных выполнялась с использованием программного пакета «Statistica 6.1». Сравнение групп по количественным показателям выполнялось на основе критерия Манна–Уитни. Количественные данные представлены в виде М ± σ (при нормальном распределении) или медианы и квартильного диапазона – Ме (25 %; 75 %) (при распределении, отличном от нормального).
Результаты исследования и их обсуждение
Было выявлено, что уровень эритропоэтина у больных с 1, 2 и 3 стадиями ХБП статистически значимо выше, чем в группе здоровых лиц (р < 0,05) (рис. 1). На 4-й стадии ХБП наблюдается снижение уровня эритропоэтина до уровня здоровых лиц. Мы полагаем, что это свидетельствует о декомпенсации нарушений выработки эритропоэтина.
Выработка эритропоэтина в организме человека регулируется на уровне транскрипции его гена. Естественным физиологическим стимулом, увеличивающим количество синтезирующих эритропоэтин клеток, является гипоксия [5]. При гипоксии почечной ткани количество эритропоэтина значительно возрастает относительно нормы 0,01–0,08 ME/мл плазмы. На рис. 2 представлена обобщенная схема активации синтеза эритропоэтина при ишемии тканей почек [2, 13].
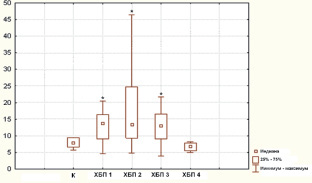
Рис. 1. Уровень эритропоэтина в крови (МЕ/мл) больных ХБП разных стадий (ХБП 1-4) и в группе контроля (К). Примечание: данные представлены в виде медианы (Ме) и квартильного диапазона. * – статистически значимые (р < 0,05) отличия от группы здоровых лиц
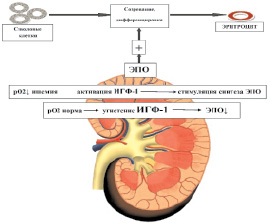
Рис. 2. Активация синтеза эритропоэтина при ишемии почечной ткани. Примечание: рО2 – парциальное давление кислорода в крови, ИГФ-1 – индуцируемый гипоксией фактор-1, ЭПО – эритропоэтин
При нормальном уровне парциального давления О2 в ткани почки радикалы кислорода, продуцируемые оксидазой, прежде всего перекись водорода, препятствуют формированию в почечной ткани «индуцируемого гипоксией фактора-1 (ИГФ-1)», стимулирующего транскрипцию эритропоэтиновой иРНК и синтез эритропоэтина. При снижении кислородного обеспечения ткани почек (рО2 до 20–40 мм рт. ст.) продукция оксидазой перекиси водорода уменьшается. Нарастает активация ИГФ-1 в цитозоле и его перемещение в ядро клетки, где ИГФ-1 специфически связывается с ДНК, вызывая экспрессию гена эритропоэтина. Это мощные компенсаторные механизмы, обеспечивающие в условиях нарастающей ишемии повышенное образование эритропоэтина и достаточный гемопоэз (анемия, как правило, не определяется). Поэтому на этой стадии заболевания вполне ожидаемо увеличение уровня эритропоэтина – «нарастающая» компенсация. Усугубление ишемии негативно влияет не только на функциональное состояние, но и на жизнеспособность эпителия перитубулярных капилляров. На этом фоне в мозговом веществе почки увеличивается концентрация лактата с параллельным сдвигом рН в кислую сторону и дальнейшим усугублением гипоксии интерстиция. Это обусловливает нарушение функционального состояния перитубулярных фибробластов, продуцирующих эритропоэтин. Не исключена роль оксидативного стресса в развитии заболевания. Реактивные формы кислорода, взаимодействуя с окисью азота (NO) в эндотелии, образуют промежуточные продукты, например, пероксинитрит, из-за чего снижается общая доступность оксида азота и возрастает сосудистый тонус. Страдает функция и выживаемость перитубулярных фибробластов, и продукция эритропоэтина резко падает. Можно предположить, что повреждение интерстициальных клеток, вырабатывающих эритропоэтин, или нарушение взаимодействия между канальцами, перитубулярными фибробластами и эндотелием, необходимого для нормального гемопоэза, способствуют ухудшению секреции эритропоэтина
В нашем исследовании показано повышение уровня эритропоэтина при развитии ХБП, свидетельствующее о важном значении гипоксии почечных тканей в патогенезе данного заболевания. При этом по мере прогрессирования патологии усиливаются и ишемические повреждения почек, приводящие в итоге к снижению уровня эритропоэтина на терминальных стадиях ХБП. Отметим, что в последнее время эритропоэтину стало уделяться особое внимание при разработке новых подходов к лечению пациентов с терминальной стадией ХБП [11]. Расширяются представления и о роли эритропоэтина не только при ХБП, но и при заболеваниях других органов и систем [13]. В нашем исследование выявлено, что значительное повышение эритропоэтина в крови наблюдается уже на ранних стадиях ХБП, это увеличивает ценность данного показателя в клинической практике для ранней диагностики ХБП.
Заключение
Таким образом, в проведенном исследовании было показано важное значение концентрации эритропоэтина в плазме крови для диагностики ХБП, в том числе на ранних стадиях развития заболевания. Патофизиологические основы повышения уровня эритропоэтина на ранних стадиях ХБП требуют дальнейшего изучения.
Рецензенты:
Горемыкин В.И., д.м.н., профессор, заведующий кафедрой факультетской педиатрии, ГБОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» Минздрава России, г. Саратов;
Болотова Н.В., д.м.н., профессор, заведующая кафедрой пропедевтики детских болезней, ГБОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» Минздрава России, г. Саратов.
Работа поступила в редакцию 17.10.2013.



