Среди современных технологий локального воздействия на ткань патологического очага лазерная деструкция является наиболее перспективной. В свете расширения показаний для использования лазеров в хирургии особый интерес представляет изучение реакции тканей и органов на лазерную деструкцию [6]. В частности, практически отсутствуют фундаментальные исследования, посвященные изучению реакции надпочечных желез на лазерное повреждение [1, 7 ] и о восстановительных процессах после него.
Цель исследования – изучить гистологическую картину тканей надпочечных желез после воздействия лазерным излучением в хирургическом диапазоне (1020 нм).
Данная работа является продолжением представленных ранее публикаций об изменении ткани надпочечника с момента лазерного повреждения до конца второй недели после него [2, 3] и посвящена ответной реакции в отдалённые сроки – с конца третей недели до конца второго месяца после воздействия.
Материал и методы исследования
Объект исследования: 18 лабораторных взрослых белых крыс-самцов линии Wistar массой 354,4 ± 18,5 г. Метод повреждения ткани: лазерное излучение (диодный лазерный аппарат «Лами») со стандартными параметрами (длина волны 1020 нм, мощность излучения 2,5 Вт, световод диаметром 400 мкм, продолжительность импульса 190 мс, интервал 10 мс, количество импульсов 150, суммарная энергия воздействия 71,25 Дж). Под хлороформным наркозом осуществлялась деструкция части левого надпочечника. На 21, 28 и 56 сутки передозировкой паров эфира производили забой крыс по 6 животных на срок. Контролем послужили 5 интактных крыс той же массы и возрастной группы.
Надпочечник обрабатывали по методу Honore [8], который позволяет дифференцировать в мозговом веществе надпочечника две основные субпопуляции хромаффиноцитов – эпинефроциты и норэпинефроциты. Материал фиксировали в 5 % глутаровом альдегиде и заливали в парафин. Срезы окрашивали сочетанием бихромата калия и толуидинового синего (норэпинефроциты окрашивались в зелёный, а эпинефроциты в серовато-фиолетовый цвет).
Расчёты и статистическую обработку проводили при помощи программы Microsoft Exel.
Результаты исследований и их обсуждение
21 сутки. Обугленные и карамелизированные ткани (лазерный струп) и остатки губчатого некроза (результат вапоризации), появившиеся после лазерного воздействия [2], имеют вид бесструктурных фрагментов коричневого цвета разной степени насыщенности. Более мелкие из них окружены отдельными фагоцитами, крупные – многослойными клеточными комплексами. Пространство между этими структурами занято грануляционной тканью с многочисленными фагоцитами, заполненными золотисто-жёлтыми гранулами. Имеются участки зрелой рубцовой ткани (рис. 1).
Среди фагоцитов преобладают одноядерные макрофаги, реже встречаются гигантские многоядерные клетки. Небольшие одноядерные формы фагоцитов и тучные клетки можно обнаружить и в толще неповреждённой части органа (рис. 2).
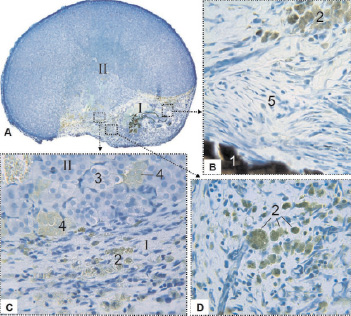
Рис. 1. Надпочечник крысы на 21 сутки после воздействия лазером: I – зона некроза; II – зона выживания; 1 – фрагмент струпа; 2 – фагоциты; 3 – эпинефроциты; 4 – норэпинефроциты; 5 – рубцовая ткань. Фикс. глут. альдегидом., окр. по Honore. A – Об. 4х, B, C, D, – Об. 40х, фотонасадка 27х
Эндокриноциты и нейроны выжившей части органа имеют нормальную морфологию.
28 сутки. Место повреждения подверглось контракции: поражённая часть уменьшилась до размеров половины от выжившей. На границе повреждённой и неповреждённой частей органа, начиная от капсулы, сформировалась зрелая рубцовая ткань. В центре повреждения определяются плотные фрагменты струпа и кистозные образования, заполненные рыхлыми остатками губчатого некроза, окруженные многослойными клеточными комплексами или отдельными фагоцитами. Грануляционная ткань в равной степени обильно заселена заполненными золотисто-жёлтыми гранулами, одноядерными макрофагами и гигантскими многоядерными клетками (рис. 3). Мелкие одноядерные фагоциты можно обнаружить по всей выжившей части органа, тучные клетки многочисленны в капсуле, реже встречаются в толще повреждённой части органа. В неповреждённой части явных следов неблагополучия не наблюдается.
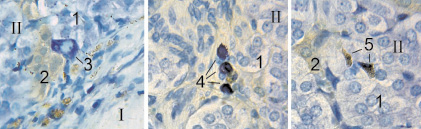
Рис. 2. Надпочечник крысы на 21 сутки после воздействия лазером: I – зона некроза; II – зона выживания; 1 – эпинефроциты; 2 – норэпинефроциты; 3 – нейрон; 4 – тучные клетки; 5 – одноядерные макрофаги. Фикс. глут. альдегидом., окр. по Honore. Об. 40х, фотонасадка 27х
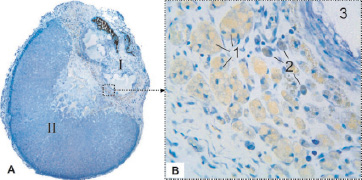
Рис. 3. Надпочечник крысы на 28 сутки после воздействия лазером: I – зона некроза; II – зона выживания; 1 – гигантские многоядерные клетки; 2 – одноядерные макрофаги; 3 – полость кисты. Фикс. глут. альдегидом., окр. по Honore. A – Об. 4х, B – Об. 40х, фотонасадка 27х
56 сутки. В целом гистологическая картина показывает плавное развитие начавшихся ранее процессов. Место повреждения ещё более стянуто рубцовой тканью. В ней залегают остатки струпа, имеющие вид инкапсулированных светло-коричневых глыб, окружённых в основном гигантскими многоядерными клетками. Кисты с рыхлыми остатками губчатого некроза исчезли. Как и на 28 сутки отдельные мелкие одноядерные фагоциты можно обнаружить между эндокриноцитами по всей выжившей части органа, а тучные клетки находятся в капсуле или, реже, в повреждённой части.
Неповреждённая часть надпочечника имеет гистологическую структуру, соответствующую нормальной: в корковом веществе различимы клубочковая, пучковая и сетчатая зоны, в клетках гранулы секрета, в мозговом веществе эндокриноциты показывают полноценную хромаффинную реакцию, нор- и эпинефроциты хорошо дифференцируются.
Так как неповреждённая часть сохранила прежние пропорции, а повреждённая ужалась, орган приобрёл форму усечённого эллипса. Мозговое вещество оказалось окруженным корковым только с трёх сторон, а с четвёртой ограничено рубцовой тканью, плавно переходящей в капсулу (рис. 4). Объём надпочечника в данную контрольную точку составил 3,1 ± 0,5 мм3, что соответствует 30 % объёма от исходного в 10,0 ± 2,5 мм3 в день повреждения и от нормы для данного возраста (р < 0,01).
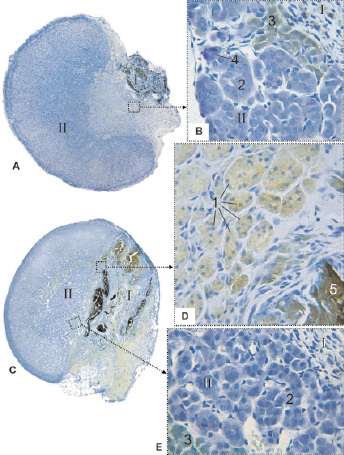
Рис. 4. Надпочечник крысы на 56 сутки после воздействия лазером: I – зона некроза; II – зона выживания; 1 – гигантские многоядерные клетки; 2 – эпинефроциты; 3 – норэпинефроциты; 4 – нейрон; 5 – фрагмент струпа. Фикс. глут. альдегидом, окр. по Honore. A, C – Об. 4х, D, E – Об. 40х, фотонасадка 27х
В половине случаев всех изученных сроков повреждённый надпочечник представляет собой состоящий преимущественно из волокнистой соединительной ткани узел эллиптической формы размером 1,4 ± 1,1 мм3, составляющий лишь около 10 % объёма органа в день повреждения и от нормы для данного возраста (р < 0,01). Центральная его часть содержит инкапсулированные фрагменты лазерного струпа и многочисленные фагоциты, в том числе гигантские многоядерные клетки, капсула утолщена, мозговые эндокриноциты отсутствуют, корковые сохранились лишь на периферии органа в виде уплощенных скоплений или островков без зональной дифференцировки (рис. 5).
Развитие событий в месте лазерного повреждения в поздние сроки укладывается в известную схему восстановления после аналогичного воздействия для других паренхиматозных органов. В частности, это продолжительная макрофагальная реакция, интенсивная пролиферация соединительнотканных элементов, участие многоядерных гигантских клеток инородных тел в резорбции некротизированной ткани, образование рубца и постепенная инкапсуляция струпа [4, 5, 9].
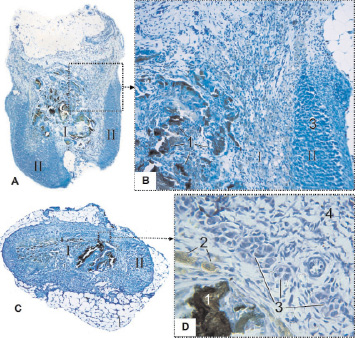
Рис. 5. Надпочечник крысы после воздействия лазером: A, B – на 28 сутки; C, D – на 56 сутки; I – зона некроза; II – зона выживания; 1 – фрагменты струпа; 2 – фагоциты; 3 –корковые эндокриношциты; 4 – капсула органа. Фикс. глут. альдегидом., окр. по Honore. A, C – Об. 4х, B, D – Об. 40х, фотонасадка 27х
Появление многоядерных гигантских клеток инородных тел и их участие в резорбции некротизированных масс является характерной чертой лазерного поражения [5]. В качестве инородных тел, стимулирующих появление этих клеток, выступают глыбы угля, массивность, химическая инертность и нерастворимость которых препятствуют их резорбции. В результате они инкапсулируются и сохраняются в органе, очевидно, пожизненно. Однако это не объясняет длительную обильную макрофагальную реакцию, так как замаскированные капсулами инородные частицы не привлекают иммунные клетки. Считается, что интенсивная и продолжительная макрофагальная реакция в лазерных ранах связана с длительной сохранностью коагулированных тканей [4]. На наш взгляд, в качестве причины этого явления следует добавить также наличие в струпе значительного объёма комплексов органических веществ с промежуточной степенью структурной редукции между коагуляцией (денатурацией) и превращением в уголь. Эти комплексы образуют внутренний слой лазерного струпа и, вследствие карамелизации сахаров, имеют золотисто-жёлтую окраску. Переход между обугленными, карамелизированными и только коагулированными органическими массами плавный, соответствует падению интенсивности лазерного воздействия от точки приложения к периферии. Так как слабо редуцированные комплексы органических веществ легко разрушаются иммунными клетками и быстро удаляются, а уголь, спёкшийся в глыбы и плохо резорбирующийся, подвергается инкапсуляции, логично было бы ожидать, что в поздние сроки должно было наступить угасание активности фагоцитов. Но так как карамелизированные массы хоть и не настолько легко удаляются как коагулированные, они и не столь инертны как уголь и продолжают медленно распадаться, что длительное время привлекает множество фагоцитов, которые постепенно оккупируют всю поражённую часть органа, наполняются золотисто-жёлтыми гранулами и сливаются в гигантские многоядерные клетки. До 14 суток фагоциты представлены в основном одноядерными формами [3], начиная с 28 суток и до конца наблюдения в 56 суток доминируют гигантские многоядерные клетки. По мере возможности карамелизированные массы уносятся макрофагами из зоны поражения, поэтому после 21 суток наиболее подвижные из них можно встретить в толще неповреждённой части органа далеко за пределами зоны поражения. Наполнение макрофагов вплоть до конца наблюдения именно золотисто-жёлтым содержимым структурно и тинкториально идентичным карамелизированным массам явно свидетельствует в пользу сказанного.
Картина фрагментирования и почти полной деградации паренхимы и превращение органа фактически в соединительнотканный узел связано, очевидно, с тем, что вследствие небольшого размера надпочечника у крыс при использованных параметрах лазерного воздействия произошёл перегрев и повреждение всего объёма органа за исключением периферических участков. Распределение температуры в органе зависит и от специфики перфузии в органе [4, 10], а в мозговом веществе присутствуют объёмные венозные синусы.
Значительное уменьшение объёма органа и преобразование его анатомических пропорций в вид соответствующий усечённой или равномерно ужатой исходной форме свидетельствует не только о сильной контракции поражённой части, но и отсутствии восстановительной гипертрофии выжившей паренхимы.
Выводы
1. В ответ на лазерное повреждение в надпочечнике с 21 по 56 сутки наблюдается формирование рубцовой ткани, продолжительная обильная фагоцитарная реакция с участием многоядерных гигантских клеток и инкапсуляция нерезорбированных фрагментов струпа.
2. Поражённая часть органа подвергается контракции.
3. Выжившая часть надпочечника не демонстрирует гипертрофии.
4. В случае выживания хотя бы 1/3 паренхимы её морфофункциональное состояние соответствует нормальному, при более обширном поражении эндокриноциты деградируют, а надпочечник превращается в соединительнотканный узел.
Рецензенты:
Гансбургский А.Н., д.м.н., профессор кафедры гистологии, цитологии и эмбриологии, ГБОУ ВПО «Ярославская государственная медицинская академия» Минздрава РФ, г. Ярославль;
Хорев А.Н., д.м.н., профессор, заведующий кафедрой факультетской хирургии, ГБОУ ВПО «Ярославская государственная медицинская академия» Минздрава РФ г. Ярославль.
Работа поступила в редакцию 05.12.2013.



