Остеоинтеграция – это биологическое явление, означающее сращение неживого (металлического) элемента с живой тканью Р. Вгаnеmагк (1977) определил остеоинтеграцию как «очевидное прямое (непосредственное) прикрепление или присоединение живой костной ткани к поверхности имплантата без внедрения прослойки соединительной ткани».
Кость обладает сильным потенциалом регенерации, однако не всегда процесс естественного заживления приводит к полному восстановлению анатомической целостности и функциональных возможностей костной ткани. Для адекватной регенерации костной ткани при заболеваниях челюстно-лицевой области, травматических поражениях, имплантации существенное значение имеет соотношение нервных, эндокринных и иммунных механизмов регуляции остеогенеза, реализующееся рядом биологически активных медиаторов, таких как бэтта-эндорфин, серотонин и др. (Волков М.В., Оганесян О.В., 1996; Маланин Д.А., 2002; Корнилов Н.В., Грязнухина Э.Г., 2006). Именно они обеспечивают регуляцию во времени и объеме регенерата роста и дифференцировку остеобластического, остеокластического, сосудистого и соединительнотканного ростков, в итоге формирующих функционирующую кость (Ревелл П.А., 1993; Рожинская Л.Я., 2006).
Учитывая то, что биологически активные вещества оказывают гомеостатическое действие и влияют на регуляцию различных физиологических функций, включая репаративную регенерацию поврежденных тканей, представляет большой интерес возможность немедикаментозного воздействия на опиоидергические структуры мозга.
Таким свойством обладает метод транскраниальной электростимуляции (ТЭС), который осуществляется слабым током специальных характеристик через электроды, помещаемые на кожу головы. Метод был разработан в Институте физиологии им. акад. И.П. Павлова РАН в лаборатории физических методов обезболивания под руководством лауреата Государственной премии, профессора, д.м.н. В.П. Лебедева. Одними из исследований, раскрывающих центральный анальгетический и периферические эффекты ТЭС, стали работы А.В. Савченко, Е.Е. Васенёва (1998), О.А. Антиповой (2005), С.В. Барковой (2007), В.В. Подольского (2009). В работах был сделан вывод, что в возникновении транскраниальной электроанальгезии участвуют взаимосвязанные опиоидный, серотонинергический и холинергический механизмы. ТЭС в терапевтическом режиме оказывает репаративный, иммуномодулирующий и вегетотропный эффекты, которые реализуются с участием опиоидных механизмов.
Цель – дать сравнительную характеристику динамике морфоструктурных изменений периимплантатной костной ткани под воздействием ТЭС-терапии и без нее в эксперименте.
Материалы и методы исследования
С целью изучения влияния транскраниальной электростимуляции на процесс остеоинтеграции дентальных имплантатов нами была проработана схема оперативного вмешательства на лабораторных животных.
Исследование проведено в лаборатории моделирования патологии ГБУ «Волгоградский медицинский научный центр». Эксперимент выполнен на 60 белых беспородных крысах-самцах массой 250–300 г, содержащихся в условиях вивария (t°= 22–24 °C, относительная влажность воздуха 40–50 %), с естественным режимом на стандартной диете (ГОСТ Р 50258-92), при соблюдении правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.3-96 и 1000.4-96) и правила гуманного обращения с животными (Report of the AVMA Panel on Euthanasia JAVMA, 2001), а также правил Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемые при экспериментальных исследованиях (1997). Эксперименты были одобрены комитетом по этической экспертизе исследований Волгоградского государственного медицинского университета (протокол № 142 – 2011 от 28.06.2011).
Все животные были разделены на 2 группы.
Основная группа – животные, в лечение которых включена ТЭС-терапия в послеоперационном периоде при имплантации.
Контрольная группа – животные, не получающие ТЭС-терапию.
Методика экспериментальной операции
В условиях стерильной операционной после обработки операционного поля все манипуляции выполняли под наркозом. Наркотизация животных осуществлялась путём введения в левую икроножную мышцу 0,1 % атропина в количестве, соответствующем весу животного (согласно инструкции производителя). Затем в эту же мышцу вводили «Золитил-100» в дозе 8 мг/кг (согласно инструкции производителя). После того как животное переставало реагировать на раздражение, его фиксировали. Производили разрез кожи и подкожно-жировой клетчатки по передней поверхности левого бедра длиной 1,5 см. Края раны отмобилизовали, продольно рассекали мышечный слой и надкостницу, отпрепарировали переднюю поверхность бедренной кости в области диафиза (с частью метафиза). С помощью бормашины, шаровидным бором производили пропил кортикальной пластины и губчатого вещества кости глубиной 8 мм, диаметром 0,8 мм. В полученное костное ложе имплантирован стерильный образец длиной 8 мм, диаметром 0,8 мм. Рана послойно ушивалась узловыми швами, полностью укрывая имплантат. Кожная рана ушивалась узловыми швами полигликолид 4/0. Гемостаз произведен по ходу операции. В качестве контроля применяли рентгенологический метод исследования.
Распределение экспериментальных животных по группам наблюдения
|
Группы экспериментальных животных |
|
|
I |
I I |
|
Электростимуляция (ТЭС) |
Контроль (без воздействия) |
|
30 |
30 |
|
60 животных |
|
Животных выводили из эксперимента в сроки 14, 30 и 90 суток посредством передозировки эфирного наркоза. На аутопсии производили забор бедренных костей, вырезали область имплантации.
Гистологическая обработка. Тканевые образцы фиксировали в 10 % нейтральном формалине, декальцинацию проводили в 25 % Трилоне Б. Далее следовала проводка через спирты возрастающих концентраций и заключение в парафин. Срезы толщиной 5–6 микрон готовили на роторном микротоме марки HM 355S фирмы Microm, окрашивали гематоксилином и эозином. Гистологические препараты фотографировали цифровой камерой Canon (Japan, 5.0 мегапикселей) на базе микроскопа Axiostar plus (Карл Цейс, Германия) с использованием объектива х50; х100, х400 и окуляра х10.
В процессе работы с препаратами изучали состояние тканевых структур вокруг имплантата по следующим критериям:
I. Оценка состояния соединительнотканной прослойки между имплантатом и костью:
1. Очень широкая, с высокой клеточностью, в том числе с примесями лимфомакрофагальных элементов и ангиоматозом – «–5»;
2. Средней ширины с умеренным числом клеток, главным образом фибробластов, с умеренно развитыми фибриллярными структурами коллагеновые волокна образуют пучки, есть участки разволокнения – «–4»;
3. Соединительнотканная прослойка средней ширины, имеет грубоволокнистое строение, клеточных элементов немного, это зрелые фибробласты – «–3»;
4. Узкая грубоволокнистая прослойка – «–2»;
5. Тяж из вытянутых соединительнотканных клеток –«–1».
6. Соединительнотканной прослойки нет – «+1».
II. Оценка состояния структуры материнской кости:
7. Признаки некробиоза и некроза, остеоцитов краевой зоны есть – «–1»;
8. Признаки некробиоза и некроза остеоцитов краевой зоны отсутствуют – «+1»;
9. Резко выраженная рарсфикация материнской кости – «–3»;
10. Умеренно выраженная рарсфикация материнской кости – «–2»;
11. Слабо выраженная рарефикация материнской кости –«–1»;
12. Отсутствие рарсфикации материнской кости – «+3».
III. Оценка состояния структуры новообразованной кости:
13. Новообразования кости нет – 0;
14. Преимущественное образование остеоидной костной ткани – «+1»;
15. Преимущественное образование трабекулярной костной ткани с фиброзным матриксом «+2»;
16. Интенсивное новообразование кости – «+3»;
17. Компактизация новообразованного костного вещества – «+4».
На всем этапе было проанализировано 240 рентгенограмм, 264 фотографий и 70 гистологических препаратов.
Результаты исследования и их обсуждения
Морфологические изменения периимплантатной костной ткани у животных 1 группы (основная)
В первой экспериментальной группе при микроскопическом исследовании через 2 недели вокруг титановых имплантатов происходило формирование бесклеточной зоны, которая отделяла имплантат от зоны выраженного ремоделирования костной ткани. В части костных балок определялись лакуны остеобластокластической резорбции, визуализировались новообразованные костно-остеоидные балки. По периметру имплантата располагалась новообразованная рыхловолокнистая соединительная ткань и хрящевая ткань. Объёмная доля костной, хрящевой и соединительной ткани составляла 25,1 ± 2,8 %, 15,7 ± 4,2 и 59,2 ± 2,3 % соответственно (рис. 1, а).
Гистологически к 4 недели эксперимента за прослойкой бесклеточной ткани отмечалось формирование вокруг титановых имплантатов преимущественно грубоволокнистой соединительной и гиалиновой хрящевой ткани с наличием отдельных участков сформированной губчатой костной ткани (рис. 1, б). Объёмная доля костной, хрящевой и соединительной ткани составляла 38,6 ± 4,1, 15,3 ± 2,9 и 46,1 ± 4,9 % соответственно.
При исследовании зоны имплантации на 12 неделе эксперимента незначительно выявлялась бесклеточная зона, увеличивалось количество костной ткани, уменьшалась объёмная доля соединительной и хрящевой (рис. 1, в). Объёмная доля костной, хрящевой и соединительной ткани составляла 47,9 ± 3,3, 13,1 ± 2,1 и 39 ± 3,5 % соответственно Воспалительные и дегенеративно-дистрофические изменения также отсутствовали во все сроки наблюдения.
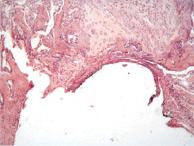
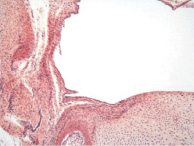
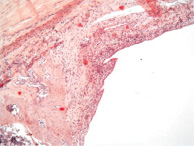
Рис. 1. 1 группа. Разрастание волокнистой соединительной и хрящевой ткани вокруг титанового имплантата: а – 2 недели; б – 4 недели; в – 12 недель. Окраска гематоксилином и эозином. Начальное увеличение х50
Морфологические изменения периимплантатной костной ткани у животных 2 группы (опытная)
Гистологическое исследование зоны имплантации у животных второй группы на 2 неделе эксперимента выявило наличие гомогенной эозинофильной бесклеточной зоны, за которой визуализировалась рыхловолокнистая соединительная ткань с явлениями выраженного отёка и далее следовала зона ремоделирования костной ткани в виде остеобластокластической резорбции отдельных балок наравне с формированием остеоидных и костно-остеоидных балок. Определялись единичные участки хрящевой ткани. Объёмная доля костной, хрящевой и соединительной ткани составляла 18,9 ± 3,3, 7,2 ± 2,1 и 73,9 ± 4,5 % соответственно (рис. 2, а).
К 4 неделе наблюдения в зоне имплантации определялась узкая гомогенная эозинофильная бесклеточная зона с перифокальным формированием грубоволокнистой соединительной ткани, которая чередовалась с участками гиалиновой хрящевой ткани. В некоторых зонах определялись фрагменты губчатой костной ткани с признаками минимального ремоделирования (рис. 2, б). Объёмная доля костной, хрящевой и соединительной ткани составляла 13,3 ± 2,8, 34,2 ± 6,1 и 52,5 ± 3,7 соответственно.
Микроскопически на 12 неделе эксперимента гистологические изменения носили схожий характер по сравнению с 4 неделями. Определялись бесклеточная зона, хорошо сформированные единичные костные балки среди зрелой фиброзной ткани и участками гиалинового хряща (рис. 2, в). Объёмная доля костной, хрящевой и соединительной ткани составляла 18,9 ± 3,3, 31,3 ± 2,1 и 49,8 ± 4,5 % соответственно Воспалительные и дегенеративно-дистрофические изменения не визуализировались во все сроки эксперимента.
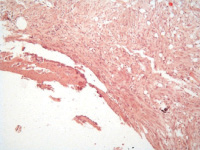
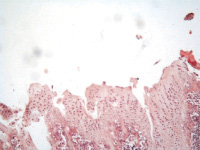
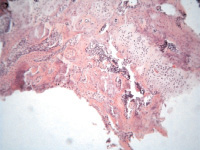
Рис. 2. 2 группа. Разрастание волокнистой соединительной и хрящевой ткани вокруг титанового имплантата: а – 2 недели; б – 4 недели; в – 12 недель. Окраска гематоксилином и эозином. Начальное увеличение х50
Морфологические изменения костной ткани у животных 3 группы (контроль)
Морфологических изменений костной ткани у животных 3 группы (контроль) не наблюдалось, так как в процессе эксперимента животные этой группы не подвергались хирургическому вмешательству и служили нормой в морфологическом строении костной ткани челюстей.
Вывод
Обобщая полученные результаты, можно с уверенностью сказать, что предложенный метод немедикаментозного воздействия на опиоидергические структуры мозга оказывает стимулирующее действие, что влияет на процессы снижения воспалительных реакций, адаптирования тканей операционного поля после вмешательства и возможность прогнозирования качества, и скорости процесса остеоинтеграции. Крайне важно учитывать оптимальные режимы предлагаемых воздействий.
Рецензенты:Фирсова И.В., д.м.н., профессор, зав. кафедрой терапевтической стоматологии ВолгГМУ, Стоматологическая поликлиника ВолгГМУ, г. Волгоград;
Данилина Т.Ф., д.м.н., профессор кафедры пропедевтики стоматологических заболеваний, Стоматологическая поликлиника ВолгГМУ, г. Волгоград.



