Перитонит остается одной из основных причин летальности при острых хирургических заболеваниях брюшной полости. Известна важная патогенетическая роль перекисного дисбаланса при гнойно-воспалительных процессах, в том числе и перитоните, и в формировании полиорганной недостаточности как основной причины летальных исходов [3]. В связи с этим актуальным является изучение эффектов антиоксидантов на течение перитонита. При этом важным является комплексная оценка влияния препаратов, включающая в себя мониторинг как маркеров окислительного стресса, так и маркеров поражения органов (прежде всего, печени и почек).
Целью настоящего исследования явилось сравнительное изучение влияния антиоксидантов (аскорбиновая кислота, метилэтилпиридинол, N-ацетилцистеин) на течение экспериментального перитонита, вызванного Escherichia coli или Klebsiella pneumoniae.
Материалы и методы исследования
Исследование выполнено на 70 крысах-самцах линии Вистар в возрасте 2–3 месяцев массой 190–290 г, полученных из питомника НИИ цитологии и генетики СО РАН (г. Новосибирск). Содержание крыс соответствовало требованиям Хельсинкской декларации Всемирной медицинской ассоциации (2000 г.), Европейской конвенции «О защите позвоночных животных, используемых для экспериментальных или иных научных целей» (Страсбург, 1986 г.). Соответственно изучаемым микроорганизмам эксперимент был разделен на 2 серии по 35 животных в каждой (5 групп по 7 особей). В каждой серии животным первой группы однократно вводился стерильный изотонический раствор хлорида натрия, животным остальных групп – бактериальная суспензия (2,5 усл. ед. по Мак-Фарланду, 5 мл/кг), полученная из суточной чистой культуры клинического штамма E. coli или Klebsiella pneumoniae. Спустя 3 часа после инъекции животным первой («K») и второй («П») групп внутрибрюшинно вводился стерильный изотонический раствор хлорида натрия, третьей группы («АСК») – раствор аскорбиновой кислоты (Panreac, Испания), четвертой группы («МЭП») – раствор метилэтилпиридинола (ФГУП МЭЗ, Россия), пятой группы («НАЦ») – раствор N-ацетилцистеина (Sigma-Aldrich, США). Еще через 3 часа стерильный изотонический раствор хлорида натрия и лекарственные препараты вводились повторно. Растворы для инъекций готовились из субстанций в асептических условиях (за исключением метилэтилпиридинола и изотонического раствора NaCl) непосредственно перед введением. Все антиоксиданты применялись в дозе 80 мг/кг, установленной в соответствии с правилами межвидового переноса на основании терапевтических доз, применяемых у человека [8].
Через 24 часа после введения бактериальной суспензии с помощью диагностических наборов (ООО «Витал Диагностикс СПб», Россия) в качестве маркеров поражения печени определялись активность аланинаминотрансферазы и щелочной фосфатазы, маркеров поражения почек – концентрации мочевины и креатинина. Для оценки оксидантного статуса определяли активность каталазы [4] и глутатионпероксидазы эритроцитов [5], а также плазменные концентрации восстановленного глутатиона [9] и тиобарбитурат-реактивных продуктов [1], в качестве маркера воспаления – концентрацию церулоплазмина в плазме крови, проявляющего также антиоксидантные свойства [13].
Статистическую обработку результатов проводили с использованием непараметического критерия Манна‒Уитни с помощью программы SigmaStat 3.5 (Systat Software, Inc., США), различия считали значимыми при P < 0,05 [2].
Результаты исследования и их обсуждение
Введение взвеси микроорганизмов приводит к активному развитию воспаления – перитониту. Об этом свидетельствует повышение концентрации церулоплазмина в плазме крови крыс обеих серий. Оно носит статистически значимый характер и не поддается коррекции исследуемыми антиоксидантами (рисунок).
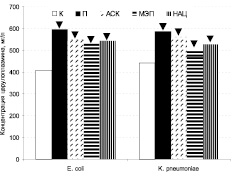
Влияние антиоксидантов на концентрацию церулоплазмина при экспериментальном перитоните (▼– значимое различие с контрольной группой («К») серии, p < 0,05)
Перитонит, вызванный кишечной палочкой, сопровождается небольшим (на 25 %), но статистически значимым повышением маркера дисфункции печени – аланинаминотрансферазы (АЛТ). Введение антиоксидантов уменьшает указанный эффект (табл. 1). Klebsiella pneumoniae вызывает более тяжелое поражение печени, при этом гепатопротекторное действие оказывает только метилэтилпиридинол. Обращает также на себя внимание и повышение креатинина плазмы при перитоните, вызванном клебсиеллой, что может объясняться почечной дисфункцией. При этом отсутствие повышения концентрации мочевины обусловлено снижением ее синтеза в печени. Нарушение функции почек уменьшается введением аскорбиновой кислоты или метилэтилпиридинола.
Оба микроорганизма вызывают выраженный оксидативный стресс: повышается активность каталазы, концентрация тиобарбитурат-реактивных продуктов с одновременным снижением концентрации восстановленного глутатиона и активности глутатионпероксидазы. Klebsiella pneumoniae по сравнению с кишечной палочкой вызывает более выраженное усиление процессов пероксидации. Наиболее выраженной антиоксидантной активностью в условиях экспериментального перитонита у животных обеих серий обладает метилэтилпиридинол (табл. 2).
Генерация активных форм кислорода и концентрация малонового диальдегида – продукта ПОЛ – повышаются в условиях сепсиса, которым сопровождается перитонит [11, 14]. Важными эффектами бактериальных эндотоксинов являются ингибирование метаболизма глюкозы, липидного обмена, повышение образования свободных радикалов, интенсивности перекисного окисления липидов и повреждение клеток [10]. Снижение содержания восстановленного глутатиона может быть связано с экспортом окисленной формы, а также со снижением активности глутатионредуктазы. Возможной причиной могут быть снижение образования NADPH, необходимого для восстановления глутатиона, вследствие угнетения работы пентозофосфатного шунта в кислой среде воспалительного очага [12].
Таблица 1
Влияние антиоксидантов на поражение печени и почек в условиях экспериментального перитонита
|
Группа |
АЛТ, мкмоль/(с×л) |
ЩФ, нмоль/(с×л) |
Мочевина, ммоль/л |
Креатинин, мкмоль/л |
|
Escherichia coli |
||||
|
К |
1,09 (0,88; 1,19) |
1565,8 (1373,5; 1942,3) |
2,03 (1,77; 2,45) |
57,08 (52,32; 59,21) |
|
П |
1,36 (1,28; 1,44)* |
1460,6 (1136,8; 1659,7) |
2,28 (1,90; 2,45) |
57,08 (51,14; 59,40) |
|
АСК |
1,29 (1,11; 1,30) |
1571,8 (1453,9; 1674,0) |
1,64 (1,57; 2,59) |
47,32 (45,25; 54,26) |
|
МЭП |
0,99 (0,98; 1,13) |
1604,9 (1520,7; 1678,5) |
2,26 (1,86; 2,35) |
56,58 (48,38; 59,33) |
|
НАЦ |
1,25 (1,05; 1,34) |
1565,8 (1360,7; 1754,4) |
2,11 (1,79; 2,34) |
54,08 (47,13; 56,58) |
|
Klebsiella pneumoniae |
||||
|
К |
1,24 (1,09; 1,47) |
1397,5 (1205,2; 1537,3) |
2,17 (1,97; 2,49) |
55,33 (51,07; 60,09) |
|
АБ |
1,75 (1,55; 1,78)* |
1544,8 (1220,9; 1765,7) |
2,04 (1,72; 2,33) |
66,84 (61,09; 71,73)* |
|
АСК |
1,76 (1,61; 2,01)* |
1571,8 (1262,3; 1738,6) |
2,37 (1,94; 2,62) |
64,84 (56,77; 78,42) |
|
МЭП |
1,55 (1,42; 2,13) |
1550,8 (1269,0; 1578,6) |
2,19 (1,88; 2,34) |
60,59 (53,33; 65,66) |
|
НАЦ |
1,76 (1,57; 2,11)* |
1574,8 (1320,1; 1746,9) |
2,34 (1,99; 2,61) |
66,84 (61,65; 72,16)* |
Примечание. * – значимое различие с контрольной группой («К») серии (p < 0,05).
Таблица 2
Влияние антибактериальных средств на свободнорадикальное окисление и его коррекция антиоксидантами
|
Группа |
КАТ, % на мг Hb |
ВГ, мкмоль/г Hb |
ГПО, мкмоль/(мин⋅л) |
ТБРП, мкМ |
|
Escherichia coli |
||||
|
К |
0,027 (0,018; 0,042) |
0,97 (0,79; 1,00) |
18,80 (16,92; 23,14) |
3,37 (2,83; 4,20) |
|
П |
0,051 (0,047; 0,053)* |
0,56 (0,52; 0,68)* |
13,89 (11,04; 16,41)* |
4,84 (4,32; 5,08)* |
|
АСК |
0,042 (0,035; 0,052)* |
0,68 (0,61; 1,03) |
16,95 (14,29; 20,76) |
4,26 (3,85; 4,97) |
|
МЭП |
0,041 (0,032; 0,043) |
0,78 (0,71; 0,95) |
17,49 (16,97; 17,99) |
3,80 (3,43; 4,10) |
|
НАЦ |
0,035 (0,033; 0,043) |
0,65 (0,56; 0,67)* |
15,44 (13,85; 18,17) |
4,50 (3,78; 4,76) |
|
Klebsiella pneumoniae |
||||
|
К |
0,027 (0,024; 0,036) |
0,82 (0,74; 0,85) |
17,95 (17,11; 22,05) |
3,68 (3,39; 4,21) |
|
АБ |
0,052 (0,045; 0,053)* |
0,45 (0,38; 0,54)* |
14,83 (12,87; 16,80)* |
5,23 (4,79; 5,80)* |
|
АСК |
0,051 (0,049; 0,053)* |
0,56 (0,50; 0,66)* |
16,58 (12,83; 17,08)* |
4,81 (3,97; 5,44)* |
|
МЭП |
0,042 (0,034; 0,044) |
0,67 (0,55; 0,85) |
18,78 (17,79; 19,29) |
4,15 (3,69; 4,54) |
|
НАЦ |
0,044 (0,042; 0,050)* |
0,47 (0,37; 0,61)* |
17,79 (15,21; 19,02) |
5,19 (3,81; 5,59) |
Примечание. * – значимое различие с контрольной группой серии (p < 0,05).
Несмотря на доказанное цитотоксическое действие свободных радикалов, введение антиоксидантов не всегда приводит к уменьшению органной дисфункции. Наиболее эффективное органопротективное действие оказал метилэтилпиридинол, что может объясняться его антибактериальной активностью в отношении исследуемых штаммов, установленной нами в результате исследований in vitro [6, 7]. В связи с этим очевидно, что в условиях бактериальной инфекции с целью коррекции оксидативного стресса наиболее целесообразно применять антиоксиданты, которые дополнительно оказывают антибактериальное действие.
Заключение
Экспериментальный перитонит, вызванный грамотрицательными микроорганизмами, сопровождается оксидативным стрессом, поэтому применение антиоксидантов является патогенетически оправданным. Антиоксидантная терапия в некоторой степени снижает выраженность оксидативного стресса, но не уменьшает воспалительную реакцию. Метилэтилпиридинол, антибактериальные свойства которого были установлены ранее, проявляет также выраженный органопротективный эффект. Несомненно, важными условиями применения антиоксидантов в комплексной терапии больных с бактериальными инфекциями являются отсутствие влияния на активность антибактериальных средств, а также комплексный биохимический мониторинг, включающий в себя как оценку маркеров оксидативного стресса, так и маркеров органной дисфункции.
Рецензенты:Смирнов И.В., д.м.н., зав. кафедрой фармакогнозии и ботаники, ГБОУ ВПО АГМУ Минздрава России, г. Барнаул;
Галактионова Л.П., д.б.н., профессор кафедры биохимии и клинической лабораторной диагностики, ГБОУ ВПО АГМУ Минздрава России, г. Барнаул.



