Поиск соединений с потенциальной биологической активностью в ряду гетероциклов является актуальным. В этом отношении большой интерес представляют трициклические азотосодержащие гетеросистемы пирролохинолины – структурные аналоги витамина PQQ. В связи с этим разработка методов синтеза различно замещенных, с различным аннелированием колец пирролохинолинов является весьма перспективным.
Цель исследования – изучение возможности использования 4-амино-1-метил-2-фенилиндола и β-кетоэфиров (метиловый эфир ацетоуксусной кислоты, щавелевоуксусный эфир) в синтезе пирроло[2,3-h]хинолинов. Настоящее исследование имеет фундаментальную направленность.
Материалы и методы исследования
Спектры ЯМР 1Н записаны на мультиядерном спектрометре ядерного магнитного резонанса JoelJNM-ECX400 (400 МГц) в DMSO-d6. Расчетные спектры соединений выполнены с использованием программы ACD/LABSHNMR Spectrum Generator: ChemsketchWindows. Электронные спектры сняты на приборе LEKISS2109UV в этаноле. Квантово-химические расчеты эффективных зарядов на атомах молекул систем I–V проведены ограниченным методом Хартри – Фока в параметризации полуэмпирического метода РМ3 и пакета прикладных программ GAMESS. Очистку продуктов реакции проводили методом колоночной хроматографии. В качестве сорбента использовали оксид алюминия (нейтральный, I и II ст. акт. по Брокману). Контроль за ходом реакции, чистотой полученных соединений, определение Rf осуществляли с помощью ТСХ на пластинках SilufolUV–254 в системах: бензол–этилацетат 15:1 (а), бензол–этилацетат 10:1 (б), этилацетат–метанол 4:1 (в).
Аминоиндол1 получен по аналогичной методике, приведенной в работе [6].
Метил (2Z)-3-[1-метил-2-фенил-1Н-индол-4-ил)амино]-2-бутеноат (2) из 0,35 г (1,58 ммоль) 4-амино-1-метил-2-фенилиндола (1) и 0,19 г (1,35 ммоль) метилового эфира ацетоуксусной кислоты в 200 мл абсолютного бензола, в присутствии следов ледяной уксусной кислоты нагревают 33 часа с насадкой Дина – Старка. По окончании реакции (контроль хроматографический) бензол отгоняют. Полученное вещество очищают пропусканием нагретого до кипения раствора в петролейном эфире с небольшим количеством бензола через слой (2 см) оксида алюминия. Перекристаллизовывают из смеси бензол-петролейный эфир. Выход: 0,28 г (55 %). Rf = 0,60 (а), т. пл. = 86–87 °С (бензол–петролейный эфир). Найдено, %: С 74,88; Н 6,33; C20H20N2О2; вычислено, %: С 74,58; Н 6,29.
Диэтил(2Z)-2-[1-метил-2-фенил-1Н-индол-4-ил)амино]-2-бутенедиоат (3) получают аналогично из 0,33 г (1,49 ммоль) 4-амино-1-метил-2-фенилиндола (1) и 0,28 г (1,49 ммоль) щавелевоуксусного эфира, но нагревают 41 ч. Выход: 0,28 г (22 %). Rf = 0,86 (б), т. пл. = 118–119 °С (бензол–петролейный эфир). Найдено, %: С 70,83; Н 6,22; C23H24N2О4; вычислено, %: С 70,39; Н 6,16.
2,7-Диметил-8-фенил-1,7-дигидро-4Н-пирроло[2,3-h]хинолин-4-он (4). 0,11 г (0,34 ммоль) енамина 2 нагревают в кипящем дифениле 20–30 мин. По окончании реакции (хроматографический контроль) еще теплую реакционную массу выливают в гексан. Выпавший осадок отфильтровывают и многократно промывают горячим гексаном от дифенила. Перекристаллизовывают из спирта. Выход: 0,044 г (45 %). Rf = 0,65 (в), т. пл. = 121–122 °С (этиловый спирт). Найдено, %: С 79,08; Н 5,69; C19H16N2О; вычислено, %: С 79,14; Н 5,59.
Спектральные характеристики соединений 2–4 приведены в табл. 1
Таблица 1
Спектральные параметры соединений 2–4
|
Соединение |
Спектр ЯМР 1Н,δ, м.д., J, Гц |
Уф-спектр |
|
|
λmax |
lg ε |
||
|
2 |
2,09 (3Н, с, С = С–СН3), 3,60 (3Н, с, ОСН3), 3,76 (3Н, с, 1–СН3), 4,76 (1Н, с, = СН), 6,50 (1Н, с, Н–3), 6,95 (1Н, д, J56 = 8, H–5), 7,18 (1Н, т, J567 = 8, м-H Н–6), 7,35 (1Н, д, J67 = 8, H–7), 7,44 (2Н, т, J = 8, п-H 2–Ph), 7,52 (2Н, т, J = 8, м-H 2–Ph), 7,63 (2Н, д, J = 8, о-H 2–Ph), 10,71 (1Н, с, 4–NН) |
205 241 292 |
4,39 4,32 4,26 |
|
3 |
1,00 (3Н, т, J = 8, COOCH2CH3), 1,24 (3Н, т, J = 8, С = С–COOCH2CH3), 3,77 (3Н, с, 1–СН3), 4,08 (2Н, к, J = 8, COOCH2CH3), 4,16 (2Н, к, J = 8, С = С–COOCH2CH3), 5,29 (1Н, с, = СН), 6,53 (1Н, д, J56 = 8, H–5), 6,57 (1Н, с, H–3), 7,14 (1Н, т, J567 = 8, Н–6), 7,29 (1Н, д, J67 = 8, H–7),7,47 (1Н, т, J = 8, п-H 2–Ph),7,54 (2Н, т, J = 8, м-H 2–Ph), 7,63 (2Н, д, J = 8, о-H 2–Ph), 9,94 (1Н, с, 4–NH) |
209 230 (плечо) 301 |
4,38 4,34 4,12 |
|
4 |
2,40 (3Н, с, 2–СН3), 3,82 (3Н, с, 7–СН3), 5,93 (1Н, с, Н–3), 7,28 (1Н, с, Н–9), 7,43–7,48 (2Н, м, Н–6, п-H8–Ph), 7,55 (2Н, т, J = 8, м-H8–Ph), 7,63 (2Н, д, J = 8, о-H8–Ph,), 7,85 (1Н, д, J56 = 8, Н–5), 11,40 (1Н, с, Н–1) |
206 265 328 |
4,44 4,53 4,15 |
Результаты исследования и их обсуждение
Продолжая исследования в области аминоиндолов, синтонов при получении трициклических гетероциклов пирролохинолинов, нами изучены реакции 4-амино-1-метил-2-фенилиндола (1) с β-кетоэфирами (метиловый эфир ацетоуксусной кислоты, диэтиловый эфир щавелевоуксусной кислоты). При этом установлено, что первичное взаимодействие выше названного аминоиндола 1 и кетоэфиров в кипящем абсолютном бензоле со следами безводной уксусной кислоты осуществляется за счет аминогруппы индола и карбонильной функции кетоэфира. В результате нами выделены соответствующие енамины 2, 3.
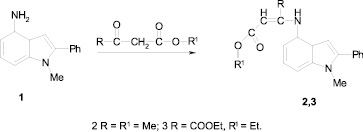
В спектре ЯМР 1Н соединения 2 (табл. 1) проявляются синглетные сигналы протонов = С–СН3, 1–СН3, метоксильной группы (ОСН3), = СНвин, ароматического водорода Н–3, 4–NH, а также 2-фенильной группы (два триплета и дублет), два сигнала в виде дублетов Н–5, Н–7 и триплет Н–6 с J = 8 Гц бензольных протонов. На основании приведенных данных, а именно наличие в спектре сигналов = СНвин и 4–NН и величин их химических сдвигов можно утверждать об тонкой Z-енаминной структуре соединения 2.
Наличие синглетов = СНвин и 4–NH в спектре ЯМР 1Н в ДМСО-d6 для соединения 3 доказывает также ее енаминную структуру. Два триплета и два квадруплета протонов это ксикарбонильных групп в обсуждаемом спектре свидетельствуют о реализации конденсации аминоиндола 1 за счет кетонной группы щавелевоуксусного эфира с образованием енамина 3. Сходство в строении енаминов 2,3 подтверждают и УФ-спектры данных соединений, которые согласуются с спектрами, полученными нами ранее, для подобных индолиленаминов [2, 4].
Оценивая реакционную способность изученного амина 1 на первичной стадии взаимодействия с дикарбонильной компонентой, следует отметить относительную инертность 4-аминоиндола по сравнению с 6-аминоиндолами. И если конденсация последних в реакции с β-ктоэфирами (щавелевоуксусным эфиром, метиловым и этиловыми эфирами щавелевоуксусной кислоты) протекает в течение 16–22 ч [2], то для окончания этой же реакции в тех же условиях в случае 4-аминоиндола 1 требует временной интервал в течение 33–40 часов.
Совершенно неожиданным оказалось поведение полученных енаминов 2, 3 в условиях термической циклизации. В то время как соединение 2 при кипячении в дифениле (280 °С) циклизуется с участием С(5) индола и углерода сложноэфирной группы, превращаясь в пирролохинолин 4, то енамин 3 даже при длительном нагревании в кипящем дифениле не дает даже следов продукта циклизации.
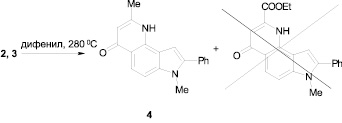
Об образовании пирролохинолина 4 свидетельствуют спектральные данные ЯМР 1Н (наличие в спектрах одиночных сигналов протонов двух метильных групп, Н–3, Н–9, Н–1, а также двух дублетов Н–5, Н–6 и сигналов 8–Ph). Величина химического сдвига Н–3 согласно литературным данным [3] и расчетным спектрам свидетельствует об хинолоновой структуре соединения 4.
В случае енамина 3 из реакционной смеси выделяется исходное соединение.
Возможную термическую циклизацию молекул структур I, II (рис. 1) можно рассматривать как электрофильную атаку атома С(3) на атом С(2), не исключая атаку на атом С(1). Реакция циклизации должна протекать под зарядовым контролем и определяется величинами эффективных зарядов на взаимодействующих атомах.
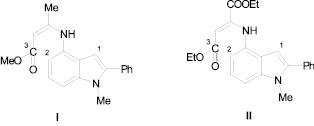
Рис. 1
В табл. 2 приведены результаты расчета эффективных зарядов (в ат. ед.) на отдельных атомах молекул структур I, II.
Таблица 2
Значения величин эффективных зарядов (в ат. ед.) на отдельных атомах структур I, II
|
Номер структуры |
Номера атомов углерода |
||
|
1 |
2 |
3 |
|
|
I |
–0,159 |
–0,158 |
0,425 |
|
II |
– ,160 |
–0,125 |
0,335 |
Как видно из данных табл. 3 молекула структуры I, имея на атоме С(2) больший по величине отрицательный эффективный заряд по сравнению с атомом С(1), а также достаточный для электрофильной атаки эффективный положительный заряд на атоме С(3), превращается в пирролохинолиновую систему. В структуре же II эффективный положительный заряд на атоме С(3) на 0,09 ат. ед. меньше, что, по-видимому, недостаточно для электрофильного замыкания как пиридинового, так и азепинового цикла.
Подобное сообщалось ранее нами при изучении поведения 4-амино-1-метил-2-фенилиндола с ацетилацетоном в условиях реакции Комба [1]. При этом было обнаружено, что термолиз первичного продукта реакции – енаминокетона приводит к осмолению. То же самое наблюдается при обработке енамина, полученного из ацетилацетона кислотными агентами. Для объяснения такого невозможности протекания реакции циклообразования нами проведены квантово-химические расчеты молекул енаминкетона и его протонированных форм III–V (рис. 2).
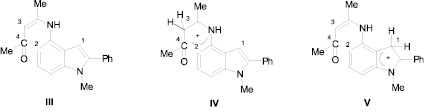
Рис. 2
Результаты расчета эффективных зарядов (в ат. ед.) на отдельных атомах структур III–V приведены в табл. 3.
Как видно из табл. 2, для структуры III положительный заряд на карбонильном атоме углерода на 0,08 ат. ед. меньше, чем на сложноэфирной группе структуры I, рассмотренной на рис. 1, что, по-видимому, исключает возможность термической циклизации. В возможных монопротонированных структурах IV, V резко уменьшается электронная плотность на С(2) атоме. При этом заряд на С(4) практически не изменяется. Полученные данные объясняют невозможность реакции циклизации, что согласуется с литературными данными [5].
Таблица 3
Значения эффективных зарядов на отдельных атомах (в ат. ед.) для структур III–V
|
Тип структуры |
Номера атомов углерода |
|||
|
1 |
2 |
3 |
4 |
|
|
III |
–0,1453 |
–0,1664 |
–0,3917 |
0,3466 |
|
IV |
–0,2248 |
–0,0401 |
–0,1711 |
0,3092 |
|
V |
–0,0575 |
–0,0359 |
–0,2025 |
0,3367 |
Заключение
1. В ходе проведенного исследования впервые изучены реакции конденсации 4-амино-1-метил-2-фенилиндола с метиловым эфиром ацетоуксусной кислоты и щавелевоуксусным эфиром. При этом было доказано протекание реакции с участием только карбонильной группы кетоэфиров, что позволило получить енамины в Z-форме, ранее не описанные в литературе. Обнаружено неоднозначное поведение полученных енаминов в термических условиях. В то время как енамин из метилового эфира ацетоуксусной кислоты при кипячении в дифениле (280 °С) циклизуется в пирроло[2,3-h]хинолин, то енамин из щавелевоуксусного эфира даже при длительном нагревании в кипящем дифениле не дает следов продукта циклизации.
2. По результатам квантово-химических расчетов структур енаминов из 4-амино-1-метил-2-фенилиндола дано объяснение их поведению в условиях термической и кислотной циклизации.
Рецензенты:
Танасейчук Б.С., д.х.н., профессор кафедры органической химии мордовского государственного университета имени Н.П. Огарева, г. Саранск;
Бузулуков В.И., д.т.н., к.х.н., профессор кафедры физической химии Мордовского государственного университета имени Н.П. Огарева, г. Саранск.
Работа поступила в редакцию 08.11.2013.



