Крупные суставы являются важным элементом, обеспечивающим стато-локомоторную функцию организма, поэтому нарушение их стабильности неизбежно приводит к нарушению функционирования всего опорно-двигательного аппарата. Коленный сустав, в связи с анатомическими и биомеханическими особенностями, является одним из ключевых и в то же время наиболее уязвимым суставом в человеческом организме. Чаще всего встречаются повреждения передней крестообразной связки, которые по результатам исследований ряда авторов [3], далеко не во всех случаях приводят к развитию нестабильности коленного сустава, особенно при парциальных повреждениях. Причины сохранения стабильности связаны с различной степенью функциональной нагрузки на сустав и зависят от состояния динамических стабилизаторов, прежде всего от силы и тонуса окружающих мышц. В связи с широким внедрением в практику артроскопии и ее высокой диагностической информативностью в отношении повреждений ПКС прослеживается тенденция к недооценке дополнительных неинвазивных методов обследования [4]. Нередко это приводит к гипердиагностике разрывов ПКС, а при обнаруженных частичных повреждениях – к резекции фрагментов связки с ее последующим тотальным замещением [2]. Зачастую, показания к протезированию ПКС устанавливаются без учёта возможной компенсации нестабильности и степени адаптации пациента. Отсутствие дифференцированного подхода к лечению данной категории пациентов определяет высокий процент неудовлетворительных результатов [1]. В процессе лечения и обследования больных с передней нестабильностью коленного сустава мы столкнулись с рядом проблем, требующих аргументированного решения. В частности с отсутствием чётких алгоритмов, учитывающих все доступные методы диагностики с индивидуальным функциональным акцентом. Актуальным остается вопрос рационального выбора материалов при протезировании передней крестообразной связки. На наш взгляд, обоснование алгоритмов диагностики и оперативного лечения с индивидуальным подбором имплантата при повреждениях ПКС с учетом степени нестабильности коленного сустава позволит повысить качество обследования данной категории пациентов и улучшить результаты лечения.
Цель исследования: обоснование алгоритмов диагностики и оперативного лечения при повреждениях ПКС с учетом степени нестабильности коленного сустава.
Материал и методы исследования
Работа основана на изучении результатов обследования и лечения 206 пациентов с передней нестабильностью коленного сустава. Из них – 133 пациента представлено мужчинами и 73 – женщинами. Средний возраст пациентов составил 37 ± 12,1 года. Всем пациентам проводилось клиническое обследование, включающее оценку по 100-бальной шкале хирургии крестообразных связок коленного сустава J. Lysholm и J. Gillguist. Оценивались клинические симптомы Лахмана, «выдвижного ящика», Мироновой [3, 8]. Всем пациентам проводилось рентгенологическое исследование коленного сустава в стандартных проекциях на аппарате Italrey «PIXEL HF» (Италия) с фокусным расстоянием 1 м. 29 пациентам дополнительно проведено 41 функциональное рентгенологическое исследование коленного сустава. Исследуемая конечность при функциональной рентгенографии удерживалась в положении переднего подвывиха голени при помощи специальных накладок. Смещение оценивалось на полученных рентгенограммах линейкой в мм. 43 пациентам проведено ультразвуковое исследование заинтересованного коленного сустава на аппарате ToshibaAplio с поверхностным линейным зонтом 7–12 МГц (Япония). В связи с недостаточной информативностью этой методики [3, 4], 33 пациентам произведена магнитно-резонансная томография коленного сустава на аппарате ShimadzuSMT-50X (Япония) по стандартной методике. Для выявления степени нестабильности коленного сустава и её объективной оценки нами выполнена функциональная магнитно-резонансная томография. Выполнено 30 функциональных исследований у 18 пациентов на аппарате «HELPIC RENEX» 0,25 Т открытого типа. При проведении функциональной магнитно-резонансной томографии использовались следующие импульсные последовательности – SET1 ВИ, SЕT2 ВИ, а также программа жироподавления (STIR ВИ). Обследование коленных суставов проводилось в угловой плоскости сканирования, с наклоном 5–10 градусов от сагиттальной плоскости в сторону парасагиттальной, с применением теста Лахмана. Вычисления проводились с помощью электронной программы и измерялись в мм [6]. 204 пациентам произведена диагностическая санационная артроскопия сустава. Операция выполнялась на оборудовании «Rudolf», Германия, с использованием оптики 30º, диаметром артроскопа 4,5 мм из стандартных – нижне-латерального и нижне-медиального доступов. Санация сустава включала в себя манипуляции на повреждённых менисках (частичные резекции, швы менисков), иссечение культей полностью или частично разорванных крестообразных связок с обязательной интраоперационной оценкой передней нестабильности коленного сустава с применением теста Лахмана. Для измерения использовался диагностический щуп с градуировкой в мм, с помощью которого измерялась величина нестабильности [5]. При выявлении показаний к оперативному восстановлению передней крестообразной связки, в соответствии с представленными ниже алгоритмами, нами выполнялось протезирование связки с применением артроскопической техники. Всего выполнено 62 артроскопические операции по восстановлению передней крестообразной связки коленного сустава. 33 операции произведено по технологии «ВТВ». Для этого применялся инструмент «Chm» (Польша) и фиксаторы – интерферентные винты из сплава титана с круглой резьбой, либо биодеградируемые винты из полимолочной кислоты. 29 пациентам передняя крестообразная связка восстанавливалась с применением синтетического протеза фирмы «Остеомед», который фиксировался титановыми интерферентными винтами. После операции всем пациентам повторно проводили клиническую оценку нестабильности по шкале J. Lysholm и J. Gillguist и выполняли функциональную магнитно-резонансную томографию по разработанной методике.
Результаты исследования и их обсуждение
На этапе первичного обращения больного с жалобами на переднюю нестабильность коленного сустава, мы применяем разработанный нами лечебно-диагностический алгоритм (рис. 1).
При выявлении у пациента жалоб на неустойчивость в коленном суставе нами проводится рентгенография коленных суставов в 2-х проекциях для выявления изменений костного скелета. Далее заинтересованный сустав исследуется на магнитно-резонансном томографе. По данным исследования пациенты с полным разрывом крестообразной связки планируются на оперативное лечение. Остальные пациенты делятся на 2 группы. Первая группа с выявленными явлениями парциального повреждения передней крестообразной связки и вторая группа с отсутствием патологии связки при исследовании. Обследование первой группы продолжается на установке МРТ открытого контура, который позволяет в процессе сканирования коленного сустава проводить тест Лахмана, т.е. удерживать голень в состоянии напряжения кпереди – функциональное МРТ. Где оценивается смещение голени по отношении к бедру кпереди в мм. Одновременно с этим мы получаем информацию о морфологической структуре передней крестообразной связки и других компонентов коленного сустава в состоянии напряжения. Это позволяет выделить пациентов с компенсированными явлениями нестабильности (смещение менее 10 мм), им будет предложен курс восстановительного лечения – ЛФК, электростимуляция и т.д. Пациентам с некомпенсированной формой нестабильности предлагается оперативное лечение [3]. Второй группе пациентов, с отсутствием повреждений ПКС при МРТ исследовании, проводится функциональная рентгенография обоих коленных суставов. Если при исследовании выявляется асимметрия, то им проводится функциональная МРТ, если нет, то пациенты направляются на курс ЛФК.
При выборе тактики оперативного лечения больных с передней нестабильностью коленного сустава нами использован разработанный алгоритм оперативного лечения больных с передней нестабильностью коленного сустава (рис. 2).
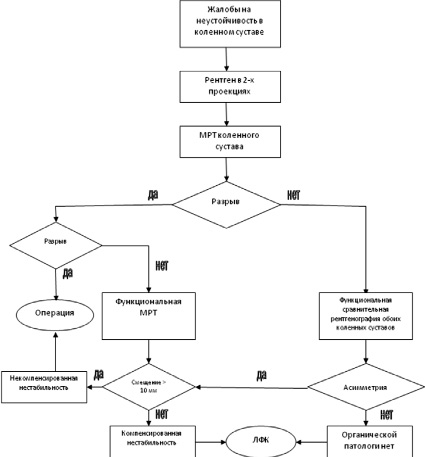
Рис. 1. Лечебно-диагностический алгоритм при передней нестабильности коленного сустава с использованием функционального магнитно-резонансного исследования
При выборе материала для связки, прежде всего, учитываются свойства различных материалов. Поскольку синтетическая связка более прочная, но менее эластичная, т.е. при выраженной нестабильности может появляться разрушение костных каналов материалом связки с рецидивом явлений нестабильности. Но в то же время, технология не требует забора собственных тканей, что уменьшает травматизацию конечности, снижает время оперативного вмешательства в условиях ишемии, а так же сокращает сроки реабилитации [2]. Поэтому данную методику мы использовали у пациентов без выраженных явлений нестабильности (до 10 мм). Синтетическая связка хорошо стабилизирует сустав, не оказывая при этом чрезмерные нагрузки на костные каналы. В остальных случаях при нестабильности более 10 мм, когда стабилизация сустава связана с повышенными нагрузками на трансплантат, мы производим пластику связки из собственных тканей по технологии BTBили ST, в зависимости от качества участка тканей, используемых для забора. Связки из собственных тканей обладают наиболее физиологичными прочностными и эластическими свойствами, но требуют затраты времени для забора трансплантата и перестройки его в процессе реабилитации до 12 и более месяцев [2, 3].
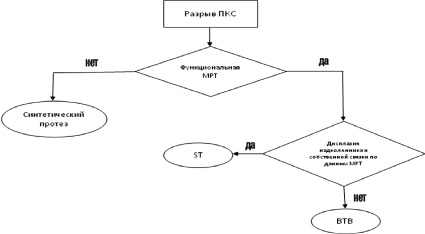
Рис. 2. Алгоритм оперативного лечения больных с передней нестабильностью коленного сустава
С применением разработанных алгоритмов нами обследовано и пролечено 206 пациентов. Шестидесяти двум из них проведено оперативное вмешательство с установкой синтетического протеза связки в 29 случаях, в тридцати трёх – установлен трансплантат из собственных тканей. У 147 пациентов был выявлен частичный разрыв передней крестообразной связки, а у 42 – полный. У 17 пациентов структурных изменений связки не выявлено. Все прошли курс восстановительного лечения.
При обращении и через 6 месяцев состояние пациентов, прошедших консервативное лечение, оценивалось по шкале хирургии крестообразных связок коленного сустава J. Lysholm и J. Gillguist. Результаты отражены в табл. 1.
Таблица 1
Результаты консервативного лечения пациентов с передней нестабильностью коленного сустава
|
Первичный осмотр (n = 24) |
Через 6 месяцев консервативного лечения (n = 20) |
|
|
Отлично |
7,7 % |
50 % |
|
Хорошо |
10,3 % |
33,3 % |
|
Удовлетворительно |
20,5 % |
8,3 % |
|
Неудовлетворительно |
61,5 % |
8,4 % |
Результаты лечения пациентов, которым произведено оперативное восстановление передней крестообразной связки в соответствии с разработанным алгоритмом, также оценивались по шкале J. Lysholm и J. Gillguist в динамике в зависимости от выбранного имплантата. Результаты отражены в табл. 2 и 3.
Таблица 2
Результаты оперативного восстановления передней крестообразной связки синтетическим протезом
|
До операции, (n = 29) |
6 месяцев, (n = 29) |
12 месяцев, (n = 22) |
|
|
Отлично |
6,9 % |
75,9 % |
91 % |
|
Хорошо |
10,3 % |
20,7 % |
4,5 % |
|
Удовлетворительно |
20,7 % |
0 % |
0 % |
|
Неудовлетворительно |
62,1 % |
3,4 % |
4,5 % |
Таблица 3
Результаты оперативного восстановления передней крестообразной связки протезом из собственных тканей
|
До операции, (n = 26) |
6 месяцев, (n = 26) |
12 месяцев, (n = 26) |
|
|
Отлично |
11,5 % |
73,1 % |
96,2 % |
|
Хорошо |
19,2 % |
19,2 % |
3,8 % |
|
Удовлетворительно |
23,1 % |
7,7 % |
0 % |
|
Неудовлетворительно |
53,8 % |
0 % |
0 % |
Выводы
Применение разработанного лечебно-диагностического алгоритма при передней нестабильности коленного сустава, включающего использование клинических тестов и дополнительных функциональных исследований, позволяет сократить количество диагностических ошибок и улучшить результаты консервативного и оперативного лечения при передней нестабильности коленного сустава.
Дифференцированный подход к выбору имплантатов для протезирования передней крестообразной связки, с учётом их положительных и отрицательных свойств, позволяет восстановить стабильность коленного сустава и минимизировать возможные рецидивы и осложнения.
Рецензенты:
Сергеев К.С., д.м.н., профессор, заведующий кафедрой травматологии, ортопедии, ВПХ ГБОУ ВПО «Тюменская государственная медицинская академия» Министерства здравоохранения РФ, г. Тюмень;
Атманский И.А., д.м.н., профессор, заведующий кафедрой травматологии и ортопедии, ГБОУ ВПО «Челябинская государственная медицинская академия» Министерства здравоохранения РФ, г. Челябинск.
Работа поступила в редакцию 17.10.2013.



