Проблема получения эффективной противогриппозной вакцины остается актуальной. Существующие субъединичные и расщепленные вакцины в качестве основных иммуногенных агентов используют поверхностные белки вируса гриппа, нейраминидазу и гемагглютинин. Однако высокая изменчивость этих белков, сопровождающаяся изменением антигенной специфичности, не позволяет обеспечить защиту от всех штаммов вируса гриппа, что требует постоянного мониторинга циркулирующих вирусов и корректировки набора штаммов, входящих в вакцину [9]. Необходимость ежегодного создания новой вакцины сопряжена с большими организационными и экономическими затратами.
Альтернативой традиционным вакцинам, использующим ослабленные вирусы или их компоненты, являются рекомбинантные вакцины, основанные на отдельных вирусных белках, которые могут быть получены в стандартных организмах-продуцентах, например в бактериях или дрожжах. Такой подход позволяет, с одной стороны, подготовить вакцину очень быстро, и/или, с другой стороны, создавать вакцины, способные защищать от большого числа вирусных штаммов в случае использования консервативных белков вируса [2].
Одним из перспективных кандидатов при создании «универсальной» противогриппозной вакцины является трансмембранный М2 белок вируса гриппа, последовательность внешнего домена (М2е) которого из 23 аминокислотных остатков высоко консервативна у большинства штаммов вируса гриппа человека и отличается лишь по нескольким аминокислотам у штаммов вирусов гриппа, выделенных от животных [4]. Основной проблемой при использовании М2е является его слабая иммуногенность, что требует присоединения М2е к носителю, способному усилить его антигенные свойства. С разной степенью успеха в качестве носителей М2е пептида были использованы вирусоподобные частицы на основе папилломавируса человека, бактериофага Qβ, вируса мозаики папайи и вируса мозаики коровьего гороха [4]. Наиболее широко и успешно в качестве высокоиммуногенного носителя эпитопов используется ядерный антиген вируса гепатита В (HBc), способный к самосборке в симметричные вирусоподобные частицы [6]. Включение чужеродных последовательностей в состав HBc с помощью генетического «сшивания» (т.е. создания гена, кодирующего химерный белок) может происходить в трех позициях. Это N- и С-концы, а также область иммунодоминантной петли, расположенная между 75 и 85 аминокислотными остатками НВс.
Примером успешного применения НВс антигена в качестве носителя М2е является получение гибридных белков с вставкой М2е в N-концевую область HBс антигена. Такие белки, экспрессированные в бактериях Escherichia coli, собирались в вирусоподобные частицы, которые обладали высокой иммуногенностью и обеспечивали защиту мышей против летального заражения вирусом гриппа [1; 3; 5]. Наиболее выгодным для обеспечения иммуногенности целевого пептида является его включение в область иммунодоминантной петли, позволяющее не только придать ему максимальную иммуногенность, но и снизить иммунный ответ против белка-носителя. Однако включение в район иммунодоминантной петли НВс антигена чужеродных последовательностей часто нарушает фолдинг химерного белка [6], поэтому такая задача не является тривиальной. Ранее были описаны рекомбинантные НВс белки, содержащие в районе иммунодоминантной петли вставку только одной копии М2е пептида вируса гриппа человека. Однако известно, что увеличение числа копий М2е пептида на N-конце HBc значительно усиливает иммунный ответ.
Цель исследования: получить гибридные НВс белки, содержащие вставку одной или двух копий М2е пептида высокопатогенного вируса гриппа птиц A/Chicken/Kurgan/05/2005 (H5N1) в районе иммунодоминантной петли.
Материалы и методы исследования
Для получения генетических конструкций и проведения ПЦР использовали следующие синтетические олигонуклеотиды: M2ek-ssF (GATCCAGCCTGCTGACCGAAGTGGAAAC CCCGACCCGTAACGAATGGGAAA GCCGTAGCAGCGATAGCAGCGATGGGCC), M2ek-ssR (CATCGCTGCTATCGCTGCTACGGCTTTCCCATTCGTTACGGGTCGGGGTTTCCACT TCGGTCAGCAGGCTG), F M2e (BamHI, Ecl136II) (ATGGATCCATCATCGAGCTCAGCCTG CTGA), R M2e (ApaI, EcoRV) (ACTACTGGGCCCCATCATGATATCCTAGCTGCTCTA), F1Gly19 (BamHI, Ecl136II) (GATC CGGCACCAGTGGCAGTAGCGGTAGTGGCAGTGGT GGCAGCGGCAGTGGTGGCGGTGGCGAG), R1Gly19 (BamHI, Ecl136II) (CTCGCCACCGC CACCACTGCCGCTGCCACCACTGCCACTACCGCTACTGCCACTGGTGCCG), F2Gly19 (АpaI, EcoRV) (ATCGGCACCAGTGGCAGTAGCGGTAGTGGCAGTGGTGGCAGCGGCAG TGGTGGCGGTGGCGGGCC), R2Gly19 (АpaI, EcoRV) (CGCCACCGCCACCACTGCCGCT GCCACCACTGCCACTACCGCTACTGC CACTGGTGCCGAT).
Все манипуляции с ДНК – клонирование последовательностей в плазмидные вектора, ПЦР-амплификация, рестрикция, лигирование, секвенирование, и т.п. – проводили согласно общепринятым методикам [8].
В качестве основы для создания рекомбинантных векторов экспрессии использовали вектор pQE60 (Qiagen). Для получения штаммов E. coli-продуцентов рекомбинантных белков соответствующие векторы вводили в клетки E. coli штамма DLT1270 с помощью трансформации. Бактерии выращивали в LB бульоне или чашках с LB агаром при 37 °С с добавлением в случае необходимости в качестве селективного маркера ампициллина (100 мкг/мл). Для экспрессии рекомбинантных белков в клетках E. coli ночную культуру штамма-продуцента засевали в LB бульон в разведении (1:100) и выращивали при 37 °С на качалке до достижения оптической плотности раствора OD600 = 0,5–0,6. Затем для индукции синтеза рекомбинантных белков в культуру вносили изопропил-β-D-1-тиогалактопиранозид (ИПТГ) до конечной концентрации 1мМ и продолжали культивировать при 28°С в течение 16 часов. Определение уровня экспрессии белков проводили с помощью SDS-PAGE суммарных белковых препаратов, выделенных из бактериальных культур.
Для определения растворимости целевого белка после индукции клетки штамма-продуцента осаждали с помощью центрифугирования (3000 g, 30 мин). Осадок ресуспендировали в буфере, содержащем 0,1 М NaCl, 10 мМ Tris-HCl (pH 8,0), 1 мМ ЭДТА из расчета 1 мл буфера на 50 мл культуральной жидкости. Клеточную суспензию обрабатывали лизоцимом (1 мг/мл) в течение 30 мин при 4 °С. Затем проводили центрифугирование в течение 10 мин при 13000 об/мин, отбирали супернатант и анализировали его состав с помощью SDS-PAGE.
Результаты исследования и их обсуждение
Ранее в нашей лаборатории был получен искусственный ген модифицированного HBc антигена со встроенными в район иммунодоминантной петли сайтами рестрикции BamHI и ApaI, клонированный в экспрессионном векторе pQE60. Этот вектор, pQE60HBc, использовали в качестве основы для получения и клонирования химерных генов.
На первом этапе была получена искусственная последовательность ДНК, кодирующая М2е пептид вируса гриппа птиц A/Chicken/Kurgan/05/2005 (M2ek). Для предотвращения хаотичного образования дисульфидных связей и, как следствие, агрегации белков, цистеины в позициях 11 и 13 последовательности М2е пептида были заменены серинами. Двухцепочечный фрагмент ДНК, кодирующий M2ek и фланкированный сайтами рестрикции BamHI и ApaI, был получен в результате отжига олигонуклеотидов M2ek-ssF и M2ek-ssR. Этот фрагмент клонировали по сайтам BamHI и ApaI в pQE60HBc, в результате чего был создан вектор pQE60 HBc/M2ek(C-S), позволяющий экспрессировать рекомбинантный белок HBc/M2е, включающий последовательность НВc со встроенной в область иммунодоминантной петли по сайтам BamHI и ApaI последовательностью М2еk пептида (рис. 1). Однако синтезируемый в клетках E. coli рекомбинантный белок оказался нерастворим, что не позволяло получить вирусоподобные НВс частицы – носители М2е.
Мы предположили, что возможной причиной этого является нарушение фолдинга гибридного белка вследствие включения М2е. В ряде работ показано, что для обеспечения гибкости структуры и, как следствие, правильного фолдинга белка можно использовать глицин-богатые линкерные последовательности [7]. Поэтому следующим этапом работы стало встраивание в точки стыков последовательностей НВс и М2еk дополнительных «гибких» линкеров длиной 19 аминокислотных остатков (GTSGSSGSGSGGSGSGGGG).
Для решения этой задачи на первом этапе в HBc/M2е были введены дополнительные сайты рестрикции Ecl136II и EcoRV. Фрагмент M2ek получали с помощью ПЦР с праймерами F M2e (BamHI, Ecl136II) и R M2e (ApaI, EcoRV), 5’-участки которых дополнительно содержали эти сайты. Полученный ПЦР фрагмент был клонирован в pQE60HBc по сайтам BamHI и ApaI.
Затем в полученный вектор pQE60 HBc/M2е + Ecl136II + EcoRV (рис. 1) последовательно встраивали два глициновых линкера по сайтам BamHI и Ecl136II и сайтам EcoRV и ApaI. Двухцепочечные фрагменты ДНК, кодирующие линкеры и имеющие необходимые «липкие» концы, были получены в результате отжига олигонуклеотидов F1Gly19 (BamHI, Ecl136II) с R1Gly19 (BamHI, Ecl136II) и F2Gly19 (АpaI, EcoRV) с R2Gly19 (АpaI, EcoRV). Полученные двуцепочечные фрагменты были последовательно встроены в вектор pQE60 HBc/M2е + Ecl136II + EcoRV по соответствующим сайтам. Таким образом, был получен вектор pQE60 HBc/M2ek (рис. 1), содержащий ген химерного белка HBc с встроенной в район иммунодоминантной петли одной копией последовательности М2еk пептида, фланкированной глициновыми линкерами. Отсутствие ошибок при генно-инженерных операциях было подтверждено результатами секвенирования.
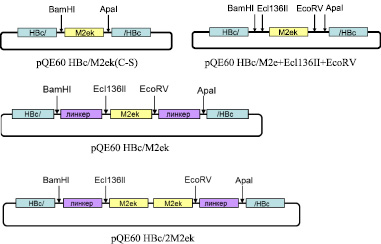
Рис. 1. Структуры рекомбинантных векторов экспрессии
Следующим этапом нашей работы было получение аналогичной конструкции с двумя копиями M2e пептида в иммунодоминантной петле НВс антигена (см. рис. 1).
Для этого вектор pQE60 HBc/M2ek обрабатывали Ecl136II и EcoRV (образуют тупые концы), получив, таким образом, фрагмент M2ek, который затем клонировали в тот же вектор по сайту EcoRV. При прямой ориентации вставки восстанавливался правый сайт EcoRV (см. рис. 1). Таким образом, были получены искусственный ген и вектор pQE60HBc/2M2ek, позволяющий экспрессировать рекомбинантный белок HBc/2M2ek с двумя копиями M2ek пептида в иммунодоминантной петле НВс антигена.
Для получения штаммов-продуцентов рекомбинантных белков HBc/M2ek и HBc/2M2ek соответствующие экспрессионные векторы на основе pQE60 вводили в клетки E. coli штамма DLT1270. Индукцию экспрессии рекомбинантных белков осуществляли путем инактивации LacI репрессора при добавлении ИПТГ и, тем самым, активации промотора в pQE60. Уровень синтеза целевых белков оценивали с помощью денатурирующего электрофореза в полиакриламидном геле (рис. 2, а). Для обоих белков он составлял 10–15 % общего белка штамма-продуцента.
 б -
б -

Рис. 2. Экспрессия рекомбинантных белков HBc/M2ek и HBc/2M2ek в штаммах-продуцентах (а) и распределение гибридных белков между растворимой и нерастворимой фракциями клеточного лизата (б): а – 1 – маркер молекулярного веса; 2 – белковый препарат из неиндуцированной культуры; 3 – белковый препарат из культуры DLT1270 pQE60 HBc/M2ek после индукции; 4 – белковый препарат из культуры DLT1270 pQE60 HBc/2M2ek после индукции; б – 1 – маркер молекулярного веса; 2 – препарат растворимой фракции из культуры DLT1270 pQE60 HBc/M2ek; 3 – препарат нерастворимой фракции из культуры DLT1270 pQE60 HBc/M2ek; 4 – препарат растворимой фракции из культуры DLT1270 pQE60 HBc/2M2ek; 5 – препарат нерастворимой фракции из культуры DLT1270 pQE60 HBc/2M2ek
Поскольку предполагается, что модифицированный HBc будет формировать вирусоподобные частицы in vivo, а обработка ультразвуком может их разрушить, лизис клеток после индукции проводили путем обработки лизоцимом с последующим замораживанием-оттаиванием клеточной суспензии. Оба варианта рекомбинантных белков большей частью находились в растворимой фракции клеточного лизата (рис. 2, б).
Выводы
Созданы искусственные гены и рекомбинантные векторы экспрессии, позволяющие получать в клетках E. coli гибридные белки, содержащие одну или две копии M2ek пептида вируса гриппа птиц A/Chicken/Kurgan/05/2005 (H5N1) в иммунодоминантной петле НВс антигена. Введение глицин-богатых линкерных последовательностей в точки «стыка» последовательностей М2е и НВс антигена обеспечило необходимую гибкость химерной последовательности и фолдинг гибридного белка, позволившие получить его в растворимой форме. Полученные гибридные белки, в случае образования ими вирусоподобных частиц, могут стать основой для создания новой рекомбинантной противогриппозной вакцины.
Работа была выполнена при финансовой поддержке Министерства образования и науки РФ (ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009 – 2013 годы, соглашение № 14.132.21.1769).
Рецензенты:
Равин Н.В., д.б.н., зам. директора по научной работе, ФГБУН Центра «Биоинженерия» Российской академии наук, г. Москва;
Игнатов А.Н., д.б.н., зав. лабораторией, ФГБУН Центра «Биоинженерия» Российской академии наук, г. Москва.
Работа поступила в редакцию 09.10.2013.



