Гистохимический анализ и ультраструктурное исследование образцов древних костной ткани на сегодняшний день является одним из важных этапов подготовки к последующему молекулярно-генетическому анализу, поскольку позволяет выявить образцы, показавшие хорошую гистологическую сохранность и положительные гистохимические тесты на наличие эндогенной ДНК [8, 6]. Кроме определения микроструктуры палеонтологических образцов, оценки степени их сохранности, немаловажным является и выявление экзогенных источников нуклеиновых кислот (ДНК микроорганизмов, грибов, современного человека), что позволяет исключить такие образцы из дальнейшего анализа [8].
Ранее методом трансмиссионной и поляризационной световой микроскопии рядом авторов охарактеризована гистологическая микроструктура образцов древней костной ткани как человека, так и животных, которая в ряде случаев воспроизводила микроструктуру современной костной ткани, но большинство объектов характеризовалось крайне плохой степенью сохранности (отсутствие остеонов и их фрагментов) [6]. При этом отмечается, что существует определённая корреляционная зависимость между степенью сохранности костной ткани и эффективностью дальнейшего молекулярно-генетического исследования [8, 14, 6].
Однако предполагается, что основным показателем успешности амплификации ДНК является не столько наличие микроструктуры, сколько вероятность контаминации древних образцов экзогенной ДНК, которые могут конкурировать с эндогенными молекулами ДНК в ходе проведения ПЦР [5]. Таким образом, необходимо оценивать не столько гистологическую микроструктуру древних образцов костной ткани, сколько наличие в образцах именно эндогенной ДНК, что на сегодняшний день позволяет проводить метод конфокальной микроскопии с использованием специфических красителей.
На сегодняшний день разработаны методики окрашивания нуклеиновых кислот при проведении конфокальной микроскопии срезов современной кости, однако для современной костной ткани и древней требуются разные методики подготовки срезов в силу их различного физического состояния. Свежая костная ткань сложна для анализа с той точки зрения, что срез должен быть доступен для просвечивания лучом и поэтому должен быть декальцинирован, в то время как в древней кости кислотная декальцинация может вызвать гидролиз и без того деградированной ДНК, которая, возможно, присутствовует в образцах [13]. По этой же причине затруднительно прямое сравнение результатов, полученных при исследовании, о чём следует помнить, когда современная кость используется в качестве контроля.
Исходя из всего вышеупомянутого, возникла потребность в простой и быстрой методике подготовки древней костной ткани для ультраструктурной и гистохимической характеристики образцов костной ткани человека из древних захоронений.
Материалы и методы исследования
В качестве объектов исследования служили образцы древней костной ткани человека, датируемые IX–XIV вв., обнаруженные в ходе археологических экспедиций на территории Среднего Поволжья: седалищная кость таза (XIII–XIV вв.), теменная кость черепа (IX–X вв.), ребро (XI–XII вв.), бедренная кость (XIV в.), лучевая кость (XIV в.), нижнечелюстная кость (XIV в.). Перед подготовкой к микроскопии все кости были тщательно промыты дистиллированной водой, высушены и подвергнуты обработке ультрафиолетовым светом в течение 15 минут.
Для ультраструктурного исследования обработку ткани проводили по методике Everts et al. (2000). Срезы костной ткани толщиной 1–2 мм фиксировали в 4 % параформальдегиде и 1 % глутаровом альдегиде на 0,1 М какодилатном буфере (0,2 М какодилат натрия, 0,07 М NaOH, pH 7.4) при комнатной температуре в течение 4 часов, затем оставляли на ночь в свежей смене фиксатора. Продолжая фиксацию, срезы переносили в декальцинирующий раствор, состоящий из 1,9 % глутарового альдегида и 0.15М ЭДТА в 0,06 М какодилатном буфере. Ткань декальцинировалась в процессе фиксации в течение 14 дней при 4 °C. Через каждые 5 дней проводили смену фиксатора на свежую порцию. После отмывки в том же буфере в течение 12 часов образцы переносили в фиксирующий раствор 1 % OsO4 на 0,075 M какодилатном буфере с последующей отмывкой в 0,1 М какодилатном буфере в течение 4 часов. Обезвоживание образцов проводили в градиенте этанола (от 70 до 96 % с шагом в 10 %) с последующей заливкой в эпоксидную смолу [6]. Далее были получены ультратонкие срезы толщиной 80 нм (LKB 2088 UltrotomeV, Швеция), контрастирование срезов проводили «методом капли» Everts et al. (2000) в 3,5 % раствором уранил ацетата и цитратом свинца. Срезы просматривали на трансмиссионном электронном микроскопе JEM-1200 EX, JEOL (Япония) при увеличении 3, 6, 8 и 15 тыс. раз.
Для гистохимического исследования использовали модифицированную методику Zheng et al. (1997). Из образцов костной ткани, предварительно нарезанной кубическими фрагментами размером 4×4×4 мм с помощью лобзика (пилка по дереву, 13 см), и замороженной при –23 °С, готовили криосрезы толщиной 100 мкм (Microm HM 550 Thermo scientific, США), после чего фиксировали в 70 % этаноле в течение 30 минут. Далее проводили окраску полученных препаратов 1 % раствором акридинового оранжевого в 100 мМ ацетатном буфере (рН 4,2) в течение 30 минут с последующей 4-кратной отмывкой ацетатным буфером, затем подготовленные срезы помещали в водно-глицериновую смесь (1:1) под покровное стекло. Анализ срезов проводили на конфокальном микроскопе LSM-510 Meta Carl Zeiss (Германия) с объективом LD Plan-Neofluar 40x/0.6 Korr с фильтрами BP 505-530 при возбуждающем луче лазера 488 нм.
Результаты исследования и их обсуждение
Ультраструктурное исследование
В ходе ультраструктурного исследования во всех образцах выявлено отсутствие клеток и органелл, независимо от возраста образца. На примере образца седалищной кости таза была показана целостность ультраструктуры, естественная пористость костной ткани, богатый коллагеновый матрикс, регулярное повторение главного структурного периода которого на протяжении фибрилл можно видеть благодаря характерной продольной «полосатости» (рис. 1). Кристаллы гидроксиапатита выявлены не были ввиду хорошей декальцинации.

Рис. 1. Электронная микрофотография срезов костной ткани, ув. 3000х
При исследовании теменной кости черепа местами была обнаружена повреждённая надкостница (рис. 2, а). Основное вещество кости также демонстрирует обильную пористость (рис. 2, б), что, возможно, связано с «высыханием» кости, потерей плотности в процессе диагенеза. Посторонних включений экзогенного происхождения выявлено не было ни в одном из образцов.
а 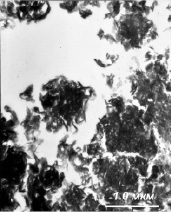 б
б 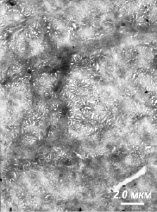
Рис. 2. Электронная микрофотография срезов костной ткани теменной кости черепа: а – ув. 8000х; б – 6000х
На следующем этапе проводили выявление нуклеиновых кислот в срезах методом контрастирования. Одним из наиболее распространенных методов выявления ДНК и РНК в современных образцах животного происхождения является последовательное окрашивание уранилацетатом и цитратом свинца по Рейнольдсу [2]. Уранилацетат сильно увеличивает контраст ДНК и РНК, но окрашивает также, хотя и в меньшей степени, белки, вследствие чего его считают селективным, но не специфическим красителем для нуклеиновых кислот [2]. Специфическое ДНК окрашивание другим красителем – DAPI (4’-6’-диамино-2-фенилиндол), который связывается с малой бороздой ДНК, в световой микроскопии показало слабую корреляцию с традиционным окрашиванием солями урана и свинца в ТЭМ [4].
В исследуемых образцах при стандартной методике окрашивания уранилацетатом следов эндогенной ДНК не обнаружено, так же как и не было выявлено следов экзогенной ДНК и РНК. Вероятнее всего, связано это может быть с тем, что при подготовке срезов для гистологической характеристики минерализованной костной ткани рекомендуется проводить этап декальцинации для улучшения проникновения заливочной среды в ткань и во избежание трудностей при получении срезов [7]. Однако необходимо учитывать то обстоятельство, что ДНК может адсорбироваться на гидроксиапатите [5]. В то же время при интенсивной декальцинации, по-видимому, происходят потери ДНК, связанные с высвобождением минерала кости, поэтому ультраструктурный анализ в данном случае не даёт чёткого представления о сохранности и локализации ДНК.
Гистохимическое исследование
Гистохимическое выявление ДНК в срезах древней костной ткани проводили методом конфокальной микроскопии, которая аналогична стандартной световой и/или флуоресцентной в плане разрешения. Однако вместо световой волны видимого диапазона, который проходит сквозь тонкий срез залитой ткани, в качестве источника освещения используется лазер с определённой длиной волны возбуждения, что используется для определения локализующих иммунологичеких проб или специальных красителей, которые связываются с молекулярными компонентами тканей.
При окрашивании ДНК используются флюуорохромы-интеркаляторы, такие как Хёкст (Hoescht) 33258, DAPI и хромомицин А3 (СМА). Качественный анализ не показывает различий в интенсивности флюоресценции между древней и современной костью, хотя в древней кости значительно снижено число DAPI- и СМА-позитивно окрашенных лакун остеоцитов [8]. Мы в своей работе использовали другой специфичный для нуклеиновых кислот краситель – акридиновый оранжевый, молекулы которого по-разному взаимодействуют с однонитевыми и двунитевыми молекулами РНК и ДНК: под действием ультрафиолетового излучения краситель, связанный с однонитевой ДНК и РНК, флюоресцирует в диапазоне 640 нм (красный спектр), тогда как при связывании с двунитевой ДНК максимум флюоресценции наблюдается в районе 560 нм (зелёный спектр). Кроме того, использование в качестве растворителя акридинового оранжевого ацетатного буфера (рН 4,2) позволяет получить резкие цветовые различия между ДНК и РНК [1].
Для подготовки срезов для конфокальной микроскопии нами была использована методика, предложенная М.H. Zheng и соавт. для современной костной ткани [15], которая основана на получении криосреза с последующей фиксацией в 70 % этаноле и окрашиванием акридиновым оранжевым, при этом отсутствие процедур заливки и декальцинации максимизируют флуоресцентный сигнал [13]. Однако недостатком исходной методики является использование в качестве заливочной среды желатин – глицеринового геля (1:1), который, как оказалось, даёт сильную автофлуоресценцию. В связи с этим заливочный гель был заменен на смесь глицерин-вода (1:1).
Хотя сама костная ткань обладает незначительной автофлуоресценцией, в результате оптимизации методики нами получены срезы, в которых наблюдаются ярко-зелёные неоднородные и рассеянные участки, что говорит о присутствии ДНК в образцах, которая с высокой долей вероятности является эндогенной. При этом отсутствие на срезах участков красного или оранжевого цвета подтверждает отсутствие контаминации экзогенными образцами ДНК и РНК (рис. 3, а–в). В качестве сравнения приведена микрофотография среза свежезамороженной современной кости, на которой обращает на себя внимание скопление клеток вытянутой формы с ярко-оранжевым окрашиванием, свидетельствующим о наличии РНК (рис. 3, г) [15].
а 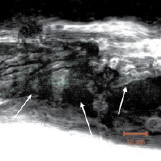 б
б 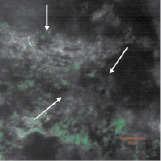
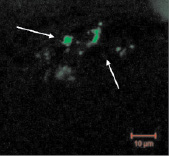 г
г 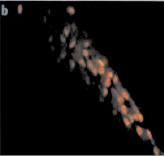
Рис. 3. Флуоресцентные микрофотографии окрашивания ДНК акридиновым оранжевым в срезах костной ткани: а – теменная кость; б – лучевая кость; в – нижнечелюстная кость; г – срез образцов современной кости из работы Zheng et al. (1997), краситель акридиновый оранжевый, максимум поглощения 488 нм, стрелками показана ДНК (снимки а–в)
Таким образом, во всех шести образцах нами выявлено присутствие эндогенной двуцепочечной ДНК (зелёные участки), её диффузное расположение с преимущественной локализацией в просветах полостей и лакун.
Заключение
Выбор метода анализа с использованием микроскопии и методики подготовки образцов, как правило, зависит от состояния ткани, целей и задач текущего исследования и производится с учётом его преимуществ и недостатков. Использование ультраструктурного анализа не представляет возможным выявление ДНК в силу необходимости интенсивной декальцинации, поэтому целесообразным является использование гистохимического метода окрашивания срезов для детекции ДНК методом конфокальной микроскопии. Ранее предложенная методика гистохимического окрашивания нуклеиновых кислот в срезах костной ткани показала свою эффективность, однако, учитывая специфику древней костной ткани, была скорректирована нами заменой заливочной среды, которая давала сильный сигнал автофлюоресценции. Таким образом, дифференциальное окрашивание нуклеиновых кислот акридиновым оранжевым позволяет выявить сохранность и присутствие древней ДНК и наличие экзогенной контаминации (в случае обнаружения РНК).
Работа выполнена при частичной финансовой поддержке гранта РФФИ 12-06-96515-р_юг_а «Молекулярно-генетический и антропологический анализ палеоматериала эпохи ранней бронзы Приморского Дагестана (могильник II великентского археологического комплекса)».
Рецензенты:
Абрамова З.И., д.б.н., профессор кафедры биохимии, заведующая НИЛ биохимии нуклеиновых кислот (БНК) ИФМиБ, ФГАОУ ВПО «Казанский (Приволжский) федеральный университет», г. Казань;
Голубев А.И., д.б.н., профессор кафедры зоологии беспозвоночных и функциональной гистологии, ФГАОУ ВПО «Казанский (Приволжский) федеральный университет», г. Казань.
Работа поступила в редакцию 10.09.2013.


