Антисептики используются людьми со времён становления цивилизации. Широко известно, что древние египтяне бальзамировали мумии и таким образом предупреждали их гниение, а в Древнем Риме использовали мёд и вино для предотвращения нагноения ран. Современное развитие и широкое применение различных антисептических средств было положено такими выдающмимся учёными, как Листер, Склифосовский, Пирогов и многими другими. Современные успехи органической химии создали базу для дальнейшего развития и внедрения антисептиков в медицину [1].
К сожалению, необходимо отметить, что не все существующие антисептики могут быть использованы в борьбе с микроорганизмами, инфицирующими послеоперационные и прежде всего хронические раны. Среди недостатков многих современных антисептиков можно указать интенсивный собственный цвет продукта (поливинилпирролидон-иод, красители с противомикробным действием, такие как кристаллический фиолетовый или бриллиантовый зеленый), токсикологическую неприемлемость или ограниченный диапазон действия (например, триклозан) [2, 3, 4].
В настоящий момент наиболее безопасными и хорошо себя зарекомендовавшими антисептиками являются полигексанид и октенидин дигидрохлорид, обладающие широким спектром действия [2].
Полигексанид является по своей химической структуре олигомерным бигуанидом и имеет следующее химическое строение:
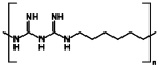
В отличие от полигексанида октенидина дигидрохлорид не является поли- или олигомером, а представляет собой молекулу со следующим строением:
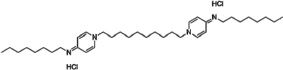
Целью данного исследования являлось экспериментальное доказательство лучшей способности подавления роста бактерий смесью полигексанида и октенидина дигидрохлорида по сравнению с этими отдельно взятыми веществами с целью применения этой смеси при обеззараживании прежде всего хронических ран.
Материалы и методы исследования
Подготовка тестируемых веществ
Растворителем полигексанида и октенидина выступал 0,5 % раствор NaCl, созданный в лаборатории с использованием высокоочищенной воды (Ultra Pure Water, Biochrom, Kat. No.: L0040) и хлорида натрия (Merck Millipore, Kat. No.: 567440). Для создания различных смесей полигексанида и октенидина были использованы 20 %-й водный раствор полигексанида (Полигексаметиленбигуанид, CAS: 27083-27-8, ARCHBiocidesltd.) и октенидин (Октенидина дигидрохлорид, твёрдая форма, CAS: 70775-75-6, Dishman Pharmaceuticalsand Chemicalsltd.).
Для растворения октенидина в 0.5 % растворе хлорида натрия были опробованы следующие поверхностно-активные вещества (ПАВ):
Pluriol P 600 (ORICA Chemicals), Pluriol P 900 (ORICA Chemicals), Pluriol P 2000 (BASF SE), Pluriol P 4000 (BASF SE), Emulphor FAS 30 (BASF SE), Pluronic PE 6800 (BASF SE), Pluronic L62 (BASF SE) Pluronic PE 7400 (BASF SE), Lutensol AT 25 Powder (BASF SE), Sokalan PA 20 (BASF SE), Pluriol E 9000 Pulver (BASF SE), Cremophor RH 40 (Caelo), Moviol 40-88 (Sigma-Aldrich). Вышеуказанные, а также другие, не использованные в данных экспериментах ПАВы, были пронумерованы. Для упрощения нумерация была сохранена, хотя ряд веществ не был использован по причине их плохой растворимости в воде.
1) Pluriol P 600
2) Pluriol P 900
3) Kollidon 30 (40.000 mw)
4) Pluriol P 2000
5) Pluriol P 4000
6) Emulphor FAS 30
7) Pluronic PE 6800 (80 % Ethylenoxid, 20 % PPO)
8) Pluronic PE 7400 (40 % ET-O 60 % PPO)
10) Lutensol AT 25 Powder (C16-C18, 25 EO, 1360 mw)
11) Sokalan PA 20
12) Pluriol E 9000 Pulver (PEG MW 9000)
16) CremophorRH 40
18) Moviol 40-88
Кроме вышеуказанных поверхностно-активных веществ был использовано ПАВ L62 (Pluronic L 62, BASF), необходимое для технического процесса, в котором должны найти своё применение октенидин и полигексанид. Исходя из этих соображений, данное вещество тестировалось в смеси с октенидином и полигексанидом.
Микроорганизмы и питательный раствор
E.coli (DSM-11250), Staphylococcusaureussubsp. aureus (DSM-799) и Pseudomonasaeruginosa (DSM-939) были культивированы в бульоне при pH 7,2 из 0,75 г казеина, 0,25 г пептона сои, 0,25 г хлорида натрия, 50 мл дистиллированной воды и 30 мкл 5 н натрия гидроксида (Appli Chem) минимум 12 часов при 37 °С при скорости перемешивания 200 rpm. Для тестирования противомикробных свойств полигексанида, октенидина и ПАВов были использованы нанесенные на агар (0,75 г агар от AppliChem и 50 мл бульон) бактерии с учётом коэффициента разведения 1:10.
Микробиологические тесты
Противомикробная активность обоих веществ и ПАВов была протестирована на вышеуказанных микроорганизмах. Каждая проба (тройное измерение)тестировалась на десяти различных концентрациях микроорганизмов каждого вида. Подсчет колоний производился через 24 ч с помощью Colony Counter Pens/eCount).
Тест на клеточную токсичность
L929 (линия фибробластов) и HaCaT (линия кератиноцитов) клетки были культивированы в среде DMEM (Dulbecco’smodifiedEagle’smedium; Biochrom) при добавлении 10 % фетальной сыворотки телёнка (Sigma), 1 % ХЕПЕС, 1 % Пенициллин/Стрептомицин, 1 % Канамицин (Biochrom), при 5 % CO2 и 37 °C. Питательный раствор заменяется на раствор DMEM с веществами, подвергающимися проверке. После 30-минутной инкубации производится интерпретация процента выживания клеток с помощью МТТ-теста согласно описанию производителя (Sigma). Сбор данных проводился с помощью фотометра при длине волны 570 нм. Оценка цитотоксичности производилась согласно нормам, принятым в ЕС: ISONorm 10993/5.
Результаты исследований и их обсуждение
В связи с гораздо худшей растворимостью октенидина по сравнению с полигексанидом были проведены исследования, направленные на выявление оптимального поверхностно-активного вещества или веществ а также их концентраций, способных растворить и стабилизировать октенидин в 0,5 % водном растворе NaCl.
Экспериментально было установлено, что именно ПАВ 11 и ПАВ 18 в различных концентрациях содействуют наиболее полному растворению октенидина.
Далее было проведено исследование растворимости октенидина при варьировании концентрации ПАВ L62. Концентрации L62 варьировались от нуля до 0,8 %. Значения экстинкции соответствовали помутнению растворов, указывающему на плохую растворимость. Более низкое значение означало хорошую растворимость (рис. 1).
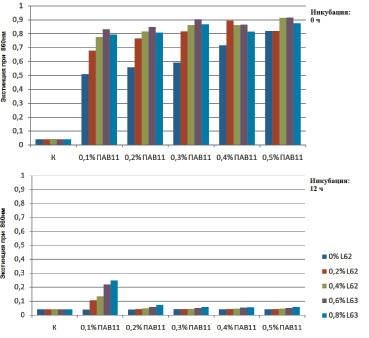
Рис. 1. Сравнение растворимости октенидина при разных концентрациях ПАВ 11 и L62 непосредственно после смешивания (сверху) и после 12-часовой инкубации (снизу)
Было отмечено, что растворимость октенидина с ПАВ 11 при различных концентрациях L62 изменялась во времени, причём наблюдалась лучшая растворимость после 12-часовой инкубации. Согласно результатам, представленным на графике, вне зависимости от концентрации L62 наблюдалась плохая растворимость октенидина во всех растворах ПАВ 11.
Однако через 12 часов инкубации было обнаружено, что практически любая комбинация L62 и ПАВ 11 обладала хорошей растворимостью, чьи значения экстинкции соответствовали контролю.
Следующим шагом стало выяснение возможности применения вышеуказанных поверхностно-активных веществ для растворения смеси октенидина и полигексанида. Нижеследующий график (рис. 2)представляет растворимость смеси 0,1 % октенидина и 0,01 % полигексанида в зависимости от выбранного ПАВ и времени инкубации.
Показаны результаты измерения экстинкции сразу после растворения компонентов.
Результаты данного исследования указывают на то, что ПАВ 10 и 16 способствуют наилучшему растворению всех необходимых компонентов (ПАВы, октенидин и полигексанид вместе).
Описанный выше эксперимент также был повторён с учётом 12-часовой инкубации. Результаты эксперимента показали значительное изменение растворимости. Наилучшей растворимости смеси L62, 0,1 % октенидина и 0,01 % полигексанида удалось достигнуть с помощью ПАВ 10, 11 и 16.
Следующим этапом исследований стало выяснение цитотоксичности исследуемых веществ и их смеси. Европейская норма проверки медицинских продуктов на цитотоксичность (ISONorm 10993) устанавливает нижний порог нетоксичности на уровне 70 % [5]. Как видно из графика, только полигексанид является с этой точки зрения нецитотоксичным. В случае смерти не более 50 % клеток вещества могут рассматриваться как слабо и легко токсичные. Если этот уровень находится между 50 и 70 %, то проверяемые активные вещества обладают средней токсичностью. Закономерно, что при снижении концентрации вещества, как правило, обладают меньшей цитотоксичностью.
Расположенный ниже график (рис. 3) представляет цитотоксичность октенидина, полигексанида и их смеси с ПАВ L62.
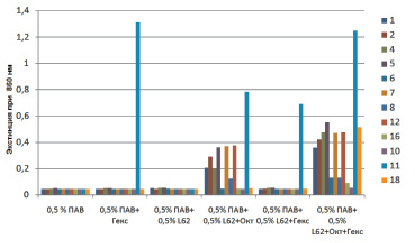
Рис. 2. Сравнение растворимости октенидина, полигексамида и их смеси в присутствие различных ПАВ
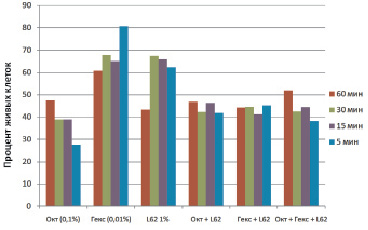
Рис. 3. Сравнение цитотоксичности октенидина, полигексамида и их смеси
Бактерицидные свойства полигексанида, октенидина и их смесей исследовались на E.coli, Staphylococcusaureus и Pseudomonasaeruginosa. На рис. 4 представлена микробиологическая активность различных концентраций активных веществ в разных временных промежутках.
Эксперименты с E.coli показали, что растворы, содержащие как полигексанид, так и октенидин, гораздо эффективнее, чем отдельно взятые вещества. Аналогичные эксперименты с Staphylococcusaureus и Pseudomonasaeruginosa при концентрации полигексанида 0,05 и 0,01 % октенидина с ПАВ 11 (L62: 0,6 %, PE6800: 0,01 % , ПАВ 11: 1 %) показали уменьшение количества бактерий как минимум на 1⋅108.
Уже низкие концентрации полигексанида (0,0025 %) и октенидина (0,0125 %) показали в комбинации друг с другом сильную противомикробную активность. Данная смесь не была до настоящего момента стандартизированно протестирована ни in vitro на бактериальных культурах ни in vivo на пациентах. Как октенидин, так и полигексанид являются хорошо зарекомендовавшими себя средствами для дезинфекции кожи и ран. Для октенидина характерно быстрое наступление эффекта [7], а также бактерицидное и цитопатогенное действие [8, 9], в то время как полигексанид обладает более поздним наступлением эффекта, являющимся в то же время более продолжительным [9].
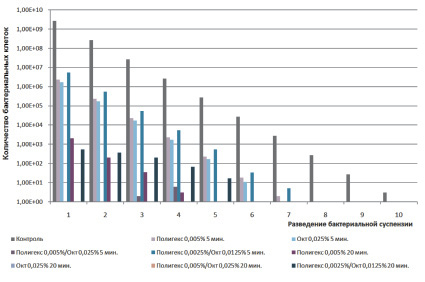
Рис. 4. Сравнение бактерицидных свойств по отношению к E. coli различных концентраций октенидина, полигексамида и их смеси при разном времени выдержки и разных плотностях исходной бактериальной суспензии
Комбинация обоих веществ оказывает синергичное влияние. Данная комбинация могла бы оказать положительное влияние на лечение инфицированных хронических ран, чьё деконтаминирование производится в интервале 48–72 часов.
Более «быстрый» октенидин убивает после механической обработки раны бактерии, находящиеся на поверхности раны. Несмотря на со временем начинающееся уменьшение влияние октенидина, полигексанид продолжает разрушать бактериальные клетки и содержать раны в состоянии, близком к асептическому. Несмотря на то, что достижение полного асептического состояния раны данным путём практически невозможно, комбинация полигексанида и октенидина является многообещающей.
Полученные в наших исследования значения цитотоксичности октенидина сопоставимы с исследованиями другими авторами сульфатов серебра и являются более высокими в сравнении с полигексанидом и поливинилпирролидон-иодом [11, 12]. Постулируется, однако, что октенидин взаимодействует с клетками или протеинами клеток, что приводит к образованию комплексов, обладающими одновременно как сильной противомикробной активностью, так и низкой цитотоксичностью. Этот факт оказал бы in vivo положительное влияние на переносимость, т.к. только внешний слой ткани контактировал бы с октенидином, в результате чего нижележащие слои были бы «закупорены» [13]. Успех применения октенидина в клинической практике подтверждает в определённой степени данную гипотезу, т.к. до сих пор не были описаны никакие затяжные нарушения заживления ран при применении октенидина (Octenisept®). Ранее опубликованные данные о низкой цитотоксичности полигексанида (например Lavasept®) в сравнении с октенидином были подтверждены и в наших исследованиях [14]. Вследствие вышеописанной возросшей противомикробной активности комбинированного препарата, состоящего из полигексанида и октенидина, может быть уменьшена доза действующих веществ и, как следствие этого, их цитотоксичность.
Демографические изменения и обусловленное ими возросшее количество случаев диабета (тип 2), закупорка артериальных сосудов и хроническая венозная недостаточностью ведут к повторяющимся дефектам кожных покровов, ярко выраженным на нижних конечностях и области таза и ведущим к увеличению заболеваний, ампутаций и смертности [5, 6]. Стоимость лечения хронических ран оценивается в мире примерно в 25 триллионов долларов США в год [5]. В результате улучшения раневых повязок, как содержащих, так не содержащих активных ингредиентов (серебро, альгинаты, асептики и т.д.), лечение хронических ран значительно улучшилось, хотя ещё и далеко от оптимального [15]. Рецидивы инфекций требуют зачастую хирургического вмешательства, избежать которого можно посредством целенаправленного применения противомикробных препаратов.
Хронические раны всегда содержат в себе бактерии [10]. В случае непатогенности бактерий иммунная система человека способна их контролировать. При этом царит определённое равновесие между факторами вирулентности бактерий, чья плотность может достигать 106 на см2, и защитными механизмами кожи. Нередко появление «суперинфекций» именно в хронических ранах. К их числу относятся как микроорганизмы, приобретённые в больнице (Pseudomonasaeruginosa, MRSA), так и бактерии, принадлежащие к нормальной флоре кожного покрова, но оказывающие патогенное влияние внутри раны. К последним принадлежат, например, E.coli, Staphylococcusaureus и Enterococcus. Именно поэтому в нашем исследовании синергичного (усиливающего друг друга) противомикробного действия октенидина и полигексанида были использованы данные бактерии, являющиеся типичными представителями бактериальной флоры хронических ран.
Заключение
Комбинация антисептиков октенидин и полигексанид показало наличие синергичного действия, создающего возможность для применения этих компонентов в низких дозах. Учитывая схожий спектр влияния относительно патогенных для человека бактерий, является целесообразной именно комбинация вышеуказанных веществ, т.к. октенидин прекрасно дополняет медленнее но долговременнее действующий полигексанид посредством своего быстродействия. Вопрос относительно высокой токсичности октенидина in vivo остаётся открытым, т.к. наблюдения пока не подтвердили данного факта.
Рецензенты:
Алешукина А.В., д.м.н., ведущий научный сотрудник, ФБУН «Ростов НИИ микробиологии и паразитологии» Роспотребнадзора, г. Ростов-на-Дону;
Монахова Е.В., д.б.н., научный сотрудник, ФКУЗ «Ростовский-на-Дону научно-исследовательский противочумный институт» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, г. Ростов-на-Дону.
Работа поступила в редакцию 15.08.2013.



