В настоящее время мнения ученых и инженеров по составу связующего силикатных бетонов и оптимальной температуры их запарки неоднозначны. Это приводит к тому, что температура и давление насыщенного водяного пара, применяемого для обработки силикатных и газосиликатных изделий, находится в разных странах в пределах 174–190 °С, давление от 0,8 до 1,2 МПа. Взгляды специалистов по вопросу о фазовом составе силикатного связующего автоклавных материалов также крайне противоречивы: одни считают, что в них преобладает тоберморит, другие – ксонотлит.
Данная статья посвящена рассмотрению этой проблемы.
Прежде всего, важен вопрос о целесообразной температуре запарки газосиликатных материалов автоклавного твердения.
На рисунке показана зависимость степени связывания извести различными видами кремнеземсодержащих материалов от температуры [2].
Как видно из рисунка, аморфная кремнекислота (силикагель, трепел, диатомит) взаимодействуют с водным раствором гидроксида кальция уже при температуре, близкой к 0 °С.
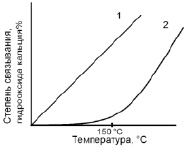
Степень связывания гидрооксида кальция различными видами кремнезема в зависимости от температуры: 1 – аморфный кремнезем; 2 – β-кварц молотый
Порошок кристаллического диоксида кремния – β-кварца – с гидроксидом кальция почти не взаимодействует вплоть до температуры 150 °С. При этой и более высокой температуре химическая реакция между Са(ОН)2 и SiO2 резко активизируется, а при 170–200 °С уже идет с приемлемой для промышленности скоростью. Вот почему запарка известково-песчаных материалов при 140–150 °С и ниже нецелесообразна с технико-экономической точки зрения.
Почему кварц резко активизируется при 150–160 °С?
Ответ на этот вопрос дает рассмотрение системы SiO2 при различных температурах [7]. Она показывает, что при температуре 170 °С одна из модификаций SiO2 – тридимит – испытывает модификационное превращение. В присутствии щелочных и щелочноземельных оксидов – СаО, Na2O, MgO – температура фазового превращения смещается на 10–20 °С вниз.
В кварце осадочного происхождения, кроме β-кварца, содержатся и другие модификации SiO2, в том числе тридимит. При помоле содержание активной фазы диоксида кремния возрастает, особенно в поверхностных слоях частиц. Фазовый переход тридимита активизирует химические реакции с его участием. Это явление называется эффектом Хэдвалла [7].
Таким образом, причиной активации реакции Са(ОН)2 + SiO2 является эффект Хэдвалла.
Как преодолеть этот температурный порог в 160–170 °С?
Гранулированные доменные шлаки и кислые золы ТЭЦ находятся в стекловидном состоянии. Данное состояние является термодинамически неустойчивым и характеризуется избыточной свободной энергией, которая может выделяться при химических реакциях. Известно, что при их использовании в смеси с известью можно понизить температуру запарки на 20–30 °С либо уменьшить ее продолжительность [4].
Повышение прочности силикатных материалов может быть достигнуто с помощью некоторых электролитов: NaCl, CaCl2, Na2SO4, NaNO3 и т.п. Механизм их действия иной.
Известно, что гидроксид кальция отличается малой растворимостью, которая резко падает с ростом температуры. Известно также, что растворимость Ca(OH)2 в воде очень мала – 1,15 г/л по СаО при комнатной температуре. В то же время растворимость кремнекислоты с ростом температуры резко возрастает, особенно в присутствии ионов гидроксила. При этом усиливается образование гидросиликатной связки силикатных и газосиликатных изделий.
При добавлении 0,5–3 % таких солей, как NaCl, Na2SO4, NaNO3 и других концентрация ионов кальция в жидкой фазе вяжущих систем растет. Она тем больше, чем выше растворимость кальциевой соли соответствующей кислоты и увеличивается в ряду СaSO4 < СaS2O3 < Са (NO3)2 < CaCl2. В этом же ряду растет и эффективность действия натриевых солей соответствующих кислот как ускорителей твердения гидросиликатной связки бетонов. По крайней мере, этот ряд соблюдается для силикатных материалов портландцементного клинкера.
Однако изложенное обобщение имеет и исключения. Так, например, сульфат кальция в повышенных дозировках может вызывать в структуре силикатных бетонов деструктивные напряжения, так как при автоклавной обработке в зависимости от ее температуры, превращается в α–ПСК (полуводный сульфат кальция), либо, что более вероятно, в α-растворимый ангидрит. Последний быстро гидратируется с большим локальным изменением объема твердой фазы, что снижает эффективность этой добавки.
В этой связи представляют интерес данные [6, 9] о том, что добавка гипса снижает прочность силикатных бетонов автоклавного твердения, а Na2SO4 – повышает [9].
В современной технической литературе по вяжущим системам утверждается, что при добавлении этой соли идет обменная реакция с образованием гипса:
Na2SO4 + Са(ОН)2 + Н2О = СaSO4·2Н2О↓ + 2NаОН
Наши термодинамические расчеты, а также правила кислотно-основных взаимодействий [9] свидетельствуют о том, что эта реакция идет не нацело, а лишь частично. Для ее полной реализации необходимо отводить продукты реакции, в том числе гипс, что невозможно в составе силикатных бетонов, где концентрация ионов кальция очень мала (0,1–0,3 г/л). В связи с этим добавка Na2SO4 не вызывает такие большие напряжения, как гипс, и более предпочтительна.
Из изложенного следует, что необходимы серьезные исследования и производственная апробация химических добавок для интенсификации производства силикатных бетонов автоклавного твердения.
Еще 60 лет тому назад Калоузек поставил вопрос о том, что силикатные изделия на основе ксонотлита 6СаО·6SiO2·Н2О обладают более высокими эксплуатационными характеристиками, чем на основе тоберморита 5СаО·6SiO2·5,5Н2О. Для реализации этой идеи нужны данные о температурной устойчивости этих двух соединений, которые пока не установлены с достаточной точностью и надежностью.
Так, в литературных источниках для обоих минералов приводится температура их устойчивого существования от 150 до 400 °С [3]. Такой разброс величин совершенно неприемлем с практической точки зрения. В связи с этим авторы произвели расчет температуры образования тоберморита и ксонотлита с применением химической термодинамики.
Предлагаемая нами методика заключается в том, что на основе термодинамических констант этих гидросиликатов и образующихся при их гидролизе и растворении ионов рассчитывается их равновесная растворимость по извести, гСаО/л. Полученная величина сравнивается с растворимостью извести при различных температурах, что позволяет найти температуру образования данного гидросиликата.
С использованием справочных и авторских исходных данных для тоберморита рассмотрена реакция
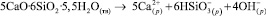
Получены следующие результаты:
|
Концентрация гидроксида кальция в пересчете, г/л СаО ………………………… |
0,23 |
|
Концентрация кремнекислоты в растворе, г SiO2/л……………………………….. |
0,24 |
|
рН……………………………………………………………………………………... |
11,4 |
Эти показатели соответствуют температуре 160–170 °С.
Для ксонотлита рассмотрена реакция
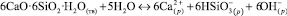
Расчет привел к следующим результатам:
|
Концентрация гидроксида кальция в пересчете на СаО, г/л СаО………………… |
0,15 |
|
Концентрация кремнекислоты в растворе, г SiO2/л……………………………….. |
0,16 |
|
рН…………………………………………………………………………………….... |
11,4 |
Значительные расхождения в данных различных авторов по вопросу температурных условий устойчивости тоберморита и ксонотлита обусловлены тем, что эти два соединения способны при изменении температуры во влажной среде испытывать взаимные превращения [1, 5].
Такие превращения, по данным [5], происходят при изменении внешних условий.
При добыче водяного пара цементное кольцо скважин нагревается до 190–200 °С и выше. При этом, по данным [1], образуется ксонотлит. Прекращение добычи пара с целью проведения ремонтных и других работ по скважине, приводит к снижению температуры в ее верхних частях до 10–25 °С и ниже. При этом ксонотлит переходит в тоберморит. После возобновления добычи пара тоберморит снова превращается в ксонотлит. Такие процессы могут наблюдаться многократно.
В книге В.С. Горшкова [5] утверждается, что превращение тоберморита в ксонотлит может происходить при нормальных условиях, что не согласуется с данными [1].
При анализе этого противоречия необходимо иметь в виду, что повышение температуры вызывает уменьшение содержания воды в гидратных соединениях. Тот факт, что в тоберморите 11,3 Å содержится почти впятеро больше воды, чем в ксонотлите, является показателем того, что последний – более высокотемпературная фаза. Гипотеза о том, что при охлаждении тоберморит теряет 4,5 моля воды, превращаясь в ксонотлит, является необоснованной, а вот обратный процесс – переход ксонотлита в тоберморит при снижении температуры – вполне возможен, о чем и свидетельствуют данные [1].
При производстве газосиликатных изделий при температуре 180–190 °С возможно образование ксонотлита, который при снижении температуры до нормальной частично или полностью может превратиться в тоберморит 11,3 Å или даже тоберморит 14 Å.
Повышение влажности изделий стимулирует этот процесс. Факторы, способствующие стабилизации ксонотлита, слабо исследованы. В связи с этим получение чисто ксонотлитовых силикатных материалов без решения изложенных проблем весьма и весьма затруднительно.
Необходимо также отметить, что переходы тоберморит ↔ ксонотлит сопровождаются существенным изменением объема 10–11 %, что близко к увеличению объема при замерзании воды. Синтез тоберморита и ксонотлита из CaО, SiO2 и Н2О сопровождается контракцией – сжатием объема системы «вяжущее – вода». Переход же тоберморита в ксонотлит, наоборот, вызывает отщепление части молекул воды от кристаллической решетки твердой фазы, что приводит к увеличению объема системы, т.е. к отрицательной контракции.
Есть основание предполагать, что этот процесс может понизить прочность силикатного камня аналогично сбросу прочности цементных систем в результате фазового перехода гексагональных гидроалюминатов кальция в кубические с отщеплением части молекул воды:
4СаО·Al2O3·19Н2О → 3СаО·Al2O3·6Н2О + Са(ОН)2 + 12Н2О
Этот процесс идет при комнатной температуре, тогда как превращение тоберморита в ксонотлит – при автоклавной обработке при 170–190 °С и выше, когда залечивание дефектов структуры путем рекристаллизации происходит достаточно интенсивно, особенно в газосиликатных материалах. Тем не менее описанные явления, обусловленные фазовыми переходами, вряд ли положительно влияют на физико-механические свойства изделий. В связи с этим актуальна проблема предотвращения фазовых переходов такого рода.
Рецензенты:
Ильина Т.Н., д.т.н., профессор кафедры теплогазоснабжения и вентиляции Белгородского государственного технологического университета им. В.Г. Шухова, г. Белгород;
Лопанов А.Н., д.т.н., профессор кафедры безопасности жизнедеятельности Белгородского государственного технологического университета им. В.Г. Шухова, г. Белгород.
Работа поступила в редакцию 07.08.2013.



