На сегодняшний день одной из нерешенных проблем в кардиохирургии является отсутствие протезов для замещения артерий малого диаметра. Возможный путь решения данной проблемы – создание сосуда непосредственно в организме на основе биодеградируемого сосудистого графта. Протезы для сердечно-сосудистой хирургии должны обладать дополнительными свойствами, обеспечивающими долговечность их функционирования: гемосовместимость, тромборезистентность и биологическую инертность. Однако любые эксперименты с биорезорбируемыми полимерами должны ответить на ряд дополнительных вопросов, отражающих принципиальную способность биорезорбируемых полимерных конструкций сохранять биологическую инертность в условиях поддержания хронического воспаления вследствие их длительной клеточной резорбции in vivo. При этом обязательно следует учитывать выраженность хронического воспаления, сопровождающего этап клеточной биодеградации полимерных структур [2, 3, 4, 5, 7].
Цель исследования – изучить динамику сывороточных маркеров воспаления при имплантации нетканых матриксов из полиоксиалканоатов и поликапролактона, потенциально пригодных для создания сосудистых графтов малого диаметра.
Материал и методы исследования
Ранее коллективом авторов была проведена серия экспериментов по выбору состава полимеров и отработке технологии изготовления конструкций, потенциально пригодных выступить в роли сосудистого импланта малого диаметра. Оптимальный состав – сочетание 5 % полигидроксибутирата/гидроксивалерата (ПГБВ) и 10 % поликапролактона (ПКЛ), (Sigma, США), обладавшим длительным сроком биорезорбции. Матриксы на основе 5 % ПГБВ/10 % ПКЛ были изготовлены методом электроспиннинга в следующем режиме: напряжение на игле – 20 kV, скорость подачи раствора полимеров – 0,3 мл/ч, расстояние от иглы до намоточного коллектора – 150 мм. Нетканые матриксы были имплантированы крысам-самцам (группа НМ, n = 18) линии Wistar с массой тела 350 ± 20 г. Эксперимент проводили с учетом требований и принципов гуманного обращения с экспериментальными животными [1] в условиях анестезии изофлюраном. Доступ к сердцу производили посредством левосторонней торакотомии с пересечением двух ребер. После выполнения перикардиотомии, осуществляли фиксацию матриксов двумя узловыми швами (у верхушки и у основания сердца) по углам образцов на передней поверхности сердца. Размер образцов составил 0,7×0,7 см. В качестве группы сравнения служили ложнооперированные животные (группа ЛО, n = 18), которым в аналогичных условиях выполнялись все манипуляции за исключением подшивания матриксов. В качестве контрольной группы выступили интактные здоровые животные (контроль, n = 6) . Вывод животных из эксперимента в группах НМ и ЛО производили через 1, 2 и 3 недели после оперативного вмешательства. У всех животных забиралась кровь с целью последующего определения белков острой фазы воспаления (С-реактивный белок (СРБ) и церулоплазмин (ЦП)), моноцитарного хемоаттрактантного белка (МСР-1) и провоспалительных цитокинов TNF-α, IL-6 и IL-1β посредством иммуноферментного анализа.
Статистическую обработку результатов эксперимента проводили с помощью пакета прикладных программ Statistica 6.0. Для описания признаков указывали медиану и межквартильный размах – 25-й и 75-й процентили (Ме (25–75 %)). Для проверки гипотезы о равенстве законов распределений использовали критерий Манна‒Уитни. Статистически значимыми считались различия при р < 0,05. Графически результаты эксперимента представляли в виде диаграмм со значениями Ме (25 %-75 %).
Результаты исследования и их обсуждение
При выведении животных групп НМ и ЛО из эксперимента выявлен спаечный процесс. В группе ЛО во всех случаях отмечался спаечный процесс между грудной стенкой и перикардом с вовлечением миокарда. В группе НМ в половине случаев наблюдался спаечный процесс между грудной стенкой и материалом, в основном в области пересеченных ребер и шовного материала. Реакции между миокардом и неткаными матриксами отсутствовали. На основании вышесказанного можно предположить, что развитие спаечного процесса обусловлено травматизацией ребер, а не имплантированными сополимерными матриксами.
Через 1 неделю после операции достоверное повышение СРБ (16,92 (10,75–26,00) мг/мл) относительно контрольных значений (8,76 (6,48–10,17) мг/мл) было зарегистрировано только в группе НМ (рисунок, а). При этом концентрации СРБ в данной группе превышали таковые у интактных животных в 1,9 раза (p < 0,05). В последующие этапы наблюдения уровни СРБ в опытной и контрольной группах достоверно не различались (р > 0,05).
Известно, что любое оперативное вмешательство само по себе способно вызвать воспалительный ответ. В связи с этим представляло интерес сравнить выраженность воспалительной реакции на имплантацию нетканых матриксов с воспалительным ответом на операционную травму. Для этого значения острофазных белков сравнивались между группами НМ и ЛО. Выявлено, что в 1 неделю наблюдения СРБ в группе с НМ (рисунок, а) был в 1,7 раза выше (16,92 (10,75–26,00) мг/мл), чем в группе ЛО (9,99 (9,27–12,03) мг/мл), р < 0,05. На второй неделе наблюдения достоверного различия уровней СРБ в изучаемых группах не выявлено. Однако через 3 недели в группе ЛО отмечено нарастание концентраций СРБ (13,74 (11,13–16,92) мг/мл), которые оказались в 1,5 раза выше, чем в группе НМ (9,25 (6,43–11,00) мг/мл), р < 0,05.
Таким образом, нивелирование воспалительной реакции в группе с имплантированными матриксами происходило быстрее, чем в группе ложнооперированных животных, что может быть обусловлено как антипролиферативным эффектом в зоне «матрикс – сердце» после имплантации матриксов, так и антиоксидантными свойствами природных биосовместимых полимеров [6].
При изучении динамики ЦП в различные послеоперационные периоды в группах НМ и ЛО в сравнении с контролем выявлено, что между группой контроля и ЛО-группой были достоверные различия (рисунок, б). Так, через 1 неделю после проведения ложной операции концентрация ЦП у животных оказалась в 1,4 раза выше (10,9 (9,03–11,42) мг/мл), чем в группе интактных здоровых животных (7,63 (5,28–7,94) мг/мл), р < 0,05. Через 2 недели наблюдения сохранялось достоверное различие показателей с разницей в 1,2 раза, р < 0,05. Однако к 3 суткам отмечено повышение уровня ЦП в группе ЛО (11,48 (9,90–12,09) мг/мл), что оказалось в 1,5 выше, чем в контроле (7,63 (5,28–7,94) мг/мл), р < 0,05. На наш взгляд, сочетанное повышение СРБ и ЦП через 3 недели после операции в группе ЛО может быть объяснено активными процессами репарации с образованием спаек к этому периоду.
При изучении концентрации ЦП в группе НМ выявлено, что на протяжении всего послеоперационного периода присутствовала достоверная разница концентраций ЦП относительно группы контроля (см. рисунок, б). Значимые различия наблюдались через 1 неделю после имплантации НМ, когда уровни ЦП (11,16 (10,22–11,59) мг/мл) в 1,5 раза превысили контрольные значения (7,63 (5,28–7,94) мг/мл), р < 0,05, с тенденцией к нивелированию данной разницы через 3 недели имплантации. В данный период уровни ЦП (10,74 (9,9–13,32) мг/мл) в 1,2 раза превысили значения в контрольной группе (7,63 (5,28–7,94) мг/мл), р < 0,05.
а 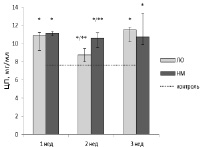 б
б 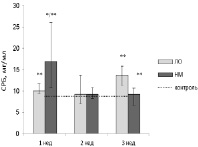
 г
г 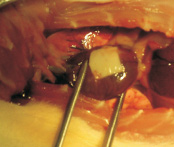
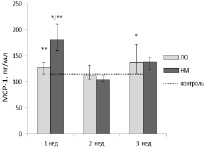
Динамика сывороточных маркеров воспаления в группах ЛО и НМ на различных этапах позднего послеоперационного периода: а – динамика СРБ; б – динамика церулоплазмина; в – динамика МСР-1; г – вид нетканого матрикса, имплантированного на переднюю поверхность сердца крысы. Примечание: ЛО – группа ложнооперированных животных; НМ – группа с фиксацией нетканного матрикса. * – p < 0,05 по сравнению с контролем; ** – p < 0,05 между группами ЛО и НМ
При сравнении концентраций ЦП в группах НМ (11,16 (10,22–11,59) мг/мл) и ЛО (10,9 (9,03–11,42) мг/мл) через 1 неделю наблюдения достоверных различий между показателями не выявлено: они были выше, чем в контроле. Спустя 2 недели после операций уровень ЦП в группе НМ начал закономерно снижаться, однако оставался в 1,2 раза выше (10,58 (9,16–11,57) мг/мл), чем в группе ЛО (8,76 (6,73–9,45) мг/мл), р < 0,05. Но через 3 недели после проведения операций значения в группе ЛО возросли, а в группе НМ остались практически неизменными, что привело к отсутствию достоверных отличий в этот период.
Таким образом, имплантация нетканых матриксов из ПГБВ/ПКЛ не способствовала усилению воспалительной реакции и была сродни реакции на операционную травму. Все это свидетельствует о высокой биосовместимости сополимерной композиции, использованной для изготовления нетканого матрикса.
При изучении концентрации МСР-1 (рисунок, в) через 1 неделю после имплантации нетканых матриксов уровень данного хемоаттрактанта (180,7 (160,5–211,2) пг/мл) в 1,6 раза выше, чем в контрольной группе (114,7 (105,82–117) пг/мл), р < 0,05. В последующие сроки концентрация МСР-1 снизилась и перестала отличаться от контрольных значений.
При сравнении уровня МСР-1 между группами НМ и ЛО через 1 неделю после операции выявлено, что концентрация МСР-1 в группе НМ (180,7 (160,5–211,2) пг/мл) в 1,4 раза превышала значения в группе ЛО (127,39 (114,92–137,14) пг/мл), р < 0,05. Через 2 и 3 недели после операции уровни МСР-1 в изучаемых группах снизились и достоверно не отличались друг от друга. Однако к сроку 3-недельного наблюдения значения МСР-1 в группах вновь увеличились. При этом достоверных отличий между значениями МСР-1 через 2 и 3 недели в группе ЛО выявить не удалось, а в группе НМ уровень МСР-1 спустя 3 недели после имплантации (138,05 (123,74–146,68) пг/мл) возрос в 1,3 раза по сравнению с 2-недельным сроком (104,55 (100,74–111,54) пг/мл), р < 0,05. Следует отметить, что значения МСР-1 через 3 недели в группе ЛО (137,96 (116,76–172,48) пг/мл) были в 1,3 раза выше, чем в контроле (114,7 (105,82–117) пг/мл), р < 0,05. При этом в данный же период уровни МСР-1 в контрольной группе и НМ достоверно не различались. Таким образом, нарастание концентрации МСР-1 в сыворотке крыс с имплантированными матриксами спустя 3 недели после имплантации могло свидетельствовать о начале привлечениия клеток моноцитарно-макрофагальной системы, ответственных за резорбцию биодеградируемых полимеров в организме, что, однако, оказалось менее выраженным, чем при репарации операционной раны и образования спаек (на примере группы ЛО). Уровни IL-6, IL-1β и TNF-α в группах НМ и ЛО во все периоды наблюдения не отличались между собой и от данных группы контроля. Все вышесказанное вновь указывает на биологическую безопасность матриксов на основе ПГБВ/ПКЛ.
Заключение
Динамика сывороточных маркеров воспаления при имплантации нетканых матриксов на основе 5 % ПГБВ/10 % ПКЛ продемонстрировала высокую биосовместимость изготовленных матриксов, что подтверждалось выраженным снижением воспалительного ответа в позднем послеоперационном периоде. Ускоренное нивелирование воспалительной реакции на имплантацию нетканых матриксов, вероятно, обусловлено свойствами полимеров, входящих в их состав.
Рецензенты:
Лисаченко Г.В., д.м.н., профессор, зав.кафедрой патологической физиологии ГОУ ВПО «Кемеровская государственная медицинская академия» Минздрава России, г. Кемерово;
Будаев А.В., д.м.н., профессор кафедры патологической физиологии ГОУ ВПО «Кемеровская государственная медицинская академия» Минздрава России, г. Кемерово.
Работа поступила в редакцию 14.08.2013.



