Предсердный натрийуретический пептид (ANP) преимущественно продуцируется предсердными кардиомиоцитами и регулирует липолиз в жировой ткани [9], усиливает высвобождение адипоцитами свободных жирных кислот. Стимуляция мобилизации липидов у человека при физических нагрузках происходит за счет увеличения уровня ANP в плазме. Понижение уровня циркулирующих натрийуретических пептидов отмечается при развитии инсулиновой резистентности и диабета 2-го типа [4]. Рецептор к натрийуретическому пептиду относится к группе рецепторов, содержащих гуанилатциклазу, активация которого приводит к повышению внутриклеточного уровня сGMP, фосфорилированию гормон-чувствительной липазы и перилипина А протеинкиназой G (PKG).
ССК – гормон и нейропептид, продуцируемый кишечником, который регулирует чувство сытости и выделение панкреатических гормонов. Рецептор к холецистокинину сопряжен с G-белком, PLC, PI3K и Са2+-системой сигнализации. Помимо классического пути передачи сигнала, обусловленного G-белком, CCK-рецептор сопряжен с рядом путей, характерных для тирозинкиназных рецепторов: MAP киназный путь, включая ERK, JNK и p38-MAPK; PI3K путь; и PLC-гамма путь [10].
Ренин-ангиотензиновая система представляет собой объединение ферментов и гормонов, регулирующих артериальное давление, электролитный и водный баланс [8]. Известно, что предшественник ангиотензина II ангиотензиноген синтезируется и секретируется адипоцитами. Показано, что AngII регулирует липогенез в адипоцитах, взаимодействуя с AngII рецепторами 2-го типа (AT2R) [6]. Нокаут по рецептору препятствует ожирению. Как и инсулин, AngII действует через рецепторы с тиразинкиназной активностью и запускает сигнальный каскад с участием фосфоинозитид-3-киназы. Также показано, что в адипоцитах мыши AngII инициирует секрецию простациклина, который вызывает процессы пролиферации и дифференцировки жировых клеток [2], увеличивает экспрессию гена лептина и его секрецию [5].
Материалы и методы исследования
В экспериментах использовали первичную культуру белых адипоцитов мыши на 9 день культивирования (9 DIV), полученную из мезенхимальной фракции стволовых клеток эпидидимального жирового депо в соответствии с общепринятой методикой [11]. Измерение динамики цитозольного кальция ([Ca2+]i) проводили с помощью системы анализа изображений «Cell observer» (Carl Zeiss, Германия), на базе моторизованного микроскопа Axiovert 200M с высокоскоростной черно-белой CCD-камерой AxioCam HSm. Источником света служила ртутная лампа НВО 100. Возбуждение флуоресценции Fura-2 проводили при двух длинах волн (340 и 387 нм) с использованием запирающих светофильтров BP 340/30 и BP 387/15.
Результаты исследования и их обсуждение
Предсердный натрийуретический пептид в широком диапазоне концентраций (3 нМ – 10 мкМ) вызывал в культивируемых белых адипоцитах периодические Са2+-колебания двух типов (рисунок, а), отличающихся не только амплитудой и периодом, но и наличием лаг-фазы в части клеток, предшествующей началу колебаний (рисунок, а, кривая 1). Колебания, индуцированные данным пептидом, подавлялись конкурентным ингибитором фермента рибозилциклазы (CD38) – никотинамидом (NAM) (рисунок, а), а также ингибиторами протеинкиназы G и рианодинового рецептора (не показано). К появлению двух типов колебаний приводила также аппликация негидролизуемого аналога цГМФ и активатора PKG – 8-Bromo-cGMP (рисунок, б). Таким образом, можно предположить, что в генерации колебаний под действием ANP происходит активация сигнального каскада, включающего ряд внутриклеточных ферментов: sGC → cGMP → PKG → CD38 → cADPR, что вызывает мобилизацию [Ca2+]i через рианодиновый рецептор. Известно, что ANP в использованных нами концентрациях стимулирует липолиз в адипоцитах за счет увеличения уровня cGMP, активации cGMP-зависимой протеинкиназы (PKG), фосфорилирующей гормон-чувствительную липазу и перилипин [7]. Значение колебаний цитозольного кальция в процессе липолиза остается невыясненным, однако в ряде работ показана их ведущая роль в регуляции процессов пролиферации и дифференцировки клеток [3]. Экспериментальные исследования in vitro и in vivo показали, что ANP вызывает выход адипонектина и адипокина, способных вызывать увеличение чувствительности к инсулину [1]. По-видимому, Са2+-сигнальная система, управляемая ANP, участвует в процессах секреции адипонектина и адипокина.
Добавление AngII в диапазоне концентраций 1–50 нМ инициировало кальциевые колебания в 5–10 % адипоцитов (рисунок, в), тогда как в большинстве клеток наблюдалось либо медленное увеличение Са2+в цитозоле, либо транзитное его повышение. Более высокие концентрации AngII (0,1–0,5 мкМ) вызывали транзитное увеличение [Ca2+]i (рисунок, г – кривая 2), а периодических режимов не наблюдалось. Колебательные ответы не возникали после опустошении эндоплазматического ретикулума тапсигаргином, однако медленные Са2+-сигналы сохранялись в этих условиях и исчезали в бескальциевой среде, что указывает на активацию депо-управляемых Са2+-каналов плазматической мембраны. Ингибиторы фосфатидил-инозитол-3-киназы – вортманнин, и протеинкиназы G – КТ5823 оказывали влияние на Са2+-ответы под действием AngII. Вортманнин понижал амплитуду [Ca2+]i сигнала, а ингибитор PKG снижал скорости увеличения и откачки [Ca2+]i (рисунок, г – кривая 1) за счет неполного ингибирования каналов мобилизации кальция из эндоплазматического ретикулума и Са2+-АТФаз плазматической мембраны.
Добавление холецистокинина (ССК) в диапазоне концентраций 10–100 нМ также инициировало в дифференцированных клетках белого жира колебательные режимы [Ca2+]i (рисунок, д). Ингибиторы фосфолипазы С и IP3-рецептора подавляли Са2+-колебания, инициированные ССК, однако к такому же эффекту приводило и ингибирование протеинкиназы G (рисунок, е). В данном случае в генерации колебаний возможно участие двух петель положительной обратной связи – короткая: (Са2+ → IP3-рецептор → Са2+) и длинная: (Са2+ → PLC → IP3 → IP3-рецептор→Ca2+). В виду того, что нами ранее было показано функционирование в адипоцитах PI3-киназного сигнального каскада с участием: eNOS → sGC → PKG → CD38 → RyR → Са2+, направленного на мобилизацию Са2+ через рианодиновый рецептор [11], и поскольку ССК-рецепторы активируют и этот путь, в определенных условиях возможно тандемное включение автоколебательного механизма Ca2+-зависимого выброса Ca2+ через канал рианодинового рецептора. Колебания подавлялись в присутствии ингибитора (5 мкМ KT5823) одной из ключевых молекул (PKG) приведенного выше сигнального пути, и в этом случае пептид ССК вызывал лишь импульсное повышение Са2+, которое устранялось в присутствии ингибиторов фосфолипазы С и IP3-рецептора.
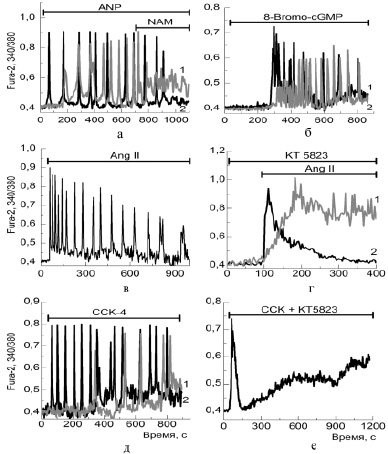
Изменение [Ca2+]i в дифференцированных белых адипоцитах под действием пептидных гормонов. Эффекты ингибиторов ключевых ферментов сGMP-сигнального каскада:а – аппликация предсердного натрийуретического пептида (ANP) в концентрации 1 мкМ (кривая 1) и 100 нМ (кривая 2) вызывает появление колебаний [Ca2+]i, которые подавляются 1 мМ конкурентного ингибитора рибозилциклазы – никотинамидом (NAM); б – активатор протеинкиназы G (аналог циклического ГМФ) в концентрации 100 нМ; в – аппликация 50нМ ангиотензина II (Ang II); г – аппликация 100 нМ ангиотензина II вызывает транзитное увеличение Са2+в цитозоле адипоцитов (кривая 2 – контроль), а ингибирование протеинкиназы G при предварительном инкубировании клеток с 5 мкМ КТ5823 (кривая 1) значительно уменьшает скорости входа и откачки [Ca2+]i; д – аппликация холецистокинина (ССК) в концентрации 10 нМ (кривая 1) и 100 нМ (кривая 2) вызывает появление колебаний [Ca2+]i; е – преинкубирование клеток с ингибитором протеинкиназы G – КТ5823 препятствует генерации колебаний на добавление ССК
Заключение
Таким образом, пептидные гормоны ангиотензин II, холецистокинин и предсердный натрийуретический пептид, взаимодействуя с рецепторами адипоцитов белого жира, могут вызывать колебания концентрации внутриклеточного Са2+ и оказывать модулирующее действие на физиологические сигналы. Полученные данные свидетельствуют в пользу того, что все исследованные пептиды активируют Са2+-систему сигнализации в белых адипоцитах и при этом могут быть задействованы различные внутриклеточные пути передачи сигналов. Каждый из исследованных пептидных гормонов имеет собственный рецептор и разветвленный сигнальный каскад, но в клетках белого жира активация любого из рецепторов исследованных пептидов может приводить в определенных условиях к появлению периодических режимов нескольких типов. Полученные данные носят приоритетный характер, поскольку периодические и затухающие Са2+-колебания, стохастические процессы и распространение Са2+-волн наблюдались неоднократно в экспериментах на клетках других типов, а в адипоцитах ранее были зарегистрированы только импульсные Са2+-ответы. Следует отметить, что основные известные изменения в системе передачи сигналов при инсулиновой резистентности и диабете 2-го типа прежде всего происходят в Са2+-системе сигнализации. Дальнейшие исследования связи наблюдаемых режимов активации Са2+-системы сигнализации с регуляцией липидного обмена позволят понять причины развития диабета 2-го типа при ожирении.
Работа выполнена при финансовой поддержке: Президиума РАН (программа № 7, проект № 01201258223); Министерства образования и науки Российской Федерации (ГК 16.512.11.2092, проект № 01201179771); ФНМ (проект № 01201256033); РФФИ (проект № 10-04-01306).
Рецензенты:
Новоселов В.И., д.б.н., профессор лаборатории механизмов рецепции, Институт биофизики клетки РАН (ИБК РАН), г. Пущино;
Асланиди К.Б., д.ф.-м.н., лаборатория регуляции внутриклеточных процессов, Институт теоретической и экспериментальной биофизики РАН (ИТЭБ РАН), г. Пущино.
Работа поступила в редакцию 11.07.2013.



