В настоящее время сложилась ситуация, когда успешное и всё более широкое применение лазеров в клинической практике несколько опережает фундаментальные гистологические исследования реакции органов на лазерное повреждение, и она до сих пор считается недостаточно изученной [5]. Сказанное в полной мере относится к такому трудному для исследования, но важному объекту, как надпочечник, лечение лазером которого [1, 6] контрастирует с фактическим отсутствием сведений как о морфологии лазерной деструкции данного органа, так и о восстановительных процессах после неё.
Для сглаживания остроты указанной проблемы мы поставили цель изучить гистологическую картину состояния надпочечника непосредственно после воздействия хирургическим лазером и спустя сутки после него.
Материал и методы исследования
Объектом исследования послужили 14 лабораторных белых крыс-самцов линии Wistar массой 348 ± 30 г., у которых с помощью аппарата «Лами» лучом диодного лазера с энергией воздействия 71,25 Дж (длина волны 1020 нм, мощность излучения 2,5 Вт, световод диаметром 400 мкм, продолжительность импульса 190 мс, интервал 10 мс, количество импульсов 150) осуществлялась деструкция части левого надпочечника.
Непосредственно после воздействия и через 1 сутки производили забой крыс передозировкой паров эфира по 7 животных на срок.
Для дифференцировки в мозговом веществе надпочечника двух основных субпопуляций хромаффиноцитов – эпинефроцитов и норэпинефроцитов ‒ применяли метод Honore [7], согласно которому материал фиксировали в 5 % глутаровом альдегиде, заливали в парафин, а срезы окрашивали сочетанием бихромата калия и толуидинового синего. В результате норэпинефроциты окрашивались в зелёный, а эпинефроциты ‒ в серовато-фиолетовый цвет.
Измерения проводили с помощью окулярных линеек и сеток непосредственно на препаратах и по цифровым фотографиям с использованием программы Fiji (разновидность ImageJ), статистическую обработку осуществляли с помощью программ Универсальный гистологический счётчик [2] и Microsoft Exel.
Результаты исследований и их обсуждение
В указанные сроки обнаружена следующая гистологическая картина.
Непосредственно после воздействия. В точке приложения лазера с указанными параметрами происходит абляция тканей с образованием каверны объёмом 0,27 ± 0,08 мм3 (рис. 1). Края каверны выстланы струпом тёмно-коричневого цвета толщиной от 50 до 100 мкм (обугливание). По мере удаления от края повреждения струп светлеет до золотистого (карамелизация). Под струпом находится зона губчатой консистенции (вапоризация), в котором можно выделить два слоя – наружный и внутренний, резко различающиеся как структурно, так и, с поправкой на использованный метод окраски, тинкториально. Наружный слой является непосредственным продолжением струпа, имеет толщину от 80 до 150 мкм, слабо базофилен, окрашивается в бирюзовый цвет и содержит мелкие вакуоли диаметром до 20 мкм. Клетки в этой зоне полностью разрушены. Внутренний слой имеет толщину 300–400 мкм, интенсивно базофилен, окрашивается в синий цвет, содержит обширные пустотелые вакуоли диаметром до 350 мкм.
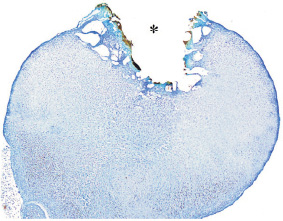
Рис. 1. Надпочечник крысы непосредственно после воздействия лазером:* – абляционная каверна. Фикс. глут. альдегидом, окр. по Honore. Об. ×4, фотонасадка ×27
Стенки вакуолей образованы вытянутыми, деформированными клетками с бледно окрашенной цитоплазмой и удлинёнными интенсивно окрашенными ядрами (рис. 2).
Чёткая граница между погибшими и выжившими клетками отсутствует (рис. 1). Клетки мозгового вещества слабо окрашены, хромаффинная реакция отсутствует, норэпинефроциты и эпинефроциты по окраске не дифференцируются. Нейроны мозгового вещества, напротив, сохраняют интенсивную базофильную окраску с характерными для них базофильными глыбками в цитоплазме, но в этой же локальной точке можно встретить и аномально хромофобные нейроны (рис. 3).
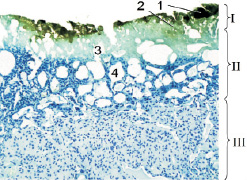
Рис. 2. Край абляционной каверны в надпочечнике крысы после воздействия лазером:I – струп; II – зона губчатого некроза (вапоризация); III – зона компактного некроза; 1 – обугливание; 2 – карамелизация; 3 – микровакуолярная зона; 4 – макровакуолярная зона. Фикс. глут. альдегидом, окр. по Honore. Об. ×10. фотонасадка ×27
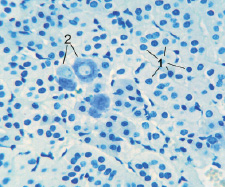
Рис. 3. Мозговое вещество надпочечника крысы после воздействия лазером:1 – хромаффинноциты; 2 – нейроны. Фикс. глут. альд., окр. по Honore. Об. ×40, фотонасадка ×27
1 сутки. В половине случаев зона некроза резко просветляется и приобретает отчётливую границу. Измеренная по ней глубина лазерного поражения составляет 1–2 мм.
При этом зона некроза заполнена беспорядочно разбросанными клеточными остатками разной степени разрушения и лейкоцитами. Хромаффинная реакция выживших хромаффиноцитов восстанавливается, они хорошо прокрашиваются, норэпинефроциты и эпинефроциты легко тинкториально дифференцируются. Некоторые из них, проявившие большую устойчивость, чем соседние оказываются изолированными от основной массы живых клеток в некротической зоне и, напротив, среди выживших клеток встречаются мозаично расположенные погибшие, имеющие пикнотические ядра и хромофобную цитоплазму. Ряд эндокриноцитов пограничной области показывают промежуточное состояние – имеют чёткие контуры, хромофильную цитоплазму, но ядра с признаками пикноза (рис. 4). На периферии органа – в капсуле и по краю абляционной каверны заметен приток и активизация клеток воспаления. Здесь обнаруживаются скопления полиморфноядерных лейкоцитов и освобождающиеся от гранул тучные клетки (рис. 5).
В другой половине случаев просветление зоны некроза не наблюдалось, его граница визуально не определялась. Клетки даже вблизи зоны вапоризации сохраняли целостность, а приток и активизация клеток воспаления были заметны только по периферии органа.
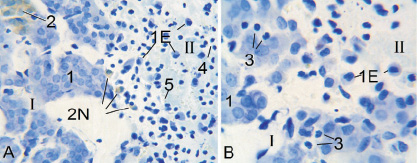
Рис. 4. Пограничная область лазерного повреждения в надпочечнике крысы через 1 сутки после воздействия:I зона выживания; II – зона некроза; 1 – эпинефроциты; 2 – норэпинефроциты; 1E – выжившие эпинефроциты в зоне некроза; 2N – выжившие норэпинефроциты в зоне некроза; 3 – погибшие клетки в зоне выживания; 4 – лейкоциты; 5 – эритроциты. Фикс. глут. альд., окр. по Honore. A – Об. ×40, фотонасадка 27х, B – Об. ×85, фотонасадка ×27
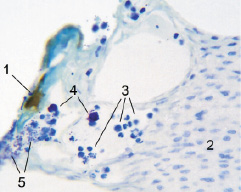
Рис. 5. Край абляционной каверны в надпочечнике крысы через 1 сутки после воздействия лазером:1 – струп; 2 – некротизированные эндокриноциты; 3 – лейкоциты; 4 – тучные клетки;5 – выделенные тучными клетками гранулы. Фикс. глут. альд., окр. по Honore. Об. ×40, фотонасадка ×27.
Обнаруженная гистологическая картина эффекта фототермического воздействия со стандартными для лазерной хирургии эндокринных желёз параметрами на надпочечник в целом соответствует описанной для других паренхиматозных органов [3, 4, 8]. Сходным является образующаяся в центре воздействия абляционная каверна (результат удаления тканевых масс путём ионизации, сгорания и испарения), затем по мере удаления от неё появление зон карбонизации (редукция органических веществ до угля), карамелизации (плавление сахаров и максимальная денатурация белков) и вапоризации (губчатый слой за счёт образования наполненных паром пузырей), «компактного» некроза (нагрев ниже точки вапоризации), а также отсроченная гибель и распад не убитых сразу, но смертельно повреждённых клеток. Можно отметить, что по отсутствию сразу после повреждения резкой границы между смертельно повреждёнными и жизнеспособными клетками, которая в половине случаев становится отчётливой к 1 суткам, реакция надпочечника ближе к печени, в которой первоначально размытая граница становится резкой в течение первых 3 суток, чем, например, к поджелудочной железе, в которой эта граница рано стабилизируется и к концу первых суток не претерпевает существенной динамики. Сходную картину для печени и надпочечника легко объяснить сходной консистенцией этих органов. В обоих паренхима образована комплексами эпителиальных клеток, чередующимися с синусоидными капиллярами, а доля волокнистой соединительной ткани невелика. В то же время местное распределение температуры сильно зависит и от природы ткани, и от перфузии в ней крови через сосудистую сеть, и от формы органа [9].
Кроме того, характерной чертой эффекта лазерного воздействия на эндокриноциты мозгового вещества надпочечника является утрата их характерной способности прокрашиваться солями хрома – хромаффинной реакции. В половине случаев к 1 суткам наступает её восстановление. К сожалению, отсутствие отчётливой границы коагуляции сразу после лазерного повреждения не даёт возможности однозначно проиллюстрировать, что это свойство проявляют не только смертельно повреждённые, но ещё не распавшиеся на этот срок клетки, но и клетки, оставшиеся жизнеспособными и впоследствии восстанавливающие нормальное морфофункциональное состояние. Но однородная хромофобность всех мозговых эндокриноцитов, в том числе и находящихся на значительном удалении от центра поражения (более 2 мм), говорит в пользу этого. Так как в контрлатеральных – интактных надпочечниках этого же срока хромаффинная реакция сохраняется, то, очевидно, причиной её утраты в повреждённом органе служит не общая реакция на стресс, а местный температурный шок. Для выяснения механизма его действия на катехоламины в хромаффиноцитах целесообразны дополнительные исследования.
Сам факт присутствия в пограничной зоне погибших эндокриноцитов среди выживших, как и обнаруженная разница в окраске нейронов, является свидетельством неодинаковой фототермической устойчивости клеток даже одной популяции, находящихся в одной точке пространства. В то же время избирательного губительного действия лазера на какие-либо разновидности клеток надпочечника не обнаружено.
Проявившееся на 1 сутки резкое различие в эффекте воздействия хирургического лазера на надпочечник, выразившееся в появлении или отсутствии в половине случаев к концу 1 суток резкой границы некроза и выживания, очевидно, связано с тем, что применённое воздействие со стандартными для эндокринных желёз параметрами в связи с малыми размерами надпочечника крысы привели к избыточному перегреву части органов, что вызвало поражение, включая коагуляцию сосудов, всего их объёма за исключением самой периферии. Более масштабное поражение, в том числе нарушение кровоснабжения, воспрепятствовало проникновению вглубь органа клеток воспаления, ускоренному распаду погибших клеток и разграничению их с выжившими, в результате погибшие клетки остались в состоянии «тепловой фиксации» [10]. Из этого следует, что лазерная энергия выше применённой для данного объёма надпочечника вызовет гарантированную гибель всей паренхимы органа, более низкая ‒ выживание её значительной части.
Выводы
1. В месте воздействия диодным хирургическим лазером с энергией 71,25 Дж происходит испарение ткани надпочечника объёмом 0,27 ± 0,08 мм3 и появляется абляционная каверна. По мере удаления от неё возникают зоны карбонизации и карамелизации (струп), зона вапоризации (губчатый некроз) из двух слоёв, отличающихся по размерам вакуолей и тинкториально, и зона внешне целых, но смертельно повреждённых клеток (компактный некроз). Глубина поражения достигает 1–2 мм.
2. Непосредственно после действия лазера отсутствует отчётливая граница между погибшими и выжившими клетками, которая спустя 1 сутки проявляется в половине случаев.
3. Лазерное воздействие вызывает утрату эндокринными клетками мозгового вещества надпочечника характерной хромаффинной реакции, которая в половине случаев восстанавливается к концу 1 суток.
4. Клетки одной и той же популяции могут обладать неодинаковой фототермической устойчивостью, в то же время избирательного действия лазера на ту или иную разновидность клеток надпочечника не обнаружено.
5. Применённая энергия лазерного воздействия вызывает выживание части паренхимы надпочечника или её полную гибель в соотношении 50/50.
Рецензенты:
Гансбургский А.Н., д.м.н., профессор кафедры гистологии, цитологии и эмбриологии, ГБОУ ВПО «Ярославская государственная медицинская академия» Минздрава РФ, г. Ярославль;
Румянцева Т.А., д.м.н., профессор, заведующая кафедрой анатомии человека, ГБОУ ВПО «Ярославская государственная медицинская академия» Минздрава РФ, г. Ярославль.
Работа поступила в редакцию 11.07.2013.



