Для оценки рисков неблагоприятного воздействия факторов окружающей среды на здоровье населения, обоснования контаминантной нагрузки организма на базе системных зависимостей с факторами воздействия в последнее время широко используются результаты исследований по содержанию химических соединений в биологических средах человека [2]. Известно, что одним из ведущих факторов техногенного воздействия на здоровье населения является качество питьевой воды из систем централизованного водоснабжения. Для городов России одним из приоритетных способов обеззараживания является хлорирование воды. На стадии обеззараживания образуется более 50 хлорорганических соединений, в том числе хлорированные фенолы различной степени хлорирования (моно-, ди-, трихлорфенолы), имеющие высокую биологическую активность [6, 3]. С увеличением атомов хлора в ароматическом кольце повышается токсичность хлорированных фенолов, устойчивость к разложению и способность к биоаккумуляции [12]. Хлорированные фенолы обладают иммунотоксичными и канцерогенными свойствами, изменяют внутриклеточный метаболизм [9].
Проведенный анализ научной литературы позволил заключить, что большинство современных методов определения хлорированных фенолов в биологических средах отличаются недостаточной селективностью и чувствительностью. Так, определение трихлорметафоса-3 и его метаболитов в биологическом материале методом газожидкостной хроматографией включает извлечение остатков трихлорметафоса-3 и хлорфенолов из проб биоматериала (печень, почки, головной мозг, кровь, моча) смесью органических растворителей – хлористого метилена и гексана (2:1) с добавлением этилового спирта, концентрировании экстракта и последующем определении на газовом хроматографе с ДЭЗ или ДПР [7]. Нижний предел определения трихлорметафоса-3 0,3 мг/кг, хлорфенолов 0,1 мг/кг. Одновременное определение методом газовой хроматографии фенола, 2-хлорфенола, 2,4 и 2,6-дихлорфенола, 2,4,6-трихлорфенола и 2,3,5,6-тетрахлорфенола в моче рабочих, подвергшихся экспозиции, предлагают P.B. Roosmalen, A.L. Klein [11]. Фенолы разделяются методом перегонки водяным паром и затем экстрагируются изопропиловым эфиром. Образцы анализировались на газовом хроматографе с использованием стеклянной колонки (180 см×2 мм внутренний диаметр), заполненной Tenax GC с детектором ионизации в пламени. Пределы обнаружения в моче составили для фенола 0,1 и 1 мг/л для ди- и трихлорфенолов. Coutts R.T., Hargesheimer E.E., Pasutto F.M. [10] предложили метод определения хлорфенолов в моче экстракцией органическим растворителем в кислой среде.
Наиболее часто в системах водоснабжения обнаруживаются хлорированные фенолы, в том числе 2,4,6-трихлорфенол и 2,4-дихлорфенол, которые в высоких концентрациях (0,1 мкг/л) оказывают токсическое действие, сопровождающееся тошнотой, повышением температуры, учащением дыхания, судорогой [5]. Определение этих соединений в биологических объектах является сложной аналитической задачей, решение которой требует разработки и внедрения в аналитическую практику методов разделения и детектирования, обеспечивающих определение пикограммовых количеств хлорированных фенолов на фоне веществ, присутствующих в матрице в значительно более высоких концентрациях.
Вышеизложенное определило актуальность настоящих исследований и позволило сформулировать цель работы – разработка высокочувствительных и селективных методов определения хлорированных фенолов в крови.
Материалы и методы исследований
Исследования выполнялись специалистами химико-аналитического отдела ФБУН «Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения». Объектами исследований являлись биологические среды (кровь), технология разработки газохроматографических методов: хроматографическое поведение исследуемых соединений на различных неподвижных жидких фазах, методы подготовки биопробы для химического анализа. Исследования по отработке методов подготовки образцов крови на содержание хлорированных фенолов выполнялись методом капиллярной газовой хроматографии с использованием газового хроматографа «Кристалл-2000» с галогенселективным детектором ДЭЗ (детектор электронного захвата).
Результаты исследований и их обсуждение
Изучены условия разделения на капиллярных колонках с различными характеристиками неподвижных жидких фаз: DB-624-25m×0,32mm×5,0µm (полярная цианопропильная фаза; температурный предел от 60 °С до 260/300 °С), HP-FFAP – 50 m×0,32 mm×0,5 µm (полярная фаза с покрытием нитротерефталевой кислотой; температурный предел от 60 °С до 240/250°С) и DB-XLB – 30 м×0,32 мм×0,5 мкм (низкополярная фаза; температурный предел от 30 °С до 340/360 °С). Полнота разделения 2,4-дихлорфенола и 2,4,6-трихлорфенола достигнута на капиллярной колонке DB-XLB- 30 м×0,32 мм×0,5 мкм при температурном режиме: колонки 135–250 °С; испарителя 260 °С; детектора 280 °С; расходе газа-носителя (азот) 20 см3/мин. Хроматограммы стандартных растворов 2,4-дихлорфенола и 2,4,6-трихлорфенола представлены на рис. 1.
Для обнаружения хлорированных фенолов (2,4-дихлорфенол и 2,4,6-трихлорфенол) в биологических средах (кровь) использовали высокоспецифичный электронно-захватный детектор (ДЭЗ) [8]. На практике при анализе биосреды наиболее часто используются такие способы пробоподготовки, как экстракция органическим растворителем и дериватизация целевых компонентов. Поэтому важным этапом исследований являлось изучение зависимости полноты экстракции хлорированных фенолов из биоматериала различными органическими растворителями, рН среды и дериватизации. В ходе экспериментальных работ по выбору экстрагента использовали ряд органических растворителей [4]. Средние значения полноты экстракции 2,4-дихлорфенола и 2,4,6-трихлорфенола из крови для ряда экстрагентов представлены в табл. 1.
а 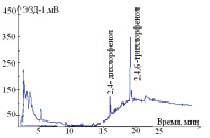 б
б 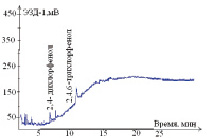 в
в 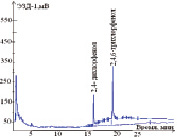
Рис. 1 Хроматограммы стандартных растворов 2,4-дихлорфенола и 2,4,6-трихлорфенола, полученные на капиллярных колонках с различными неподвижными жидкими фазами:а – колонка DB-624 – 25 m×0,32 mm×5,0 µm; при температурном режиме: колонки 125–240 °С; испарителя 250 °С; детектора 270 °С; расходе газа-носителя (азот) 20 см3/мин; б – колонка HP-FFAP – 50 m×0,32 mm×0,5 µm; при температурном режиме: колонки 135–260 °С; испарителя 260 °С; детектора 280 °С; расходе газа-носителя (азот) 20 см3/мин;в – колонка DB-XLB – 30 м×0,32 мм×0,5 мкм; при температурном режиме: колонки 135–250 °С; испарителя 260 °С; детектора 280 °С; расходе газа-носителя (азот) 20 см3/мин
Таблица 1
Зависимость степени экстракции 2,4-дихлорфенола и 2,4,6-трихлорфенола из крови от природы органического растворителя (n = 5, Р = 0,95)
|
Органический растворитель |
2,4-хлорфенол |
Степень экстракции, % |
2,4,6-трихлорфенол |
Степень экстракции, % |
||
|
Введено |
Найдено |
Введено |
Найдено |
|||
|
1. Хлористый метилен |
0,18 |
0,002 ± 0,0004 |
1,1 |
0,14 |
0,00007 ± 0,0000035 |
0,05 |
|
2. Диэтиловый эфир |
0,011 ± 0,0021 |
6,1 |
0,04 ± 0,0038 |
28,6 |
||
|
3. Хлористый метилен + гексан (1:1) |
0,0002 ± 0,000015 |
0,11 |
0,000032 ± 0,0000052 |
0,02 |
||
|
4. Гексан |
9,25 |
3,57 ± 0,35 |
38,6 |
7,05 |
3,5 ± 0,28 |
49,8 |
|
5. Толуол |
5,96 ± 0,43 |
64 |
5,83 ± 0,37 |
82,7 |
||
Экспериментальным путем установлено, что применение в качестве экстрагента толуола при использовании 10 % раствора щавелевой кислоты для обеспечения рН среды 2–3 повышает степень извлечения из крови до 64 % для 2,4-дихлорфенола и 82,7 % ‒ для 2,4,6-трихлорфенола.
Хроматографическое определение хлорированных фенолов затруднено в связи с их высокой полярностью, недостаточной термической и химической стабильностью, что вызывает ассимметричность пиков и их неудовлетворительное разделение. С целью получения соединений с меньшей полярностью, более низкой температурой кипения, повышенной стабильностью и лучшими по сравнению с исходными хлорфенолами хроматографическими характеристиками в исследованиях использовали химическую модификацию хлорфенолов действием ацилирующих агентов. Изучены два методических подхода химической модификации хлорфенолов: метод экстракции-бромирования и экстракции-бромирования-дериватизации.
Метод экстракции-бромирования включал экстракцию хлорфенолов (2,4-дихлорфенол и 2,4,6-трихлорфенол) из биологической матрицы (кровь) органическим растворителем в кислой среде и введение в молекулу хлорфенола атомов галогенов в органической фазе [13]. Методика модификации и количественного определения низких концентраций хлорфенолов (2,4-дихлорфенол и 2,4,6-трихлорфенол) в биосреде (кровь) основана на окислении хлорфенолов в избытке молекулярного брома. В процессе исследований установлены оптимальные условия бромирования хлорфенолов: исходная концентрация брома в растворе, рН среды, продолжительность бромирования. С этой целью к 2 см3 крови добавляли 5 мм3 исходного стандартного раствора (концентрация 2,4-дихлорфенола 4,6 мкг/см3 и 2,4,6-трихлорфенол 3,5 мкг/см3), 2 см3 бидистиллированной воды, подкисляли 10 % раствором щавелевой кислоты до рН = 2–3 и экстрагировали пробу крови 2 раза двумя см3 органического растворителя (толуол) в течение 5 минут. Полученный экстракт центрифугировали при 7000 об/мин в течение 15 минут и сливали в пробирку объемом 10 см3. Затем применяли реакцию взаимодействия хлорпроизводного фенола с молекулярным бромом в органическом экстракте в кислой среде. Для этого к органическому экстракту добавляли бромирующий реагент в объеме 2 и 0,4 см3 разбавленной серной кислоты при рН = 2–3 и затем экстракт бромировали. В процессе исследований было установлено, что в кислой среде при избытке молекулярного брома (~103-кратный молярный избыток по сравнению с расчетным стехиометрическим соотношением) бромпроизводное 2,4-дихлорфенола образуется в течение 3–5 минут с количественным выходом, после чего происходило снижение его концентрации, вызванное окислением (табл. 2).
Таблица 2
Полнота экстракции 2,4-дихлорфенола из крови в зависимости от времени бромирования
|
Время бромирования, мин |
Концентрация, мкг/см3 |
Полнота экстракции, % |
|
|
Введено |
Найдено |
||
|
1,0 |
1,11 |
0,19 ± 0,032 |
17,1 |
|
3,0 |
1,11 |
0,45 ± 0,071 |
40,5 |
|
5,0 |
1,11 |
0,98 ± 0,054 |
88,3 |
В ходе экспериментальных работ по выбору экстрагента изучали зависимость полноты экстракции бромпроизводных хлорфенолов из крови различными экстрагентами при pH 2-3 (табл. 3).
Таблица 3
Полнота экстракции бромпроизводных хлорфенолов
|
Экстрагент |
Концентрация, мкг/см3 |
Полнота экстракции, % |
|
|
Введено |
Найдено |
||
|
2,4-дихлорфенол (6-Бром 2,4-дихлорфенола) |
|||
|
Гексан |
9,25 |
4,98 ± 0,44 |
53,8 |
|
Толуол |
9,25 |
7,1 ± 0,42 |
76,8 |
|
2,4,6-трихлорфенол |
|||
|
Гексан |
7,05 |
0 |
0 |
|
Толуол |
7,05 |
0 |
0 |
К органическому экстракту (гексан, толуол), содержащему стандартные растворы хлорфенолов, добавляли бромирующий реагент в объеме 2 и 0,4 см3 разбавленной серной кислоты и экстракт бромировали в течение 5 мин. Избыток брома удаляли из органического экстракта раствором сернистокислого натрия объемом 0,4 см3 и пробирку энергично встряхивали в течение 3 мин, образец центрифугировали при 7000 об/мин в течение 10 минут до разделения водной и органической фракций. После разделения слоев 1 мм3 органического экстракта анализировали методом ГХ/ЭЗД.
Максимальная степень экстракции при подобранных оптимальных условиях бромирования хлорфенолов и органического растворителя была достигнута при использовании толуола для экстракционного концентрирования в кислой среде при рН = 2–3, времени бромирования в течение 5 мин, которая составила для 2,4-дихлорфенола 76,8 %. 2,4,6-трихлорфенол взаимодействует с бромом.
Метод экстракции-бромирования-дериватизации включает получение новой аналитической формы путем введения атомов брома в ароматическое ядро хлорфенолов по реакции электрофильного замещения (первая стадия), последующее ацилирование ангидридами в среде органического растворителя бромпроизводных хлорфенолов (вторая стадия) [1, 13]. Целенаправленное насыщение молекул хлорфенолов атомами галогенов повышает чувствительность ДЭЗ к получаемым дериватам и позволяет снизить предел обнаружения. Для эффективного концентрирования бромпроизводных хлорфенолов из биосреды (кровь) применяли жидкостную экстракцию различными органическими растворителями, изучали экстракционные характеристики, оценивали эффективность химической модификации хлорфенолов. Изучена зависимость полноты экстракции 2,4-дихлорфенола из крови при применении органического экстрагента, бромирования в органической фазе в избытке молекулярного брома; 2,4,6-трихлорфенола при использовании ацилирующего агента, реакция протекает в среде пиридина (табл. 4).
Таблица 4
Полнота экстракции эфирных производных хлорфенолов из крови (этерификация в среде органического растворителя)
|
Экстрагент |
Концентрация, мкг/см3 |
Полнота экстракции, % |
|
|
Введено |
Найдено |
||
|
2,4-дихлорфенол (трифторацетата 6-Бром 2,4-дихлорфенол) |
|||
|
Гексан |
9,25 |
6,12 ± 0,58 |
66,2 |
|
Толуол |
9,25 |
8,2 ± 0,39 |
88,8 |
|
2,4,6-трихлорфенол (три-фтор-ацетата 2,4,6-трихлорфенол) |
|||
|
Гексан |
7,05 |
5,0 ± 0,61 |
70,9 |
|
Толуол |
7,05 |
6,77 ± 0,54 |
96,1 |
Полученные результаты полноты экстракции 2,4,6-трихлорфенола из крови при применении различных ацилирующих агентов показаны в табл. 5.
Таблица 5
Полнота экстракции 2,4,6-трихлорфенола из крови (этерификация в среде органического растворителя различными ацилирующими агентами)
|
Ацилирующий агент |
Концентрация, мкг/см3 |
Полнота экстракции, % |
|
|
Введено |
Найдено |
||
|
Уксусный ангидрид |
0,7 |
0,03 ± 0,0046 |
4,3 |
|
Йодистый метил |
0,7 |
0,18 ± 0,031 |
25,7 |
|
Трифторуксусный ангидрид |
0,7 |
0,67 ± 0,042 |
95,7 |
Оптимальный эффект полноты экстракции изучаемых соединений из биосреды (кровь) наблюдался при использовании в качестве экстрагента толуола, ацилирующего агента – трифторуксусного ангидрида, реакция протекает в среде пиридина при объемных соотношениях – экстрагент:ацилирующий агент: бромная вода:пиридин = 2:0,4:0,4:0,1 и центрифугировании биопробы при 7000 об/мин в течение 15 мин. Центрифугирование в течение меньшего диапазона времени недостаточно для устранения матричного эффекта при оптимизации количественного определения хлорфенолов в биопробе. В экстракционной системе толуол–биосреда из крови извлекалось от 64 до 82,7 % хлорфенолов, бромпроизводных 2,4-дихлорфенола (6-Бром 2,4-дихлорфенола) 76,8 %, для их эфирных бромпроизводных степень извлечения увеличивалась и достигала для 2,4-дихлорфенола (трифторацетата 6-Бром 2,4-дихлорфенол) 88,8 % и для три-фтор-ацетата 2,4,6-трихлорфенола 96,1 %.
Для идентификации хлорированных фенолов и их производных в крови, образующихся на различных стадиях подготовки биопробы к анализу, выполнены хромато-масс-спектрометрические исследования стандартного образца (2,4-дихлорфенол и 2,4,6-трихлорфенол) с регистрацией масс-спектров и сравнения с библиотечными спектрами. Для качественной идентификации производных хлорфенолов использовали алгоритм аналитического исследования стандартных образцов, основываясь на временах удерживания и относительной интенсивности одного основного и двух подтверждающих ионов (m/z). Полученные производные хлорфенолов анализировали в системе газовый хроматограф–масс-спектрометр НР 5973/6890 фирмы Agilent Technologies. Хроматограммы получали с применением кварцевой капиллярной колонки DB- 624, 30 m×0,25 mm×0,25 µm в условиях: температурная программа колонки 150–250 °С; температура инжектора 290 °С, давление 109,7 kPa, газ-носитель гелий. Инжектор направлен на ввод пробы без сброса (splitless). Режим работы масс-селективного детектора – сканирование в интервале 40–550 а.м. Для обработки хроматограмм использовали систему AMDIS (NIST).
Алгоритм аналитического исследования стандартного образца 2,4-дихлорфенола
1 этап экстракционного концентрирования 2,4-дихлорфенола методом жидкостной экстракции в кислой среде предназначен для перевода 2,4-дихлорфенола в более удобную для последующего газохроматографического анализа органическую фазу, повышения его концентрации в экстракте и отделения мешающих компонентов из биологической матрицы. Хроматограмма стандартного образца 2,4-дихлорфенола по полному ионному току и масс-спектр представлены на рис. 2.
а 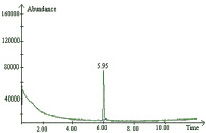 б
б 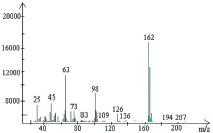
Рис. 2. а – хроматограмма стандартного образца 2,4-дихлорфенола по полному ионному току. 5,96 мин–2,4-дихлорфенол; б – масс-спектр стандартного образца 2,4-дихлорфенола. Основной ион массой 162 и подтверждающие ионы 126 и 98
2 этап: бромирование органического экстракта, содержащего 2,4-дихлорфенол, молекулярным бромом. При бромировании атомы брома замещают атомы водорода в ароматическом ядре хлорфенола в положении 6 и происходит образование бромпроизводного 6-Бром 2,4-дихлорфенола.
3 этап: получение трифтор-ацетилпроизводных хлорфенолов в среде органического растворителя для газохроматографического анализа. Получение трифторацетатов бромпроизводных хлорфенолов улучшает их хроматографические характеристики: уменьшает полярность, понижает температуры кипения, нейтрализует активный атом водорода ОН-группы, осложняющий газохроматографический анализ. Хроматограмма стандартного образца 6-бром-2,4-дихлорфенола ацетилированного трифторуксусным ангидридом по полному ионному току и масс-спектр представлены на рис. 3.
Проведенные исследования позволили идентифицировать по величинам времени удерживания и масс-спектрам в стандартном образце: 2,4-дихлорфенол, 6-Бром 2,4-дихлорфенол, трифторацетата 6-Бром 2,4-дихлорфенола.
Алгоритм аналитического исследования стандартного образца 2,4,6-трихлорфенола
1 этап экстракционное концентрирование 2,4,6-дихлорфенола методом жидкостной экстракции в кислой среде. Эта стадия предназначена для перевода 2,4,6-трихлорфенола в более удобную для последующего газохроматографического анализа органическую фазу. Хроматограмма стандартного образца 2,4,6-трихлорфенола по полному ионному току и масс-спектр представлены на рис. 4.
а 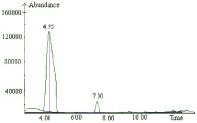 б
б 
Рис .3. а – хроматограмма стандартного образца 6-бром-2,4-дихлорфенола, ацетилированного трифторуксусным ангидридом по полному ионному току: 7 мин – трифторацетата 6-Бром 2,4-дихлорфенол; б – масс-спектр трифторацетильного производного 6-бром-2,4-дихлорфенола (соответствует по молекулярному весу этому соединению). Основной ион массой 241 и подтверждающие ионы 213 и 338
а 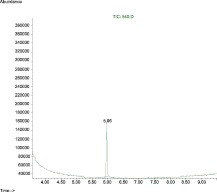 б
б 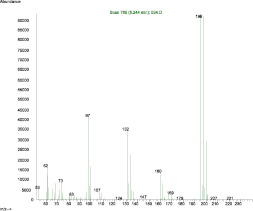
Рис. 4. а – хроматограмма стандартного образца 2,4,6-трихлорфенола: по полному ионному току. 5,96 мин – 2,4,6-трихлорфенол; б – масс-спектр стандартного образца 2,4,6-трихлорфенола. Основной ион массой 196 и подтверждающие ионы 160 и 132
2 этап ‒ проведение этерификации в среде органического растворителя. Превращение 2,4,6-трихлорфенола в эфиры путем ацетилирования трифтор-уксусным ангидридом в среде пиридина. Ацетилирование в среде органического растворителя устраняет гидролиз эфиров. Хроматограмма стандартного образца 2,4,6-трихлорфенола ацетилированного трифторуксусным ангидридом по полному ионному току и масс-спектр представлены на рис. 5.
а 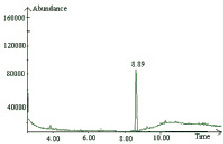 б
б 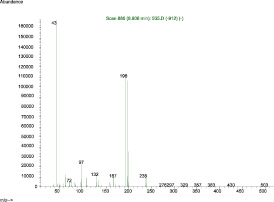
Рис. 5. а – хроматограмма стандартного образца 2,4,6-трихлорфенола, ацетилированного трифторуксусным ангидридом по полному ионному току 8,89 мин; б – масс-спектр трифторацетильного производного 2,4,6-трихлорфенола. Основной ион массой 294 и подтверждающие ионы 195 и 264
Получение трифторацетата 2,4,6-трихлорфенола улучшает его хроматографические характеристики (снижает температуру кипения, способствует симметричности пика) и увеличивает чувствительность (введение 3 атомов фтора) при определении галогенселективным детектором электронного захвата, что позволяет снизить предел обнаружения 2,4,6-трихлорфенола в 2 раза.
Выводы
Для определения хлорфенолов в крови предложен новый прием двухстадийной химической модификации, основанный на более эффективном использовании реакционной способности аналитов. Для дериватизации хлорфенолов на первой стадии предложено применять молекулярный бром (реакции электрофильного замещения), на второй – ацилирование полученных бромпроизводных в органическом экстракте ангидридом фторсодержащих карбоновых кислот. Для каждого исследованного соединения получены аналитические формы: 6-Бром 2,4-дихлорфенол, трифторацетат 2,4-дихлорфенол, 2,4,6-трихлорфенилтрифторацетат.
Высокая чувствительность газохроматографического анализа 2,4-дихлорфенола в крови на уровне 0,07–1,5 мкг/см3 при погрешности метода определения не более 25 % достигнута путем экстракционного концентрирования из биологической матрицы методом жидкостной экстракции в кислой среде, получения бромпроизводного 2,4-дихлорфенола (окисление молекулярным бромом) и ацилирования бромпроизводного в органическом экстракте ангидридом фторсодержащих карбоновых кислот в сочетании с оптимальными условиями пробоподготовки, хроматографирования, использованием капиллярной колонки DB-XLB 30 m×0,32 mm×0,50 µm и детектора электронного захвата (ДЭЗ).
Высокая чувствительность газохроматографического анализа 2,4,6-трихлорфенола в крови на уровне 0,04–0,8 мкг/см3 при погрешности метода определения не более 25 % достигнута путем получения производных 2,4,6-трихлорфенола по гидроксильной группе (этерефикации в среде органического растворителя) в сочетании с оптимальными условиями пробоподготовки, хроматографирования, использованием капиллярной колонки DB-XLB 30 m×0,32 mm×0,50 µm и детектора электронного захвата (ДЭЗ).
Хромато-масс-спектрометрическими исследованиями на стандартных образцах было подтверждено образование аналитических форм хлорфенолов: 6-Бром 2,4-дихлорфенол, трифторацетат 2,4-дихлорфенол, 2,4,6-трихлорфенилтрифторацетат на различных стадиях химической модификации.
Рецензенты:
Дегтев М.И., д.х.н., профессор кафедры аналитической химии Пермского государственного национального исследовательского университета; г. Пермь;
Зайцева Т.А., д.б.н., профессор кафедры охраны окружающей среды Пермского национального исследовательского политехнического университета; г. Пермь.
Работа поступила в редакцию 11.07.2013.



