4-Аминодифениламин (4-АДФА) является промежуточным продуктом при получении его алкилированных производных, используемых в качестве антиозонантов, антиоксидантов и стабилизаторов мономеров и различных полимерных материалов. К настоящему времени разработаны новые способы получения 4-АДФА, сущность которых состоит в конденсации нитробензола с анилином в щелочной среде в присутствии гидроксида тетраалкиламмония с образованием 4-нитродифениламина (4-NO2ДФА) и 4-нитрозодифениламина (4-NOДФА) и последующим их каталитическим гидрированием до 4-АДФА [1]. Основным недостатком этих способов являются большие потери гидроксида тетразамещенного аммония при его регенерации [3, 6].
Известны способы, в которых вместо дорогого и неустойчивого гидроксида тетраметиламмония (ГТМА) было предложено использовать хлорид тетраметиламмония (ТМАХ) [4], различные соли четвертичных аммонийных оснований [7] в сочетании с сильным основанием, комплексные катализаторы [8], состоящие из гидроксида тетраалкиламмония, гидроксида щелочного металла и соли тетраалкиламмония. Однако при использовании ГТМА и его солей в качестве компонентов комплексного катализатора стадии конденсации накладывает очень жесткие требования к поддержанию температурного режима на отдельных стадиях технологического процесса. Перегрев реакционной массы выше 80 °С ведет к существенному ускорению процессов разложения катализатора, образованию побочных продуктов и снижению селективности процессов конденсации и гидрирования.
Бочкарев В.В. с сотрудниками [5] разработали способ получения 4-АДФА взаимодействием анилина и нитробензола в присутствии высокоосновных анионитов с образованием 4-NO2ДФА и 4-NOДФА в качестве промежуточных продуктов. Последующее гидрирование указанных промежуточных продуктов после их выделения или непосредственно в реакционной массе в присутствии катализатора гидрирования приводит к получению 4-АДФА. В работе [2] показано, что использование полимерного катализатора при синтезе 4-АДФА исключает стадию его отделения от реакционной массы, снимает жесткие температурные и концентрационные ограничения на последующих стадиях процесса, повышает эффективность и значительно облегчает проведение процессов фазового разделения реакционной массы, регенерации щелочного раствора.
Цель исследования – определить эффективность гомогенного комплексного катализатора (ТМАХ-гидроксид натрия) и гетерогенных катализаторов (высокоосновных анионитов, содержащих четвертичную аммонийную группу ~–N(CH3)3+) реакции конденсации. Выявить особенности катализа высокоосновными анионитами процесса конденсации анилина с нитробензолом в щелочной среде.
Материалы и методы исследования
Нитробензол, гидроксид натрия использовались марки «х.ч.»; хлорид тетраметиламмония – «for synthesis» (Merck Schuchardt OHG). Анилин очищали перегонкой под вакуумом (~3 кПа) над цинковой пылью непосредственно перед использованием. В качестве катализаторов процесса конденсации нитробензола с анилином использованы комплексный катализатор ТМАХ-NaOH и сильноосновные аниониты АВ-17-8 ГОСТ 20301-74, Dowex Marathon MSA (Dow Chemical Co).
Методика проведения экспериментов (базовый опыт). В термостатированную при 25 ± 0,1 °С колбу загружали гидроксид натрия 0,03 (0,004...0,08) моля в виде 40 %-го водного раствора, анилин 0,057 (0,019...0,08) моля. Эту смесь растворяли в 20 см3 диметилсульфоксида (ДМСО) при перемешивании. После растворения щелочи в ДМСО в колбу добавляли ТМАХ 0,0125 моля или 12,5 (5...25) см3 анионита в OH-форме и нитробензол 0,0095 моля. Реакцию проводили в течение 6 ч. На протяжении всего опыта отбирали пробы и производили спектрофотометрический анализ реакционного раствора на содержание нитробензола и продуктов реакции.
Реакция анилина с нитробензолом в условиях 4...10-кратного избытка анилина подчиняется кинетическому уравнению реакции первого порядка. Наблюдаемую константу скорости определяли по тангенсу угла наклона зависимости 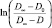 от времени, где D∞, D0 и D – предельное, начальное и текущее значение оптической плотности реакционного раствора при 580 нм. Спектры поглощения анилина, нитробензола, 4-NO2ДФА, 4-NOДФА и проб реакционного раствора записывали с помощью спектрофотометра Evolution 201 в кварцевых кюветах с толщиной слоя 1 см в диапазоне длин волн 220...600 нм.
от времени, где D∞, D0 и D – предельное, начальное и текущее значение оптической плотности реакционного раствора при 580 нм. Спектры поглощения анилина, нитробензола, 4-NO2ДФА, 4-NOДФА и проб реакционного раствора записывали с помощью спектрофотометра Evolution 201 в кварцевых кюветах с толщиной слоя 1 см в диапазоне длин волн 220...600 нм.
Результаты исследования и их обсуждение
При смешении анилина с нитробензолом в присутствии щелочи и катализатора наблюдалось окрашивание раствора в интенсивный красно-бурый цвет. Это обусловлено появлением в реакционном растворе основных продуктов реакции – солей 4-NO2ДФА и 4-NOДФА. Выход основных продуктов и селективность процесса зависит от многих факторов, и прежде всего от мольного соотношения анилина, щелочного агента и катализатора к нитробензолу, природы щелочного агента и катализатора, присутствия в реакционной массе воды, растворителей [1, 2, 8, 9]. С целью выяснения особенностей катализа высокоосновными анионитами процесса конденсации анилина с нитробензолом в настоящей работе нами была изучена кинетика этой реакции.
Особенностью гетерогенно-каталитических процессов в жидкой фазе является необходимость переноса реагентов из жидкой фазы к поверхности гетерогенного катализатора или продуктов реакции с поверхности катализатора в объем жидкой фазы. В зависимости от относительной скорости химической реакции, адсорбции и массопередачи существуют несколько областей протекания гетерогенно-каталитических процессов, различающихся кинетическими закономерностями и селективностью.
Как показали проведенные нами эксперименты с использованием высокоосновных анионитов, при числе оборотов мешалки более 100 об/мин скорость реакции не зависит от интенсивности перемешивания. Это свидетельствует о том, что внешняя диффузия не оказывает существенного влияния на скорость гетерогенно-каталитической реакции. Во всех дальнейших экспериментах скорость оборотов мешалки поддерживалась в диапазоне 150...250 об/мин.
На рис. 1 и 2 представлены экспериментальные зависимости величины наблюдаемой константы скорости от концентрации анилина и гидроксида натрия.
Обе представленные зависимости носят нелинейный характер, что характерно для сложных реакций. Следует отметить, что наблюдаемая константа скорости (см. рис. 1) в случае использования анионита Dowex Marathon MSA несколько выше, чем для АВ-17-8. Это, скорее всего, обусловлено более низкой динамической обменной емкостью анионита АВ-17-8 (0,695 г-экв/л) по сравнению с анионитом Dowex Marathon MSA (0,890 г-экв/л).
С целью определения эффективности использования анионита в качестве катализатора процесса конденсации анилина с нитробензолом нами были проведены сравнительные кинетические исследования процесса конденсации при использовании высокоосновных анионитов в OH-форме и каталитической системы ТМАХ – NaOH. На рис. 3 представлены экспериментальные зависимости наблюдаемой константы скорости от концентрации активных четвертичных аммонийных групп. Экспериментальные данные свидетельствуют, что при одинаковых концентрациях активных четвертичных аммонийных групп анионит АВ-17-8 в OH-форме по своей каталитической активности в исследуемой реакции ненамного уступает известной каталитической системе ТМАХ – NaOH. Активность макропористого анионита Dowex Marathon MSA при тех же условиях несколько выше активности гомогенного катализатора. При низких концентрациях катализатора (групп ~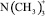 ) активность АВ-17-8 и Dowex Marathon MSA практически одинакова. При дальнейшем увеличении концентрации катализатора на зависимостях наблюдаемой константы скорости наблюдается максимум: для АВ-17-8 – при мольном отношении катализатор/нитробензол = 1; для Dowex Marathon MSA – при мольном отношении катализатор/нитробензол ≈ 2.
) активность АВ-17-8 и Dowex Marathon MSA практически одинакова. При дальнейшем увеличении концентрации катализатора на зависимостях наблюдаемой константы скорости наблюдается максимум: для АВ-17-8 – при мольном отношении катализатор/нитробензол = 1; для Dowex Marathon MSA – при мольном отношении катализатор/нитробензол ≈ 2.
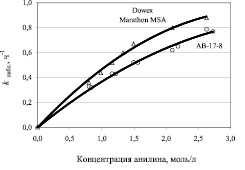
Рис. 1. Зависимость наблюдаемой константы скорости от начальной концентрации анилина. (Количество катализатора – 12,5 см3; количество гидроксида натрия – 0,0008 моля)
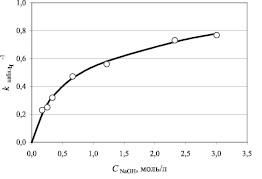
Рис. 2. Зависимость наблюдаемой константы скорости от концентрации гидроксида натрия. (Количество катализатора АВ-17-8 – 12,5 см3; количество анилина – 0,019 моля)
Данный факт можно объяснить следующим образом. С одной стороны – катализатор активирует молекулу анилина и таким образом должен ускорять процесс конденсации. С другой стороны – продукты конденсации 4-NO2ДФА и 4-NOДФА в виде анионов могут сорбироваться на активных центрах катализатора и увеличение количества катализатора (свыше эквимолярного по отношению к нитробензолу) должно приводить к снижению концентрации адсорбированных продуктов реакции и соответственно скорости диффузии продуктов реакции с поверхности катализатора в раствор. Для макропористого анионита Dowex Marathon MSA этот фактор менее значим, чем для гелевого анионита АВ-17-8. Все это позволяет полагать, что скорость процесса конденсации анилина с нитробензолом с использованием в качестве катализатора высокоосновных анионитов контролируется как кинетическими, так и внутридиффузионными факторами. Анализ экспериментальных данных показывает, что при использовании анионитов процесс контролируется внутренней диффузией продукта при мольном отношении катализатор/нитробензол > 1 для АВ-17-8 и мольном отношении катализатор/нитробензол > 2 для Dowex Marathon MSA. При практической реализации процесса конденсации анилина с нитробензолом рекомендуется использовать мольное отношение катализатор/нитробензол = 1.
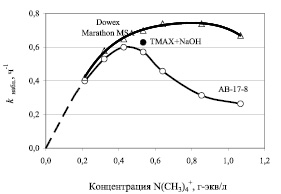
Рис. 3. Зависимость наблюдаемой константы скорости от концентрации четвертичных аммонийных групп. (Количество гидроксида натрия – 0,003 моля; количество анилина – 0,019 моля)
На основании имеющихся литературных данных по механизму реакции конденсации анилина с нитробензолом [9] мы можем предложить следующую схему процесса конденсации анилина с нитробензолом в щелочной среде в присутствии сильноосновных анионитов (Q+OH–):
 (1)
(1)
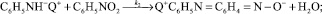 (2)
(2)
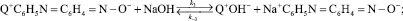 (3)
(3)
 (4)
(4)
где 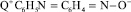 – сорбированный на активных центрах анионита анион 4-NOДФА;
– сорбированный на активных центрах анионита анион 4-NOДФА; 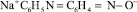 – анион 4-NOДФА в виде натриевой соли в растворе.
– анион 4-NOДФА в виде натриевой соли в растворе.
Предполагая, что стадии ионного обмена (1), (3), (4) протекают достаточно быстро и стадией, определяющей скорость процесса в целом, является реакция (2), выражение для скорости накопления продуктов конденсации в растворе (кинетическая область) будет следующее:
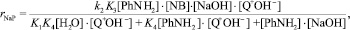
где PhNH2, NB – анилин и нитробензол соответственно; rNaP – скорость накопления продуктов конденсации в реакционном растворе.
Наличие знаменателя в вышеприведенном уравнении определяет нелинейные зависимости величины kнабл от концентраций анилина, гидроксида натрия и катализатора. По зависимостям 1/kнабл1/ от обратных концентраций катализатора (при мольном отношении катализатор/нитробензол < 1) и гидроксида натрия были определены значения k2×K3 = 2,7 ± 0,2 л/(моль×ч); K4 = 1,94 ± 0,08; K1 = 0,53 ± 0,06 для анионита АВ-17-8 и k2×K3 = 4,2 ± 0,1 л/(моль×ч) для анионита Dowex Marathon MSA.
Выводы
1. Установлено, что высокоосновные аниониты, содержащие четвертичную аммонийную группу 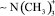 , по своей каталитической активности в реакции конденсации нитробензола с анилином в щелочной среде не уступают известной каталитической системе хлорид тетраметиламмония – гидроксид натрия.
, по своей каталитической активности в реакции конденсации нитробензола с анилином в щелочной среде не уступают известной каталитической системе хлорид тетраметиламмония – гидроксид натрия.
2. На экспериментальных зависимостях наблюдаемой константы скорости от концентрации активных четвертичных аммонийных групп наблюдается максимум: для анионита АВ-17-8 – при мольном отношении катализатор/нитробензол = 1; для анионита Dowex Marathon MSA – при мольном отношении катализатор/нитробензол ≈ 2. Это связано с переходом процесса из кинетической области во внутридиффузионную, в которой скорость контролируется внутренней диффузией продукта с активных центров анионита в раствор. При практической реализации процесса конденсации анилина с нитробензолом рекомендуется использовать мольное отношение катализатор/нитробензол = 1.
Работа выполнена в рамках государственного задания «Наука» по теме 3.2702.2011.
Рецензенты:
Ивашкина Е.Н., д.х.н., доцент кафедры химической технологии топлива и химической кибернетики, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск;
Коробочкин В.В., д.т.н., профессор, зав. кафедрой общей химической технологии Института природных ресурсов, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.


