Никель – один из немногих химических элементов, с которым мы встречаемся ежедневно и повсеместно. В большом количестве он считается весьма токсичным и может иметь негативные последствия для здоровья. Токсичность и физиологическая потребность в никеле зависит от химической формы его соединений, пути поступления в организм, дозы и длительности воздействия [1, 4]. Согласно классификации Международного агентства исследований рака (IARC), металлический никель (пыль) и гипосульфит никеля являются канцерогенами и опасны в концентрациях 0,0004–0,4 и 0,0001–0,1 мг/м3 соответственно. Предельно допустимые концентрации никеля в водоемах санитарно-бытового водопользования 0,1 мг/дм3, в почве – 4,0 мг/кг. Поэтому оценка содержания никеля в различных объектах очень актуальна.
Для определения никеля используют различные физико-химические методы анализа: спектро- и фотометрию, варианты хроматографии, атомно-абсорбционную спектрометрию [5, 8, 9].
Особое предпочтение аналитики отдают электрохимическим методам анализа, в частности, вольтамперометрии (ВА), т.к. данный метод сочетает высокие информационные возможности с простотой получения аналитического сигнала при невысокой стоимости самого оборудования [3]. Суть метода ВА заключается в способности Ni2+ накапливаться на поверхности электрода в виде малорастворимого соединения с последующим катодным восстановлением осадков при изменении потенциала. Аналитическим сигналом является величина катодного пика, которая пропорционально зависит от концентрации никеля.
В литературе, описывающей определение никеля в различных объектах методом ВА, значительная доля работ выполнена на ртутном или ртутно-пленочном электродах (РПЭ) [3, 6, 7]. Однако токсичность ртути, особенно трудности с ее утилизацией, ставят перед аналитиками задачи поиска электродов из нетоксичных материалов. Например, нанесение на поверхность металла или графита нетоксичных органических модификаторов.
В качестве таких модификаторов для определения неорганических веществ хорошо зарекомендовали себя соли арилдиазоний тозилата (ArN2+OTs–), которые нетоксичны, стабильны, хорошо растворимы в воде и многих органических растворителях. Авторы [2] предполагали, что в ходе модифицирования происходит ковалентное связывание функциональных групп Ar с поверхностью электрода, при этом выделяется азот и генерируются активные свободные радикалы Ar.
Нами были предложены серебряный и висмутовый электроды, модифицированные солями арилдиазоний тозилата (ArN2+OTs–) с –NH2 и –COOH группами в качестве заместителей.
Цель работы заключалась в выборе модификатора и способа получения органо-модифицированных электродов (ОМЭ) для вольтамперометрического определения никеля.
Измерения проводили на вольтамперометрическом анализаторе «СТА» («ИТМ», город Томск), в 3-электродной системе измерений: в качестве индикаторного электрода использовали модифицированные серебряный (МAgЭ) и покрытый пленкой висмута графитовый электроды (МВiЭ); вспомогательного и сравнительного – хлоридсеребряные электроды в растворе хлорида калия концентрации 1,0 моль/дм3. Аналитический сигнал Ni2 + на ВiЭ получали после удаления кислорода из фонового электролита, для этого через ячейку пропускали азот.
В качестве модификаторов использовали соли арилдиазоний тозилата с различными заместителями: –СООН, –NH2, –NO2.
Фоновым электролитом служила смесь 0,1 моль/дм3 раствора NH4Cl с добавкой 0,03 см3 0,1 моль/дм3 диметилглиоксима (ДМГ).
Основным раствором никеля являлся государственный стандартный образец (ГСО) состава растворов никеля с аттестованным значением массовой концентрации 1000,0 мг/дм3. Модельные смеси готовили из рабочих растворов. Рабочие растворы – аттестованные смеси (АС) получали последовательным разбавлением в бидистиллированной воде основного раствора никеля. Все остальные растворы готовили из реактивов марки ос.ч или х.ч. растворением в бидистиллированной воде.
Массовую концентрацию никеля рассчитывали по методу добавки АС ионов никеля в анализируемый раствор.
Для нанесения модификатора использовали два способа: погружение электрода на 5–7 с в раствор соответствующей соли арилдиазоний тозилата; электрохимическое накопление модификатора на поверхности электрода в течение 3–5 с, при потенциале Ен = 0,0 В. Полученный ОМЭ промывали в дистиллированной воде. Установлено, что высота пика тока и диапазон линейности градуировочного графика Ni2+ не зависит от способа модифицирования. Поэтому в дальнейшей работе модификатор на поверхность электрода наносили погружением. Для подтверждения наличия органических функциональных групп на поверхности модифицированного серебряного электрода получен его спектр отражения ИК. В спектре наблюдались полосы поглощения при 3659, 1685, 1590, 786 см–1, отвечающие карбоксильной группе и фенильному ядру.
Проведены исследования по выбору соли арилдиазония с целью применения в качестве модификатора и рабочих условий модифицирования (концентрация модификатора, время модифицирования). Установлено, что чувствительность определения никеля с использованием МAgЭ увеличивается в ряду МAgЭ–NO2 < МAgЭ–СООН < МAgЭ–NH2. Для МBiЭ сигнал получен только на МBiЭ–СООН. Поэтому для дальнейших исследований в качестве модификаторов выбраны соли арилдиазоний тозилата с –NH2 группой для AgЭ и –СООН группой для МBiЭ.
Вольтамперограммы, полученные при регистрации аналитических сигналов никеля на ОМЭ в модельных растворах, представлены на рис. 1 и 2.
Как видно из рис. 1 и 2, при добавке к фоновому электролиту (график 1) проб никеля на вольтамперограммах (график 2) наблюдаются пики при потенциалах Еп = (– 1,0 ± 0,05) В для МAgЭ–NH2 и Еп = (– 1,1 ± 0,05) для МBiЭ–COOH, которые от добавки АС увеличиваются пропорционально (график 3). Регистрацию катодных пиков осуществляли в дифференциально-импульсном режиме съемки вольтамперограмм при скорости развертки потенциала 27 мВ/с.
На примере получения МAgЭ–NH2 и МВiЭ–СООН проведены исследования влияния концентраций модификаторов и времени контакта электродов с растворами диазониевой соли на аналитический сигнал Ni2+. Экспериментально установлено, что концентрация диазониевых солей – 0,1 ммоль/дм3 и время экспозиции 3–10 с являются оптимальными условиями модифицирования, т.к. дальнейшее увеличение концентрации приводит к снижению аналитического сигнала Ni2+. Данный эффект можно объяснить образованием многослойных и менее прочных покрытий поверхности электрода органическими фрагментами при увеличении концентрации диазониевой соли.
Проведены исследования по выбору рабочих условий (потенциала и времени электролиза) получения аналитического сигнала Ni2+ на ОМЭ. Полученные результаты представлены в виде зависимостей пика тока от потенциала и времени накопления Ni2+ на ОМЭ (рис. 3 и 4).
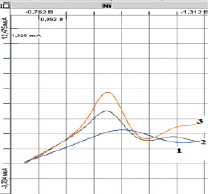
Рис. 1. Вольтамперограммы никеля на МAgЭ – NH2. Условия: Фон – 0,1 моль/дм3 NH4Cl + 0,1 моль/дм3 ДМГ; Ен = –0,7 В; τ = 30 с;1 – фоновой электролит; 2 – проба (С(Ni+2) = 0,01 мг/дм3); 3 – проба с добавкой АС (С(Ni+2) = 0,02 мг/дм3)
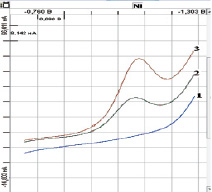
Рис. 2. Вольтамперограммы никеля на МBiЭ – COOH. Условия: Фон – 0,1 моль/дм3 NH4Cl + 0,1 моль/дм3 ДМГ + N2; Ен = –0,7 В; τ = 60 с;1 – фоновой электролит; 2 – проба (С(Ni+2) = 0,2 мг/дм3); 3 – проба с добавкой АС (С(Ni+2) = 0,04 мг/дм3)
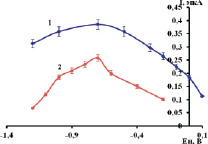
Рис. 3. Зависимость аналитического сигнала Ni2 + от потенциала накопления: 1 – МAgЭ –NH2; 2 – МВiЭ-СООН. Фон: 0,1 моль/дм3 NH4Cl + 0,1 моль/дм3 ДМГ, τ = 60 c, С(Ni 2+) = 1 мг/дм3
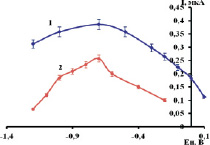
Рис. 4. Зависимость аналитического сигнала Ni2+ от времени накопления:1 – МAgЭ – NH2; 2 – МВiЭ-СООН. Фон: 0,1 моль/дм3 NH4Cl + 0,1 моль/дм3 ДМГ, Е = 0,7 В, С(Ni2+) = 1 мг/дм3
Как видно из рис. 3, максимальные значения тока пика для ОМЭ имеют одно значение потенциала накопления Ен = (–0,7 ± 0,05) В, которое было использовано в дальнейшей работе.
Как видно из рис. 4, максимальное время электролиза для МAgЭ–NH2 составляет 60 и 40 с для МВiЭ-СООН. Дальнейшее увеличение времени электролиза приводит к снижению аналитического сигнала. Возможно, данный эффект обусловлен положительной адсорбцией на границе раздела фаз.
На примере получения аналитического сигнала Ni+2 на МAgЭ–NH2 предложен возможный механизм реакции на поверхности электрода:
1. Модификация электрода
Ag0 + 2ArN2OTs → Ag(Ar)2adc + 2N2 + 2OTs–.
2. Концентрирование
Ni2+ + 2С4Н8N2O2 → [Ni(C4H7 N2O2)2]2– + 2H+,
Ag (Ar)2adc + [Ni(C4H7 N2O2)2]2 – – 2ē → Ag [Ar2Ni(C4H7 N2O2)2]adc
3. Растворение
Ag [Ar2Ni(C4H7 N2O2)2]adc + 2ē → Ag (Ar)2adc + [Ni(C4H7 N2O2)2]2–,
где Ar = n –C6H4 – NH2.
В ходе эксперимента получены градуировочные зависимости Ni2+ на различных электродах, которые представлены на рис. 5.
Как видно из рис. 5, максимальной чувствительностью и диапазоном измеряемых концентраций обладает РПЭ (рис. 5, график 1). Однако МAgЭ-NH2 (рис. 5, график 3) в малых диапазонах не уступает РПЭ, т.к. разница значения тока между ними находится в пределах ошибки измерения. В отсутствии серебряной подложки адекватной заменой может служить и МBigЭ-СООH (рис. 5, график 2).
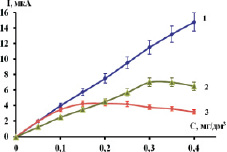
Рис. 5. Градуировочная зависимость Ni2+:1– РПЭ; 2 – МВiЭ-СООН; 3 – МAgЭ-NH2
В ходе исследований установлено, что определению Ni+2 не мешает 100-кратный избыток следующих элементов Fe, Zn, Hg и 30-кратный избыток Сu, Pb, Cd.
На основании экспериментальных данных предложены условия получения аналитического сигнала никеля на ОМЭ, которые представлены в таблице.
Рабочие параметры методики выполнения измерения никеля на ОМЭ
|
Параметры измерения |
Значения параметров для ОМЭ |
|
|
МAgЭ-NH2 |
МBiЭ-COOH |
|
|
Фоновый электролит |
0,1 моль/дм3 NH4Cl + 0,1 моль/дм3 ДМГ |
|
|
Удаление кислорода |
нет |
N2 |
|
Используемая система |
3-электродная |
|
|
Потенциал накопления (Ен), В |
–0,7 ± 0,05 |
|
|
Диапазон развёртки потенциалов (Ер), В |
от –0,7 до –1,3 |
|
|
Скорость линейного изменения потенциала (w), мВ/с |
27–30 |
|
|
Режим регистрации вольтамперограмм |
дифференциально-импульсной |
|
|
Потенциал пика (Еп), В |
–1,00 ± 0,05 |
–1,10 ± 0,05 |
Полученные результаты предполагается использовать при разработках методик количественного химического анализа различных объектов для определения никеля методом вольтамперометрии. При этом необходимо учитывать задачи, поставленные перед аналитиком. Например, при определении низких концентраций лучше использовать МAgЭ-NH2, т.к. диапазон определяемых концентраций для данного электрода лежит в пределах от 0,005 до 0,15 мг/ дм3, для более высоких концентраций предпочтительнее МBiЭ-COOH, но тогда необходимо удалять кислород из фонового электролита.
Работа выполнена в рамках государственного задания «Наука» по теме 3.2702.2011.
Рецензенты:
Слепченко Г.Б., д.х.н., профессор кафедры физической и аналитической химии, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск;
Короткова Е.И., д.х.н., профессор кафедры физической и аналитической химии, заместитель проректора-директора по научной работе и инновационному развитию института природных ресурсов, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.



