Ключевым источником энергии в организме млекопитающих является глюкоза, поступающая в кровь в основном в результате превращения углеводов, потребляемых с пищей. Существуют три пути трансформации глюкозы в организме:
1) немедленное включение в энергетический метаболизм;
2) превращение в гликоген для долгосрочного хранения;
3) превращение в жир [2].
Полное рассмотрение метаболизма глюкозы не входит в нашу задачу.
Уровень глюкозы в крови не постоянен – он регулируется многими гормонами, увеличиваясь и уменьшаясь в зависимости от потребностей организма. Основными регуляторами уровня глюкозы являются инсулин и глюкагон – гормоны поджелудочной железы. При повышении концентрации глюкозы в крови повышается секреция инсулина и снижается секреция глюкагона. Это происходит как непосредственно в результате стимулирующего влияния глюкозы на рецепторы клеток поджелудочной железы, так и опосредовано, путем активации парасимпатической нервной системы через глюкозочувствительные рецепторы в гипоталамусе. Кроме глюкагона, повышению уровня глюкозы в крови способствуют гормоны мозгового (адреналин, норадреналин) и коркового (глюкокортикоиды) вещества надпочечников [1, 3, 5].
В современной научной литературе значительное место отводится изучению циркадных и сезонных ритмов изменения уровня глюкозы в крови [4, 7]. Однако до настоящего времени остается открытым вопрос о показателях инфрадианных (многодневных) ритмов уровня глюкозы.
Целью настоящей работы было изучение инфрадианных ритмов уровня глюкозы у лабораторных грызунов – мышей BALB/c и крыс Вистар, выявление влияния на эти процессы пищевой депривации.
Материалы и методы исследования
Объектом исследований были половозрелые самцы мышей BALB/c (18–20 г) и крыс Вистар (масса 190–210 г), полученные из питомника «Столбовая». Животных содержали по 10 особей в клетке, в максимально стандартных условиях, изоляции от самок и один вид от другого. Клетки были расположены так, чтобы исключить возможное влияние зрительного, акустического и ольфакторного каналов передачи информации на синхронизацию активности между животными разных групп. В помещениях поддерживался фотопериод, характерный для естественного в Москве светового дня, и постоянная температура +24 °С. Эксперименты проводили с 1-го ноября по 2-е декабря 2011 г. с 10 до 11 ч. Все экспериментальные процедуры проводили в соответствии с регламентом использования лабораторных животных в ФГБУ «НИИ морфологии человека» РАМН, принятым и утвержденным комиссией по биоэтике.
Были сформированы следующие экспериментальные группы:
1) мыши BALB/c, получающие пищу ad libitum (n = 10);
2) мыши, подвергаемые в течение 20 сут периодической пищевой депривации (по 24 ч депривация и свободный доступ к пище), затем этих животных переводили на кормление ad libitum (n = 10);
3) крысы Вистар, получающие пищу ad libitum (n = 10).
У всех животных ежедневно измеряли уровень глюкозы в капиллярной крови, получаемой из области кончика хвоста (укол стерильной иглой), используя электрохимический биосенсор с автоматическим контролем установки диагностических полосок IME–DC (Германия), с ключом контроля для проверки системы. Прибор соответствует положениям директивы Европейского Сообщества IVDD (98/79/EC). Предварительно было проведено сравнение показателей прибора IME–DC с референтным глюкозооксидазным методом («Diagnostic Systems», Gmbh, Германия) определения уровня глюкозы в крови на 45 образцах, коэффициент корреляции 0.965.
В начале эксперимента и через 21 сут определяли массу тела мышей 1-й и 2-й групп.
Статистическую обработку данных проводили с помощью пакета программного обеспечения Statistica 6.0. (StatSoft Inc., США). В случае соответствия нормальному распределению значений показателей (Shapiro-Wilk’S test), применяли t-критерий Стьюдента для независимых выборок. В случае распределения, отличного от нормального, использовали непараметрический критерий U Манна–Уитни для сравнения несвязанных совокупностей. Для выявления периодов биоритмов вычисляли коэффициент автокорреляции. Ранговый корреляционный анализ проводили по методу Спирмена. Различия считались статистически значимыми при p < 0,05.
Результаты исследованияи их обсуждение
Изучение уровня глюкозы в крови у крыс Вистар с 1-го ноября по 2-е декабря 2011 г. позволило установить, что в период с 10 до 11 ч минимальные показатели уровня глюкозы в крови составляли 5,0, а максимальные – 7,7 ммоль/л. Средние величины показателей уровня глюкозы у крыс были меньше, чем у мышей, находящихся на таком же режиме питания (6.45 ± 0,11 и 7.47 ± 0,12 ммоль/л соответственно р < 0,01). У мышей BALB/c, получавших пищу ad libitum (1-я группа), показатели уровня глюкозы в крови не опускались ниже 5,0 и не поднимались выше 10,7 ммоль/л. В то же время у мышей, подвергавшихся пищевой депривации (2-я группа), минимальные показатели уровня глюкозы в крови на фоне лишения пищи достигали 2,5, а максимальные – 4,6 ммоль/л, а в дни получения пищи ad libitum – 7,2 и 11,3 ммоль/л соответственно. Примечательно, что в дни получения пищи ad libitum и после отмены пищевой депривации у этой группы мышей наблюдалось достоверно значимое увеличение уровня глюкозы по сравнению с 1-й группой животных (9,45 ± 0,39 и 7,47 ± 0,12 ммоль/л соответственно р < 0,01) (рисунок). При регистрации массы тела мышей BALB/c у сформированных 1-й и 2-й групп в начале эксперимента (19,21 ± 0,75 и 19,38 ± 0,8 г соответственно), а также через 21 сут у подвергавшихся и не подвергавшихся пищевой депривации, не выявлено статистически значимых отличий между группами (22,16 ± 1,11 и 22,68 ± 1,13 г соответственно).
У мышей и крыс наблюдались инфрадианные ритмы колебания уровня глюкозы в крови с периодом 6 сут (рисунок). Коэффициент автокорреляции со сдвигом 6 сут составил у мышей 0,55 (р < 0,005), а у крыс 0,41 (р < 0,05). Следует отметить, что инфрадианные ритмы животных разных видов – мышей и крыс, находящихся на одинаковом режиме питания (1-я, 2-я после отмены пищевой депривации и 3-я группы), совпадали по фазам и датам (рисунок).
У мышей 2-й экспериментальной группы в период чередования пищевой депривации с получением пищи ad libitum (по 24 ч, на протяжении 20 сут), инфрадианных ритмов колебания уровня глюкозы в крови выявить не удалось, однако сразу после восстановления свободного доступа к пище, проявились ритмы, аналогичные другим группам животных и совпадающие с ними по фазам и датам (рисунок).
Таким образом, в проведенном исследовании удалось выявить инфрадианные ритмы колебания уровня глюкозы с периодом 6 сут у мышей BALB/c и крыс Вистар. Примечательным является факт совпадения этих ритмов по календарным датам и фазе у животных разных видов, находящихся на обычном режиме питания. Этот факт, вероятнее всего, указывает на наличие внешнего синхронизатора, определяющего 6 сут периодичность колебания уровня глюкозы в крови. Установить природу такого синхронизатора в настоящее время не представляется возможным.
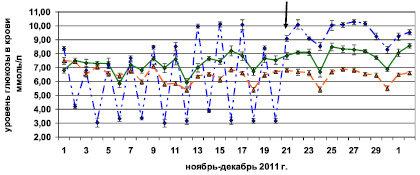
Инфрадианные ритмы колебания уровня глюкозы в крови крыс Вистар, интактных мышей BALB/c и мышей, подвергавшихся периодической пищевой депривации. По оси ординат – средние значения уровня глюкозы по группе за опыт в ммоль/л:синяя линия – мыши, подвергавшиеся периодической пищевой депривации;зеленая линия – интактные мыши; оранжевая линия – интактные крысы. Стрелкой указан день отмены пищевой депривации. За время эксперимента все значения уровня глюкозы в крови этих групп животных имели достоверно значимые различия p < 0,05
Известно, что пищевой режим является значительным синхронизатором для поведенческих, гормональных, метаболических параметров и параметров нервной системы. Ожидание пищи при изменении режима кормления и ограничении количества пищи повышает активность гипоталамуса у лабораторных грызунов, что обычно сказывается на показателях суточных ритмов [6, 8]. В наших экспериментах установлено, что длительная (на протяжении 20 сут) периодическая пищевая депривация не повлияла на период и фазу инфрадианных ритмов уровня глюкозы после восстановления обычного режима питания.
Обнаруженные нами отличия по уровню глюкозы в крови лабораторных грызунов характеризовались более низкими значениями у крыс, чем у мышей, кроме того, у мышей после отмены пищевой депривации показатели уровня глюкозы были выше, чем у животных того же вида, регулярно получавших пищу ad libitum.
Заключение
Проведено исследование уровня глюкозы в крови крыс Вистар и мышей BALB/c, во время которого регистрировали значения этого показателя в строго определенное время суток (с 10 до 11 ч) в течение 30 сут у животных при обычном содержании и кормлении, а также при воздействии такого десинхронизатора, как пищевая депривация. Отмечены межвидовые отличия по уровню глюкозы в крови, а также внутривидовые отличия у мышей BALB/c при свободном доступе к пище, пищевой депривации и после возвращения на обычный режим питания, отражающие особенности метаболизма глюкозы. В частности, у крыс уровень глюкозы в крови ниже, чем у мышей, кроме того, у мышей после отмены пищевой депривации – выше, чем у животных того же вида, регулярно получавших пищу ad libitum.
Колебания уровня глюкозы в крови мышей BALB/c и крыс Вистар, находящихся на обычном режиме питания, а также группы мышей после отмены пищевой депривации, носили инфрадианный характер с периодом 6 сут. Представляет интерес тот факт, что у этих видов лабораторных грызунов наблюдалось совпадение ритмов глюкозы по календарным датам и фазе. Периодическая пищевая депривация, проводимая в течение 20 сут и сопровождающая ее выработка условного рефлекса на наличие или отсутствие пищи, не повлияли на период и фазу инфрадианных ритмов уровня глюкозы после восстановления обычного режима питания мышей BALB/c.
Полученные данные послужат основанием для более точного установления коридора нормы колебаний уровня глюкозы в крови крыс Вистар и мышей BALB/c, дополнят сведения о закономерностях ритмических процессов, чувствительности организма млекопитающих к действию пищевого режима.
Рецензенты:
Болтовская М.Н., д.б.н., профессор, заведующая лабораторией клеточной иммунопатологии и биотехнологии ФГБУ «Научно-исследовательский институт морфологии человека» РАМН, г. Москва;
Гореликов П.Л., д.б.н., заведующий лабораторией нейроморфологии ФГБУ «Научно-исследовательский институт морфологии человека» РАМН, г. Москва.
Работа поступила в редакцию 06.06.2013.



