В 1913 году Н.Н. Аничков и С.С. Халатов создали экспериментальную модель атеросклероза у кроликов путем кормления их пищей, богатой холестерином, что позволило сформулировать комбинационно-инфильтрационную теорию патогенеза атеросклероза. Ее появление стало важной вехой в развитии учения о патогенезе этого заболевания и предопределило не только направление дальнейших работ Н.Н. Аничкова и созданной им научной школы, но и многих других отечественных и зарубежных исследовательских коллективов. Холестериновая модель атеросклероза выдержала испытание временем, и многочисленные исследования в разных странах, касающиеся тех или иных сторон патогенеза атеросклероза, выполнены и выполняются сегодня именно на этой модели [3, 4, 6]. Но только в работе Н.Н. Аничкова и С.С. Халатова (1912) было выяснено, что в развитии атеросклероза у кроликов в этих условиях опыта имеет значение содержащийся в продуктах холестерин. Н.Н. Аничкову и С.С. Халатову удалось воспроизвести изменения аорты, сходные с атеросклерозом человека, при введении кроликам с пищей чистого холестерина [7]. В настоящее время опыты с воспроизведением холестеринового атеросклероза у кроликов могут быть повторены в любой лаборатории. Подобный алиментарный способ получения атеросклероза у кроликов является общепризнанным завоеванием экспериментальной патологии, а сам эксперимент можно назвать классическим [8]. Одним из перспективных научных направлений методов лечения хронической (критической) ишемии нижних конечностей у больных, не являющихся кандидатами на хирургическую или эндоваскулярную реваскуляризацию, может стать терапевтический ангиогенез. Ангиогенез представляет собой сложный процесс, включающий серию событий, происходящих в строгой последовательности [9]. Интересы ангиологии сосредоточены на «терапевтическом ангиогенезе» – процессе, который направлен на лечение нарушений при недостаточной перфузии ткани путем стимуляции роста и арборизации кровеносных сосудов или модуляции функции эндотелия [10]. Хитозановые биополимеры не использовались до сих пор для реконструкции сосудистой стенки при локальном их введении. Общая закономерность биологического эффекта полимера хитозана выражается в деградации воспалительной реакции при любой локализации процесса как в месте дислокации полимера, так и в непосредственной близости от него. Сущность эффекта заключается в том, что при введении или имплантации хитозана или хитозансодержащих материалов в органы и ткани формируется электростатический и концентрационный градиенты для клеток, метаболитов и воды, приводящие к трансляции их в сторону полимера и к снижению воспалительной реакции в результате дренирующего эффекта как за пределами, так и в пределах его дислокации. Такое дренирование может объяснить морфологическую сохранность тканей в месте дислокации полимера и в непосредственной близости от него на фоне общих деструктивных воспалительных процессов в организме [12–15]. Предварительные исследования показали, что локальное введение хитозановых полимеров в гелевой форме у крыс и кроликов в фасциальные футляры задних конечностей приводит к локальному изменению характеристик в сосудистой стенке не только липидных фракций, но и клеточно-межуточного матрикса стенки магистральной артерии конечности [1, 2, 5, 11].
Цель исследования – разработать малоинвазивную технологию терапевтического ангиогенеза путем морфологической реконструкции стенки магистральных сосудов нижних конечностей при экспериментальном атерогенном процессе с помощью полисахаридных биополимеров.
Материалы и методы исследования
В исследование включены 36 кроликов породы Shinhilla, мужского пола, массой 3,5 ± 0,5 кг, животные были разделены на 6 групп, по шесть животных в каждой группе. С первой по третью группы входили животные, получавшие холестериновую диету (ХД) (ежедневно на протяжении всего эксперимента, 110 суток, 0,8 г холестерина на 1 кг массы тела в нерафинированном подсолнечном растительном масле, к воде доступ свободный), которым на 80-е сутки эксперимента в околососудистое фасциальное пространство магистральных артерий левой задней конечности в области голеностопного сустава с помощью инъекций помещался один из трех образцов биополимера полисахаридной природы, объемом 4 мл. С четвертой по шестую группы – животные, содержавшиеся на стандартном рационе вивария. Этим животным идентично в околососудистое фасциальное пространство магистральных артерий левой задней конечности в области нижней трети голени с помощью инъекций помещался один из трех образцов биополимера полисахаридной природы, объемом 4 мл.
Имплантируемые биополимеры:
группа 1 (6 кроликов, получавших ХД) – полиионный комплекс «Болхит» (изделие медицинского назначения (ИМН), содержащий 2 % хитозан молекулярной массы (Мм) от 100 до 700 kDa и степени дезацетилирования (СД) 95 %, на 1 г сухого хитозана ‒ аскорбиновую кислоту 1,8 г, хондроитинсерную кислоту – 10 мг, гиалуроновую кислоту (D- глюкуроновую) – 10 мг, сывороточный фактор роста крупного рогатого скота «адгелон» – 10 мкг, гепарин – 2,5 мг);
группа 2 (6 кроликов, получавших ХД) – 1 % гель сульфатированного водорастворимого хитозана (β1,4 D–глюкопиранозин–N–метил–сульфатил натрия), Мм 250 kDa, СД 85 %;
группа 3 (6 кроликов, получавших ХД) – 1 % гель хитозана аскорбата, Мм 700 kDa, СД 98 %;
группа 4 (6 кроликов, не получавших ХД) – полиионный комплекс «Болхит»;
группа 5 (6 кроликов, не получавших ХД) – 1 % гель хитозана сульфата (β1,4 D – глюкопиранозин – N – метил – сульфатил натрия), Мм 250 kDa, СД 85 %;
группа 6 (6 кроликов, не получавших ХД) –1 % гель хитозана аскорбата, Мм 700 kDa, СД 98 %.
Кролики с первой по третью группы в течение 110 дней получали ХД. На 1-е, 80-е, 100-е и 110-е сутки эксперимента всем группам животных было проведено измерение показателей микроциркуляции в трех точках на левой и правой задних конечностях (метод лазерной допплеровской флоуметрии, ЛАКК-02, Россия), а также забор крови для анализа липидного спектра. Подопытные животные были выведены из эксперимента на 110-е сутки. У всех групп был отпрепарирован комплекс мягких тканей бедра и голени обеих конечностей, включающий магистральный сосудисто-нервный пучок, для выполнения гистологических исследований. Образцы тканей после фиксации в забуференном растворе нейтрального формалина по общепринятой методике заключались в парафиновые блоки. Гистологическая проводка тканей, выполнение серийных срезов сосудисто-нервного комплекса и окраска проводились на автоматизированной системе Leica (Германия). Гистологические срезы для обзорного анализа окрашивались гематоксилином и эозином, а также суданом III. Морфометрическое исследование полученных срезов проводилось при помощи программы «JMicroVision 1.2.5». Светооптическое исследование и фотографирование микропрепаратов осуществляли на микроскопе “Axiostar” (Германия) при увеличении (х100, х200 и х400). Морфометрическое исследование полученных срезов сосудов проводилось при помощи программы «Image Tool»: сфотографированные в цифровом формате срезы (при увеличении х100 и х400) вводились в компьютер (операционная система Windows XP) в формате BMP и посредством копирования из буфера обмена анализировались данной программой. В отношении каждого случая производилось измерение определенного критерия в 5 срезах. Для морфометрической оценки артерий кроликов использовались следующие критерии: удельный объем просвета артерии (Vvпр); удельный объем стенки артерии (Vvст); удельный объем средней оболочки артерии (Vvм); коэффициент гладких миоцитов субинтимальной области (вычислялся как отношение численной плотности субинтимальных миоцитов к площади средней оболочки бедренной артерии); число сосудов в паравазальном пространстве, исключая крупные магистральные сосуды; наличие ксантомных клеток оценивалось в формате дихотомической переменной (да, нет).
Результаты исследования и их обсуждение
ХД в течение 80 дней вызывала у кроликов гиперлипидемию, о чем свидетельствует рост показателей липидного спектра в плазме крови кроликов по сравнению с интактными животными. При кормлении кроликов ХД в течение 80 дней происходило увеличение показателей общего холестерина в крови в 29 раз (с 0,77 ± 0,13 – у интактных животных до 22,95 ± 2,13 – при ХД), ТГ в 2,5 раза (с 1,68 ± 0,35 до 4,16 ± 0,91 соответственно), ЛПНП в 61 раз (с 0,33 ± 0,18 до 18,14 ± 1,55 соответственно), ЛПОНП в 2,4 раза (с 0,76 ± 0,16 до 1,89 ± 0,41), коэффициент атерогенности возрос в 7 раз (с 1,18 ± 0,72 до 10,95 ± 1,81 соответственно).
При имплантации в паравазальное пространство биополимеров (1 % геля хитозана аскорбата; 1 % сульфатированного водорастворимого хитозана) кроликам, содержавшимся в течение 110 суток на ХД, гистологическая картина в стенке левой бедренной артерии с наличием липидной фиброзной бляшки существенно отличается от таковой в артериях правых конечностей. Параллельно с процессами биологической деградации полимера отмечается резорбция компонентов бляшки под воздействием макрофагов, индуцированных имплантированным полимером (рис. 1).
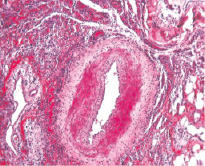
Рис. 1. Гистологический препарат бедренной артерии кролика, содержавшегося в течение 110-ти суток на ХД в условиях имплантации 1 % геля сульфатированного водорастворимого хитозана. Окраска гематоксилином и эозином. Х 200
В некоторых образцах средней трети левых бедренных артерий выявляется отек различной степени выраженности (от слабо выраженного до выраженного). В интиме правой бедренной артерии (между внутренней эластической мембраной и эндотелиоцитами) выявляются ксантомные клетки (рис. 2).
Численная плотность гладких миоцитов субинтимально и в медии снижается, липидная фиброзная бляшка уплотняется и уменьшается в размере. Характер и плотность распределения клеток средней оболочки во всех образцах был приблизительно одинаковым. В паравазальном пространстве артерии левой голени отмечается выраженная васкуляризация по сравнению с правой (рис. 3).
В случае, когда производилась имплантация биополимеров кроликам, которые содержались на стандартном рационе вивария, отличие заключается в том, что ни в одном из образцов не обнаружены ксантомные клетки, численная плотность гладких миоцитов правой и левой задних конечностей не отличается от интактных животных. Отмечается, что в паравазальном пространстве, как в случае имплантации на фоне ХД, наблюдается выраженная васкуляризация в левой голени по сравнению с правой.
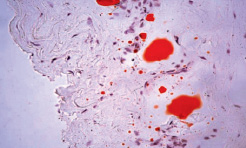
Рис. 2. Гистологический препарат бедренной артерии кролика, содержавшегося в течение 110-ти суток на ХД в условиях имплантации 1 % геля сульфатированного водорастворимого хитозана. Окраска судан III. Х 400
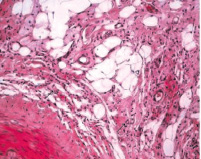
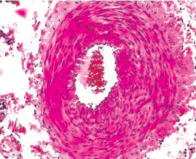
Рис. 3. Гистологические препараты бедренных артерий кролика, содержавшегося в течение 110-ти суток на ХД в условиях имплантации 1 % геля сульфатированного водорастворимого хитозана. Окраска гематоксилином и эозином:а – выраженная васкуляризация паравазального пространства левой конечности Х 400; б – отдельные кровеносные сосуды в виде капилляров и венул в паравазальном пространстве правой конечности. Окраска гематоксилином и эозином. Х 200
Анализ показывает, что удельный объем сосудистой стенки артерии голени интактных животных на 39 % меньше, чем у кроликов, которые в течение 110 суток получали ХД, и составляет соответственно 50,17 ± 5,80 % против 82,04 ± 8,10 % (р < 0,05). Этот морфометрический показатель достоверно уменьшается соответственно на 27 и 15,2 % при имплантации в паравазальное пространство левой голени кроликов, получавших ХД, 1 % геля сульфатированного водорастворимого хитозана (60,12 ± 3,58 %) и 1 % геля хитозана аскорбата (70,29 ± 8,86 %) по сравнению с правой конечностью – 82,46 ± 7,65 % (биополимер не вводился) (р < 0,05) (рис. 4).
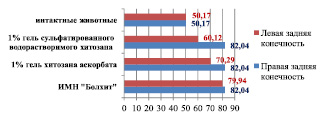
Рис. 4. Удельный объем сосудистой стенки голени интактных животных и кроликов, получавших ХД, после имплантации различных биополимеров (110-е сутки эксперимента)
Имплантация исследуемых биополимеров в паравазальное пространство голени кроликам, содержавшимся на стандартном рационе вивария, не приводит к достоверному уменьшению удельного объема сосудистой стенки артерии голени. Однако следует отметить, что прослеживается явная тенденция уменьшения этого показателя при имплантации 1 % геля сульфатированного водорастворимого хитозана и 1 % геля хитозана аскорбата по сравнению в конечностью, в которую биополимер не вводился.
Холестериновая диета в течение 110 суток приводит к достоверному уменьшению на 40 % удельного объема просвета артерии правой голени (16,47 ± 2,48 %) по сравнению с интактными животными (27,69 ± 4,65 %) (р < 0,05). При сравнении между собой этого морфометрического показателя левой и правой голени подопытных животных выявлено, что имплантация 1 % геля сульфатированного водорастворимого хитозана приводит к его увеличению в левой голени на 87 % и составляет 30,87 ± 3,4 %.
Анализ показывает, что удельный объем медии артерии голени интактных животных на 34 % меньше, чем в голени правой конечности кроликов, которые в течение 110 суток получали холестериновую диету и составляет соответственно 50,86 ± 5,68 % против 76,82 ± 4,71 % (р < 0,05). Этот морфометрический показатель достоверно уменьшается на 22 % при имплантации в паравазальное пространство левой голени кроликов, получавших ХД, 1 % геля сульфатированного водорастворимого хитозана (60,13 ± 3,22 %) по сравнению с правой конечностью – 76,82 ± 4,71 %, р < 0,05. Следует отметить, что нахождение в течение 30 суток в околососудистом пространстве 1 % геля хитозана аскорбата и ИМН «Болхит» приводит к явной тенденции к уменьшению удельного объема медии артерии голени левой конечности по сравнению с правой, хотя статистически эти показатели неразличимы р > 0,05 (рис. 5).
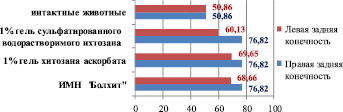
Рис. 5. Удельный объем медии голени интактных животных и кроликов, получавших ХД, после имплантации различных биополимеров (110-е сутки эксперимента)
Холестериновая диета в течение 110 суток приводит к увеличению на 64 % коэффициента субинтимальных миоцитов артерии правой голени (85,56 ± 9,34) по сравнению с интактными животными (52,09 ± 7,04), р < 0,05. При сравнении данного морфометрического показателя левой и правой голени подопытных животных выявлено, что имплантация 1 % геля сульфатированного водорастворимого хитозана приводит к его уменьшению в левой голени на 27 % и составляет 62,76 ± 4,71 по сравнению с правой – 85,56 ± 9,34, р < 0,05 (рис. 6).
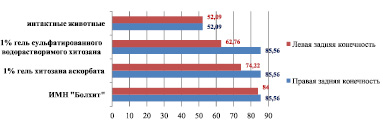
Рис. 6. Коэффициент субинтимальных миоцитов голени интактных животных и кроликов, получавших ХД, после имплантации различных биополимеров (110-е сутки эксперимента)
На 110-е сутки холестериновой диеты (ХД) после имплантации 1 % геля аскорбата хитозана и 1 % геля сульфатированного водорастворимого хитозана происходит достоверное увеличение количества сосудов паравазального пространства голени (непосредственная локализация биополимера) по сравнению с конечностью, в которую биополимер не вводился. При имплантации 1 % геля аскорбата хитозана этот показатель увеличивается в левой конечности по сравнению с правой на 66 % и составляет соответственно 30,67 ± 5,89 против 18,42 ± 3,92 (р < 0,05). Дислокация 1 % сульфатированного водорастворимого хитозана в фасциальном ложе магистральной артерии в течение 30 суток приводит к увеличению количества сосудов паравазального пространства на месте деградации полимера на 56 %. В левой конечности этот параметр равен 28,75 ± 3,11, а в правой – 18,42 ± 3,92 (р < 0,05) (рис. 7).
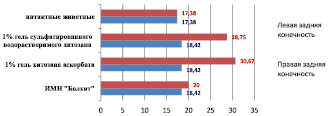
Рис. 7. Количество сосудов паравазального пространства голени интактных животных и кроликов, получавших ХД, после имплантации биополимеров (110-е сутки эксперимента)
Анализ показывает, что на 30-е сутки после имплантации 1 % геля аскорбата хитозана и 1 % сульфатированного водорастворимого хитозана кроликам, содержавшимся на стандартном рационе вивария, происходит достоверное увеличение количества сосудов паравазального пространства голени (на месте резорбции хитозановой конструкции) по сравнению с конечностью, в которую биополимер не вводился. При имплантации 1 % геля аскорбата хитозана этот показатель увеличился в левой конечности по сравнению с правой на 88 % и составил соответственно 23,3 ± 3,45 против 12,38 ± 2,03 (р < 0,05). Дислокация 1 % сульфатированного водорастворимого хитозана в течение 30 суток приводит к увеличению количества сосудов паравазального пространства в месте дислокации в 2,1 раза. В левой конечности этот параметр равен 26,0 ± 4,21, а в правой – 12,38 ± 2,03 (р < 0,05) (рис. 8).
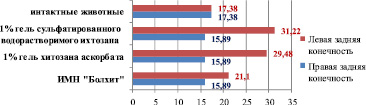
Рис. 8. Количество сосудов паравазального пространства голени интактных животных и кроликов, не получавших ХД, после имплантации биополимеров (110-е сутки эксперимента)
Реконструкция паравазального пространства вышележащих сегментов артерии, не контактировавших с биополимерной «рубашкой», не происходит, что указывает на строго локальный эффект терапевтического ангиогенеза.
Холестериновая диета в течение 80 суток приводит к уменьшению показателя микроциркуляции (ПМ) во всех исследуемых точках по сравнению с животными, получавшими стандартный рацион вивария. В точке 1, которая расположена в области паховой складки, этот показатель у кроликов, получавших ХД, составляет 2,79 ± 0,33 перф.ед., а у интактных – 5,32 ± 0,56 перф.ед, (р < 0,05). В точке 2, расположенной чуть ниже коленного сустава, где непосредственно располагался биополимерный имплантат, у животных с ХД ПМ составлял 3,43 ± 0,35 перф.ед., у кроликов без ХД – 7,88 ± 0,78 перф.ед., р < 0,05. Это указывает на то, что ХД в течение 80-ти суток приводит к достоверному уменьшению ПМ соответственно в точке 1 на 48 %, а в точке 2 – на 56 %. Результаты исследования величин артериальной перфузии тканей показывает, что локализация 1 % геля сульфатированного водорастворимого хитозана в паравазальном пространстве голени кроликов, получавших ХД, в течение 20-ти суток приводит к увеличению ПМ в точке 2 левой задней конечности на 80 % по сравнению с исходным уровнем и на 86 % по сравнению с сегментом правой конечности и составляет соответственно 6,16 ± 0,51 перф.ед. против 3,43 ± 0,35 и 3,31 ± 0,53 перф.ед., р < 0,05. Через 30 суток после имплантации биополимера (110-е сутки ХД) происходит снижение ПМ как в левой задней конечности, так и в правой, но в левой он остается выше на 34 %, чем в правой и составляет соответственно 4,36 ± 0,25 перф.ед. против 3,25 ± 0,29 перф.ед., р < 0,05. Показатель микроциркуляции в точке 2 левой задней конечности у животных, не получавших ХД, также возрастал после имплантации указанного биополимера: на 20-е сутки – на 26 % (составляет соответственно 9,70 ± 0,27 перф.ед. против 7,67 ± 0,34 перф.ед., р < 0,001), на 30-е сутки на 31 % (составляет соответственно 9,87 ± 0,45 перф.ед. против 7,52 ± 0,61 перф.ед., р < 0,05) (рис. 9).
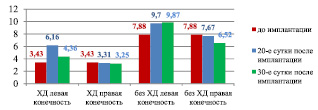
Рис. 9. Изменения показателя микроциркуляции задних конечностей кроликовв точке 2 под влиянием 1 % геля сульфатированного водорастворимого хитозана
Анализ показывает, что дислокация 1 % геля аскорбата хитозана в паравазальном пространстве голени кроликов, получавших ХД, в течение 20-ти суток приводит к увеличению ПМ в точке 2 левой задней конечности на 68 % по сравнению с правой и составляет соответственно 5,64 ± 0,76 перф.ед. против 3,36 ± 0,63 перф.ед., р < 0,05. С момента имплантации этого биополимера в течение 20 суток в мягких тканях левого сегмента задней конечности возрастает ПМ с 3,43 ± 0,35 до 5,64 ± 0,76 перф.ед., что составляет 64 %. Через 30 суток после имплантации биополимера (110-е сутки ХД) происходит снижение ПМ как в левой задней конечности, так и в правой, но в левой он остается на 36 % выше, чем в правой и составляет соответственно 4,41 ± 0,59 перф.ед. против 3,24 ± 0,60 перф.ед., р < 0,05. По сравнению с началом имплантации уровень перфузии мягких тканей через 30 суток в левом сегменте превышает на 28 %. Показатель микроциркуляции в точке 2 левой задней конечности у животных, не получавших ХД, также увеличивается после имплантации указанного биополимера по сравнению с правым сегментом: на 20-е сутки – на 41 % (составляет соответственно 9,89 ± 0,54 перф.ед. против 6,99 ± 0,34 перф.ед., р < 0,005), на 30-е сутки – на 38 % (составляет соответственно 9,77 ± 0,19 перф.ед. против 7,08 ± 0,58 перф.ед., р < 0,05)(рис. 10).
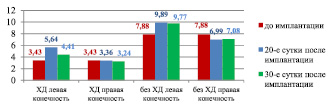
Рис. 10. Изменения показателя микроциркуляции задних конечностей кроликов в точке 2 под влиянием 1 % геля аскорбата хитозана
Заключение
Использование холестериновой диеты у кроликов породы шиншилла в течение 80–110 дней обеспечивает увеличение в плазме крови в 1,5–2,5 раза уровня триглицеридов, в 30–90 раз уровня холестерина, в 29–56 раз и выше уровня фракции ЛПНП, в 2,5–5 раз уровня фракции ЛПОНП, формирует очень высокий коэффициент атерогенности. Высокий уровень гиперлипидемии у животных соответствует высокому уровню липидных фракций в тканях сосудистой стенки магистральных артерий и превышает в бедренных артериях уровень общих липидов в 3 раза, триглицеридов – в 2,5 раза, формируя в интиме скопления ксантомных клеток. Введение в паравазальное пространство магистральной артерии гелевой формы сульфатированного хитозана и кислых протонированных его форм стимулирует новообразование микрососудистого ложа на месте резорбции полимеров, увеличивая число новых сосудов у кроликов на 56–66 %. Более высокий эффект терапевтического ангиогенеза ясно прослеживается и при имплантации хитозановых конструкций в ткани интактного животного, составляя прирост через 30 дней постимплантационного периода 96 %. Малоинвазивная реконструкция биополимерами магистральных артерий на примере кроликов, заключающаяся в снижении удельного объема сосудистой стенки за счет снижения удельного объема медии и коэффициента субинтимальных миоцитов, в увеличении просвета сосуда и росте числа микрососудов паравазального ложа, обеспечивает локальное увеличение перфузии мягких тканей конечности через 20 дней после имплантации в среднем на 68–86 %. Через 30 дней постимплантационного периода величина перфузии снижается, но превышает по сравнению с контрольной зоной на 34–36 % перфузионных единиц.
Рецензенты:
Сухоруков А.М., д.м.н., профессор НИИ медицинских проблем Севера СО РАМН, г. Красноярск;
Зыкова Л.Д., д.м.н., профессор кафедры патологической анатомии, ГБОУ ВПО «КрасГМУ им. проф. В.Ф. Войно-Ясенецкого», г. Красноярск.
Работа поступила в редакцию 30.05.2013.



