В современных условиях разработка лекарственных препаратов возможна только при теоретически и экспериментально обоснованном процессе планирования и проведения исследований. Большинство экспериментаторов самостоятельно строят план исследовательской работы при создании лекарственного препарата. Такой подход рассчитан на высокую квалификацию специалиста как в области разработки лекарственных препаратов, так и в смежных областях, что при современном объеме информации не всегда достижимо. Огромный спектр требований и этапов разработки лекарственного препарата обусловливает необходимость привлечения высококвалифицированных специалистов различного профиля, владеющих информацией в своей области исследований и разнообразными методиками ведения эксперимента, способных при этом к ассоциативному аналитико-синтетическому мышлению. Оптимизировать исследования по созданию лекарственных препаратов позволяет методологический подход к фармацевтической разработке. В настоящее время предложены методологии разработки лекарственных препаратов следующих видов действия: противоопухолевого [11], с иммунобиологический и адсорбционной активностью [14], для коррекции некоторых патологий кровообращения, дефицита магния и фтора [8], для лечения раневых и воспалительных процессов на основе местноанестезирующего средства анилокаина [1], противомикробных средств со спермицидной активностью [9], для коррекции сахарного диабета и его осложнений при метаболическом синдроме [12].
Анализ литературы и данных собственных исследований позволили сформировать общий алгоритм методологического подхода, в котором можно выделить ряд последовательных блоков исследований: информационно-поисковый, исследовательский, стандартизационно-фармакологический, клинический, внедрение в производство. Наиболее разработанными и регламентированными являются этапы стандартизационно-фармакологический (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, под ред. Р.У. Хабриева, 2005), клинический (ГОСТ Р 52379-2005 «Надлежащая клиническая практика»), внедрения в производство (ГОСТ 52249-2009 «Правила производства и контроля качества лекарственных средств», ОСТ 91 500.05.001–00 «Стандарты качества лекарственных средств. Основные положения»). Вместе с тем в «Руководстве..» под ред. Р.У. Хабриева представлены методики для изучения наиболее распространенных фармакологических эффектов, что обусловливает необходимость создания моделей для исследования фармакологических действий, не включенных в Руководство. Отсутствие лекарственных препаратов для местной терапии ожогов пищевода, модели для исследования фармакологического эффекта и показателей качества для лекарственных препаратов данной направленности обусловили актуальность нашей работы.
Цель работы – экспериментально-теоретическое обоснование алгоритм-схемы разработки лекарственных препаратов для местной терапии ожогов пищевода.
Материалы и методы исследования
При выполнении исследований по разработке экспериментальных препаратов для местной терапии ожогов пищевода были использованы лекарственные средства: метронидазол (ФС 42-0257-07), метилурацил (ФС 42-0256-07), преднизолон (ФС 42-2779-91), лидокаина гидрохлорид (ФС 42-0251-07), гиалуронидаза (ФС 42-2606-93); вспомогательные вещества: регенкур (ФС 42-3395-97), крахмал, глицерин, натрия сахаринат, фруктоза, стевиозид, ароматизаторы, идентичные натуральным.
В процессе разработки экспериментальных препаратов микробиологические исследования проведены на 24 тест-микробах методом диффузии в агар и методом прямого контакта [7], реологические параметры установлены на ротационном вискозиметре NDJ-1 «Comecta» (Испания), высвобождение лекарственных веществ из композиции изучены методом диализа [2].
Экспериментальные препараты в форме порошка и гранул для приготовления суспензий анализировали согласно ГФ ХI, вып. 2, статьи «Порошки», «Гранулы» и «Суспензии», а также по показателям «сыпучесть» на вибрационном устройстве марки ВП-12А и «насыпная масса» на вибрационном уплотнителе 545Р-АК-3. Микроскопическим методом определяли размер частиц твердой фазы в готовой суспензии. Подлинность оценивали с помощью химических реакций. Испытание на стерильность проводили на базе Барнаульского филиала ФГУЗ «Федеральный центр гигиены и эпидемиологии по железнодорожному транспорту» (Протоколы лабораторных исследований № 3740 и № 3741 от 27 апреля 2011) в соответствие с требованиями ГФ XII, ОФС 42-0066-07 «Стерильность». Статистическую обработку экспериментальных данных осуществляли с использованием программ Statistica 6.1 и Microsoft Excel. Результаты исследований (Р = 95 %) обрабатывали при помощи критерия Стьюдента по стандартным методикам ГФ XII изд.
Количественное содержание действующих веществ устанавливали на микроколоночном жидкостном хроматографе МилиХром А–02 (ЗАО «Институт хроматографии «ЭкоНова», г. Новосибирск), с УФ-детектором, колонкой 2×7,5 мм и сорбентом ProntoSIL-120-5-С18 (размер частиц 5 мкм). Результаты исследования обрабатывали с использованием программы «МультиХром» для «Windows» [3].
Фармакологические исследования проводили на 24 кроликах породы «Шиншилла» обоего пола в возрасте 1,5–2 месяцев массой тела 1,0–1,5 кг, на кожной модели химического ожога. Морфометрические показатели определяли с использованием графического пакета AxioVision 4.7LE (Carl Zeiss, Germany). Оценку межгрупповых различий осуществляли по критерию Дана или по критерию Даннетта. При статистической обработке результатов морфометрического исследования использовали компьютерную программу SigmaStat 3.5 для Windows, Systat Software, Inc. [4].
Результаты исследования и их обсуждение
На этапе информационного поиска была выявлена потребность в лекарственных препаратах для местной терапии ожогов пищевода, сформулированы цель и задачи исследования, проведен анализ литературных источников по данной патологии и историй болезни больных. Анализ полученных данных показал, что основным этиологическим фактором является случайный (дети) или суицидальный (взрослые) прием средств бытовой химии на основе натрия гидроксида, уксусной кислоты, соляной или серной кислот, при этом особенностью ожога пищевода является наличие одновременно участков ожога всех степеней поражения. Сравнительная характеристика послойного строения кожи и пищевода показала, что для терапии ожогов пищевода применим дифференцированный подход к лечению раневого процесса [13]. Обобщение полученной информации позволило сформулировать требования к лекарственным препаратам для местной терапии ожогов пишевода для фазы воспаления: местноанестезирующее действие в связи с выраженным болевым синдромом, противовоспалительный эффект, антимикробная активность; и для II-III фаз патологического процесса: выраженный регенерирующий эффект, антипролиферативное действие для уменьшения образования грубой соединительной ткани на месте ожога и профилактики развития рубцовых деформаций, антимикробная активность для профилактики наслоения вторичной инфекции, которые дополнены требованиями к лекарственной форме: достаточная вязкость для обеспечения более длительного нахождения на пораженной поверхности слизистой пищевода; оптимальные органолептические свойства (коррегирование вкуса и запаха); удобство приема для больного [4, 5].
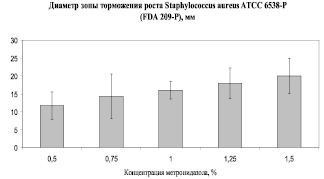
Рис. 1. Антимикробная активность состава № 2 (содержание полимера 2 % для улучшения контакта композиции с агаром)
На втором этапе (исследовательском) осуществляли оптимизацию качественного и количественного состава композиций, разработку рациональной технологии, определение показателей качества. Важным фактором, который учитывали при создании лекарственных препаратов для местной терапии ожогов пищевода, являлось не только местное действие на ткани пищевода, но и поступление комплекса лекарственных и вспомогательных веществ в желудочно-кишечный тракт. В связи с этим кроме выбора концентрации метронидазола микробиологическим методом (рис. 1) и обоснования концентраций лидокаина, преднизолона и метилурацила, проводили расчет оптимальных количеств лекарственных веществ в составе лекарственной формы с учетом средней массы тела ребенка (таблица).
Расчет количества лекарственных веществ в лекарственной форме для детей в возрасте 4–5 лет (прием 8 раз в сутки по 5,0)
|
Лекарственное вещество |
Суточная терапевтическая доза, г |
Разовая терапевтическая доза, мг |
Содержание в 100,0 лекарственной формы, г |
|
Метронидазол |
0,3 |
37,5 |
0,75 |
|
Лидокаин |
0,04 |
5 |
0,1 |
|
Преднизолон |
0,02 |
2,5 |
0,05 |
|
Метилурацил |
0,75 |
100 |
2,0 |
|
Гиалуронидаза |
51,2 ед. |
6,4 ед. |
128 ед. |
На данном этапе исследований выбирали вспомогательные вещества (полимеры, корригенты) по технологическим, микробиологическим, биофармацевтическим и реологическим параметрам, принимая во внимание тот факт, что лекарственная форма должна дозироваться ложками, при проглатывании задерживаться в пищеводе и обладать адекватными органолептическими свойствами. Вязкость экспериментальных препаратов обеспечивали за счет гидрофильных полимеров, разрешенных к медицинскому применению. Комфортность приема достигали включением в составы композиций подсластителей, таких как натрия сахаринат, стевиозид, фруктоза, а также корригентов вкуса и запаха: ароматизатора «клубника», идентичного натуральному, масла лимона или масла сладкого апельсина [10]. Разработанные составы для фаз воспаления и роста грануляций ожогового процесса запатентованы [15]. На основании данных экспериментальных исследований разработана оптимальная технология. При прогнозировании сроков годности было установлено, что разработанные составы, представляющие собой суспензионно-гелевые композиции, имеют небольшой срок годности (10 суток) в связи с большим содержанием жидкой фазы. Известно, что более длительному хранению подлежат «сухие» суспензии, к которым добавляют необходимое количество растворителя перед применением. «Сухие» суспензии чаще всего изготавливают в виде гранул или порошков для суспензий. На основании проведенных технологических исследований в качестве рациональной лекарственной формы выбран порошок для приготовления суспензии, разработана технология, определены особенности упаковки и хранения [6].
Стандартизационно-фармакологический этап разработки лекарственных препаратов является наиболее универсальным для большинства групп лекарственных препаратов. На данном этапе установлены критерии оценки качества экспериментальных препаратов в форме порошка для приготовления суспензии: описание, размер частиц твердой фазы в готовой суспензии, влажность, подлинность, количественное определение лекарственных веществ, стерильность. ВЭЖХ-методики количественного определения метронидазола, преднизолона, лидокаина гидрохлорида, метилурацила, входящих в составы экспериментальных препаратов, валидированы. Результаты проведенных исследований использованы при разработке проектов ФСП и лабораторных регламентов на предложенные препараты «Премелтоп» и «Ремелтоп» [3, 6].
Как свидетельствуют данные фармакологических исследований, разработанные препараты наряду с необходимой вязкостью и адекватными органолептическими свойствами обладают выраженным благоприятным влиянием на процесс заживления химического ожога, что должно обеспечить их успешное использование в клинике для лечения химических ожогов пищевода и желудка (рис. 2) [4].
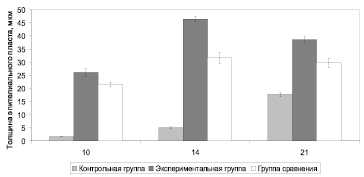
Рис. 2. Динамика регенерации эпителиального пласта (M ± m, мкм)
Таким образом, на основании обобщения экспериментальных данных и анализа научных источников выделены основные этапы разработки и сформирована алгоритм-схема (рис. 3), которая используется как основа методологии создания лекарственных препаратов для терапии ожогов пищевода.
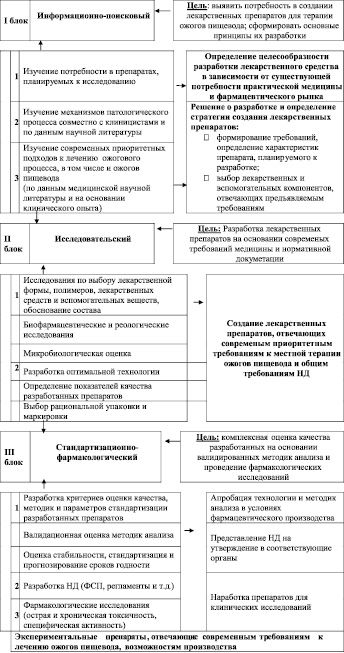
Рис. 3. Алгоритм-схема разработки лекарственных препаратов
Рецензенты:
Карабинцева Н.О., д.фарм.н., профессор, зав. кафедрой фармацевтической технологии и биотехнологии, ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России, г. Новосибирск;
Беляев М.К., д.м.н., профессор кафедры детской хирургии, ГБОУ ДПО «Новокузнецкий государственный институт усовершенствования врачей» Минздрава России, г. Новокузнецк.
Работа поступила в редакцию 07.06.2013.



