Биосинтез глицеролипидов пластично регулируется у бактерий E.coli в зависимости от изменений окружающей среды (Zhang and Rock, 2008). При стрессовых условиях, таких как температурное нагревание, происходит увеличение текучести мембраны (De Mendoza et al., 1983). Для предотвращения критичного состояния клетки синтезируют липиды с жирными кислотами с более длинной углеродной цепью и полностью насыщенными. Кроме того, регулируется также и асимметрия липидов в мембране. Известно, что количество фосфатидной и лизофосфатидной кислоты (ЛФК) увеличивается при повышении температуры инкубации клеток бактерий. Было показано, что их содержание коррелирует с образованием мицелл (Kooijman et al., 2005). Вероятно, данный механизм несет защитную функцию для мембранных белков, которые с помощью мицелл солюбилизируются в цитоплазму. Кроме того, упаковка в мицеллы мембранных белков является способом транспорта в гидрофильной среде. Лизофосфатидная кислота присутствует в нормальных условиях в мембране E.coli в пределах 0,1–0,5 % от общего содержания глицерофосфолипидов. Несмотря на малую концентрацию, играет важную роль в клеточных процессах, в частности, в образовании мицелл, вероятно, за счет содержания одного липофильного «хвоста», что несет возмущающее, дестабилизирующее действие на жидкокристаллическую липидную бислойную структуру (Mouritsen, 2011).
Упаковка мембранных белков при их избытке в мицеллы или при стрессовых условиях могла бы способствовать их сохранению и транспортировке. Таким образом, увеличение количества лизофосфатидной кислоты в мембране при одновременной сверхпродукции мембранных белков позволит подтвердить или опровергнуть данную гипотезу.
Материалы и методы исследования
Материалы
[32Р]-фосфорная кислота получена от Amersham, изопропил-β-D-тиогалактопиранозид от Sigma. Пластинки для тонкослойной хроматографии от Merck и Whatman, гели и буферы для электрофореза от Bio-Rad, набор для хемилюминесцентной реакции для Вестерн-блота от Thermo Fisher Scientific.
Штаммы и плазмиды
Штамм E.coli SM2-1 содержал делецию гена 1-ацил-глицерол-3-фосфат ацилтрансферазы plsC, в результате которой предотвращается синтез фосфатидной кислоты из лизофосфатидной кислоты, что приводит к накоплению последней (Coleman, 1990). Штамм последовательно трансформировали плазмидами pGP1-2 и pT7-5. Плазмида pGP1-2 несла ген Т7 полимеразы, pT7-5 ген пермеазы лактозы LacY под T7 полимеразным промотором, что обеспечило сверхпродукцию пермеазы лактозы. Штамм JF618 использовался в качестве контрольного штамма, однако требовал содержания дополнительного цитозина в среде до 200 мкМ, так как нес мутацию гена pyrG, ответственного за синтез ЦТФ-синтазы.
Культивирование микроорганизмов
Штаммы растили до середины log-фазы на LB (Лурия‒Бертани) среде с ампициллином 100 мкг/мл, с тетрациклином 10 мкг/мл при 30 °С, затем переносили на водяную баню 42 °С на 20 минут (для увеличения синтеза лизофосфатидной кислоты) и подавляли клеточную полимеразу добавлением рифампицина в среду (для преимущественного синтеза плазмидных белков). Для фосфолипидного анализа при инокуляции в среду добавлялся радиоактивный 32Р-фосфат до 10 мкКи/мл.
Анализ фосфолипидов
Анализ проводили методом двумерной тонкослойной хроматографии (ТСХ), которую осуществляли в первом водном нейтральном направлении в системе растворителей хлороформ-метанол-вода (65:25:4) и во втором кислом ацетатном в хлороформ-метанол-уксусная кислота (65:25:10). ТСХ предшествовала стадия выделения фосфолипидов экстракцией в смеси метанол-хлороформ (1:2).
Вестерн-блоттинг мембранных белков
Гомогенизацию клеток E.coli осуществляли с помощью Френч пресса при 1000 psi. Разрушенные клетки осаждали при 5000 об/мин 7 минут, используя ротор Beckman SS-34. После этого часть супернатанта использовали в качестве цитоплазматической фракции, другую часть центрифугировали 45 000 об/мин 45 минут, используя ротор Beckman SW-41. Осадок растворяли в 0,1 М трис-HCl, pH = 8,0, содержащем 10 мМ хлорид магния. Далее проводили электрофорез в полиакриламидном геле в денатурирующих условиях и переносили на нитроцеллюлозную мембрану в течение 2 часов. Далее блокировали 5 % БСА в ТБС (10 мМ трис-HCl, pH = 7,4, 0,9 % NaCl) при 4 °С в течение ночи, отмывали ТБС, содержащим 0,05 % NP-40. Первичные моноклональные и поликлональные антитела против LacY использовали в разведении 1:10 000, поликлональные против OmpF 1:5000. Детекцию сигнала осуществляли с помощью хемилюминесцентной реакции.
Истерн-Вестерн блоттинг
На силикагелевую пластинку размером 10×10 см от Merck наносили в определенном положении раствор фосфолипида (0,001 % лизофосфатидная кислота в смеси хлороформ-метанол-вода – 30 % гидроксид аммония, 120:75:6:2, о/о). Данную область отмечали карандашом и далее осуществляли Истерн-блоттинг, заключающийся в термопереносе липидов с пластины для ТСХ на нитроцеллюлозную мембрану. Высушенную в потоке сухого воздуха пластину помещали в смесь растворителей для переноса (изопропанол – 0,2 % водный хлорид кальция-метанол, 40:20:7, о/о) на 20–30 секунд. Далее помещали смоченную мембрану и 3 мм стекловолоконный фильтровальный лист на пластину и подвергали нагреванию с помощью термоблоттера фирмы ÄKTA при 180 °С в течение 60 секунд и нагревательного блока, толщиной 1,5 инча. Далее мембрану сушили на воздухе. Окунали мембрану в воду для создания иммерсии фосфолипидов на 10 секунд и далее осуществляли обычный Вестерн-блоттинг.
Результаты исследования и их обсуждение
В качестве модели мембранных белков были выбраны пермеаза лактозы LacY и порин OmpF.
В результате двумерной тонкослойной хроматографии (ТСХ) фосфолипидов в нейтральном водном направлении и в кислом ацетатном обнаружили, что исследуемый мутантный по plsC гену штамм имеет повышенное содержание лизофосфатидной кислоты до 6 % по отношению к 0,3 % у штамма JF618 (рис. 1).
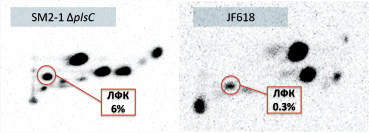
Рис. 1. Двумерная ТСХ 32P-радиомеченых фосфолипидов штаммов E.coli в %. ЛФК – лизофосфатидная кислота
Уровень экспрессии пермеазы лактозы у контрольного штамма JF618 выше, чем у мутантного штамма SM2-1 при сравнительно одинаковом содержании конформационно «правильной» пермеазы лактозы в мембране (рис. 2). Правильную конформацию белка оценили, используя моноклональные антитела к пермеазе лактозе, которые способны связываться с эпитопами белка только при его правильной, нативной конформации. Это может свидетельствовать о том, что увеличенное содержание лизофосфатидной кислоты в мембране приводит к встраиванию белка в мембрану в правильной конформации, тогда как в результате сверхпродукции мембранных белков в норме происходит их встраивание в мембрану вне зависимости от конформации. Участие ЛФК во встраивании белков в мембраны может быть благодаря непосредственному взаимодействию, то есть ЛФК выступает в качестве липидного шаперона, аналогично фосфатидилэтаноламину и инозитолу. Другой вариант участия ЛФК заключается в высвобождении мембранных белков с «неправильной» конформацией в цитоплазматическое пространство в форме мицелл.
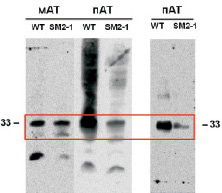
Рис. 2. Вестерн-блоттинг пермеазы лактозы LacY. WT – штамм JF618, мАТ-моноклональные антитела, пАТ – поликлональные антитела. Слева – нанесено 20 мкг белка в лунку, справа – 2 мкг
Методом Вестерн-блоттинга цитоплазматической фракции клеток определили, что количество пермеазы лактозы не отличается у исследуемых штаммов (рис. 3). Однако заметно увеличение другого мембранного белка, порина OmpF в цитоплазме, что может свидетельствовать о миграции избытка мембранного белка в цитоплазму при увеличенном содержании лизофосфатидной кислоты в мембране.
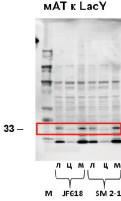
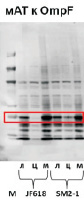
Рис. 3. Вестерн-блоттинг пермеазы лактозы LacY и порина OmpF:М – маркер, л – лизат клеток, ц – цитоплазматическая фракция, м – мембранная фракция
Кроме того, лизофосфатидная кислота не оказывает прямого воздействия на фолдинг и встраивание пермеазы лактозы в нативной конформации, то есть не оказывает функцию липидного шаперона. Присутствие ЛФК на нитроцеллюлозной мембране приводит к уменьшению количества пермеазы, ренатурированной до нативной структуры (рис. 4).
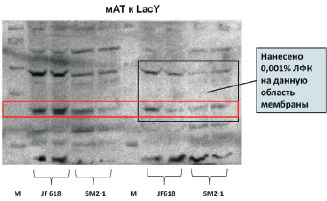
Рис. 4. Истерн-Вестерн блоттинг пермеазы лактозыв присутствии лизофосфатидной кислоты (ЛФК):М – маркер, JF618 и SM2-1 – мембранные фракции клеток данных штаммов
По всей видимости, увеличение лизофосфатидной кислоты в клетках приводит к высвобождению мембранных белков в мицеллах. Увеличение ЛФК в стрессовых условиях может быть необходимо для сохранения нативной конформации мембранных белков, которые «пережидают» неблагоприятное воздействие с сохранением структуры в гидрофильной среде. Либо солюбилизация белков носит случайный характер вследствие увеличения ЛФК в мембране, имеющей одну жирную кислоту, что способствует дестабилизации бислойной структуры мембраны, образованию мицелл и высвобождению фрагментов мембраны в мицеллах. То есть при случайной фрагментации мембраны высвобождение белков в мицеллах может являться не целью, а следствием. Кроме того, встраивание белков в мицеллы может быть необходимо для транспорта мембранных белков (Bond et al., 2004). Вероятно, при стрессовых условиях определенные мембранные белки транспортируются внутри клетки для выполнения некоторых функций.
Заключение
Лизофосфатидная кислота способствует встраиванию белков в мембрану с соблюдением нативной конформации последних. При этом наличие данного фосфолипида в среде при ренатурации пермеазы лактозы не приводит к ее полному восстановлению, что означает отсутствие непосредственного участия ЛФК в фолдинге белка.
Увеличение мембранного белка порина OmpF в цитоплазматической фракции клеток E.coli, содержащих повышенное количество ЛФК в мембране (6 % по отношению к 0,3 % в норме), может происходить вследствие интенсивного образования мицелл. Биологическое значение мицеллообразования в стрессовых условиях, при которых содержание ЛФК возрастает, надлежит дальнейшему изучению. Количество мембранных белков в мицеллах увеличивается, что может являться необходимостью сохранения нативной структуры данных белков, либо с целью транспорта белков для выполнения определенных функций.
Рецензенты:
Абрамова З.И., д.б.н., профессор кафедры биохимии Казанского (Приволжского) федерального университета, г. Казань;
Канарский А.В., д.т.н., профессор кафедры пищевой биотехнологии Казанского национального исследовательского технологического университета, г. Казань.
Работа поступила в редакцию 07.06.2013.



