Неспецифические транспортеры, или порины, грамотрицательных бактерий, в том числе и E.coli, являются основными белками наружной мембраны и образуют каналы для диффузии низкомолекулярных соединений (Achouak и соавт., 2001).
Порины относятся к β-структурированным мембранным белкам, которые в наружных мембранах грамотрицательных бактерий существуют в виде тримеров, устойчивых к действию денатурирующих агентов и протеолитических ферментов (Garavito и Rosenbusch, 1986).
Кардиолипин входит в состав бактериальных мембран и является важным звеном многих биологических процессов, таких как трансляция, транслокация и фолдинг белков, а также энергетический и ионный обмен, являясь структурным и функциональным компонентом многих белковых комплексов (Gold и соавт., 2010).
В настоящее время также существуют данные, полученные in vitro, о том, что анионный дифосфатидилглицерин, или кардиолипин, может принимать участие в работе транслокона SecYEG, необходимого для дальнейшего фолдинга и транспортировки пробелков и поринов к наружной мембране E. coli, в том числе и порина OmpF.
Целью настоящего исследования было изучение роли кардиолипина в сборке и транслокации порина OmpF in vivo.
Материлы и методы исследования
Штаммы
Объектом исследования были выбраны: дикий тип E.сoli W3110, происходящий от штамма К12, и его мутант BKT12 с делециями кардиолипинсинтаз clsA, clsB, clsC, полученный методом трансформации (Klebba и соавт., 1990).
Клетки W3110 и BKT12 были рассеяны из глицеринового столбика на чашки с агаризованной средой Лурия‒Бертани (ЛБ) и выращивались в течение 24 ч при 37 °С, затем инокулированы на жидкую среду ЛБ и выращены до середины лог-фазы при 37 °С и постоянном покачивании 250 rpm до OD600 0.7–1, и осаждены центрифугированием при 5,000 об/мин (ротор JLA-8.1000) 5 минут, осадок клеток хранили при –80 °С (Varma и Jacobsson, 2004).
Экстракция фосфолипидов E.coli
Для определения фосфолипидного состава штаммы выращивали в жидкой среде LB с добавлением радиоактивной метки 32P в конечной концентрации 10 мкКи/мл в течение 18 ч при 30 или 37 °С и постоянном покачивании 250 rpm до стационарной фазы роста. Далее клетки осаждали центрифугированием при 5,000 об/мин (ротор JLA-8.1000) 5 минут и отмывали один раз для удаления избытка радиоактивности буфером 0,1М Трис, 0,7 % K2HPO4, 0,3 % KH2PO4, 0,05 % цитрат натрия, 0,1 % (NH4)2SO4, pH = 7,5.
Экстракцию фосфолипидов из клеток производили по стандартной методике (Varma и Jacobsson, 2004). Экстракт хранили при –20 °С.
Для разделения фосфолипидов использовали систему растворителей хлороформ-метанол-вода-аммиак (60:37,5:3:1). Для активации силикагелевые пластинки (ВЭТСХ силикагель 60, Whatman) выдерживали минуту в 1,2 % борной кислоте в 48 % этаноле. Высушивали 15 минут на воздухе и прокаливали при 190 °С в течение 60 минут. Затем охлаждали в потоке сухого воздуха и наносили образцы на расстоянии 1,5 см от края пластинки, в количестве, равном по степени радиоактивности. ТСХ проводили до достижения линии фронта растворителем 5 мм от края пластинки. Далее высушивали пластинку в потоке сухого воздуха и подвергали экспозиции, используя Phosphor screen от Bio-Rad. Измерение, визуализацию и обработку результатов проводили, используя Molecular Imager® Gel Doc™ XR System и Quantity one software (Bio-Rad).
Экстракция мембранных белков
Экстракцию проводили при 4 °С. Клеток (1 г) были суспендированы в 20 мл холодного буфера (100 мM HEPES, 25 мM MgCl2, 1,1 мM PMSF). Клеточные стенки разрушали French press (Glen Mills, USA) при 8000 psi. Неразрушенные осаждали центрифугированием при 30000 g 20 минут 4 °С (ротор SS-34). Для осаждения мембран супернатант центрифугировали 1 час при 200000 g 4 °C (ротор Beckman Ti 50.2). Осадок ресуспендировали в буфере 10 мM HEPES, 25 мM MgCl2 1,1 мM PMSF. Гомогенат перенесли в микроцентрифужные пробирки по 50 мкл и хранили при –20 °С.
SDS-ПААГ и Вестерн блот
Концентрацию белка определяли методом на бицинкхониевую кислоту (BCA protein assay kit, Pierce). Солюбилизированые 2 % дигитонином образцы мембранных белков смешивали с готовым LSB буфером (Laemmli sample buffer), затем встряхивали 15 минут, инкубировали 15 мин при 37 °С и снова встряхивали 15 минут на вортексе. Центрифугировали 5 минут при 14000 об/мин и супернатант наносили на 4–16 % градиентный ПААГ (Bio-Rad). После разделения белки переносили на нитроцеллюлозную бумагу (Immun-Blot PVDF, Bio-Rad) в буфере 250 мM трис, 1,92 M глицин, 0,2 % SDS, pH 8,3 в течение 1 часа 45 минут 45 В при 4 °С. После переноса мембраны блокировали в течение 18 ч в TBS буфере 10 мM Tris-HCl, 0,9 % NaCl, 5 % БСА, pH 7,4. Мембраны отмывали в TBS буфере, содержащим 0,5 % NP-40, один раз 10 мин и инкубировали 3 часа при покачивании с первичными мышиными антителами против OmpF фрагментов (мономеры и тримеры) наружной мембраны E. coli, любезно предоставленными лабораторией Hiroshi Nikado. Затем 3 раза по 10 минут на качалке отмывали в TBS буфере, содержащем 0,5 % NP-40, инкубировали час со вторичными анти-мышиными антителами, мечеными пероксидазой хрена, отмывали 3 раза по 10 минут в TBS буфере, содержащем 0,5 % NP-40 и один раз в TBS в течение 5 минут, далее проявляли набором для хемюлиминесцентного определения (ECL detection kit, Thermo Sc.). Блоты детектировали с помощью Molecular Imager® Gel Doc™ XR System и Quantity one software (BioRad).
Результаты исследования и их обсуждение
На рис. 1 представлена хроматограмма ТСХ, где подтвердили абсолютное отсутствие кардиолипина в мутантах BKT12 относительно дикого типа W3110 E.coli, следовательно, ввиду отсутствия генов clsA, clsB, clsC и соответственно экспрессии кардиолипинсинтаз в случае BKT12 кардиолипин не может вмешиваться в работу транслокона SecYEG и сборку порина OmpF.
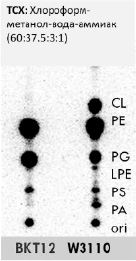
Рис. 1. Одномерная ТСХ 32P-радиомеченых фосфолипидов штаммов E.coli в %:CL – кардиолипин, PE – фосфатидилэтаноламин, PG – фосфатидилглицерин, LPE – лизофосфатидилэтаноламин, PS – фосфатидилсерин, PA – фосфатидная кислота, ori – исходное пятно
Трансмембранный порин OmpF наружной мембраны грамотрицательных бактерий функционирует в виде тримера c молекулярной массой ~100 кДа, тогда как индивидуальный мономер имеет молекулярную массу ~39 кДа (Новикова и соавт., 1993).
Существует предположение, что транслокон SecYEG задействован в фолдинге и доставке пробелков, в том числе и OmpF к наружной мембране для дальнейшей сборки этих поринов (Новикова и соавт., 1993). Также in vitro показано, что кардиолипин может поддерживать функциональную структуру самого транслокона, являясь структурным компонентом, необходимым для его нативной конформации (Tan и соавт., 2012).
Нами проверена экспрессия и наличие тримеров и мономеров порина OmpF в экстракте мембранных белков мутантов BKT12 с отсутствием кардиолпина в сравнении с диким типом W3110 in vivo, где кардиолипин в среднем составляет 5–15 % от всех мембранных фосфолипидов (Klebba и соавт., 1990).
Пространственная организация белков зависит от метода выделения и используемого солюбилизирующего агента и температуры, при которой проводится диссоциация комплекса пептидогликан-порин (Новикова и соавт., 1993). В связи с этим для получения поринов в конформации, максимально приближенной к таковой в наружной мембране, большое значение имеет подбор условий извлечения этих белков из бактерий. Была проведена оптимизация различных методов выделения мембранных белков, был выбран описанный ранее метод выделения и солюбилизации мембранных белков.
На рис. 2 представлен типичный вестерн блот SDS-ПААГ мембранных белков после инкубации с моноклональными мышиными антителами к порину OmpF, выделенными по стандартной методике, после ECL проявления и использования Quantity one software (BioRad).
а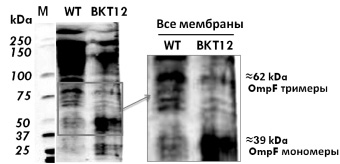 б
б
Рис. 2. Вестерн-блоттинг порина OmpF. WT – штамм W3110
В образцах мембранных белков мутанта BKT12 (рис. 2, А) с делециями всех кардиолипинсинтаз обнаружены только OmpF мономеры в отличие от дикого типа W3110, где присутствует большое количество тримеров и их спонтанных агрегатов, следовательно, мы показали in vivo, что в мутантах в отличие от дикого типа не произошла транслокация и сборка OmpF мономеров в тримеры.
Можно предположить, что из-за отсуттсвия кардиолипина как необходимого структурного элемента и последующего нарушения работы транслокона SecYEG OmpF мономер не принял нужную конформацию для дальнейшего фолдинга и не достиг наружной мембраны E.coli для последующей сборки (рис. 2, б).
Следующим этапом будет исследование активности и стабильности комплекса самого транслокона SecYEG в присутствии и в отсутствии кардиолипина in vivo.
Известно, что особенности структуры поринов и их локализация на поверхности клеток бактерий обусловливает наличие у этой группы белков не только транспортных функций. С одной стороны, порины выступают как эффекторы патогенеза, подавляя защитные реакции организма-хозяина, с другой – они являются высокоиммуногенными компонентами наружной мембраны грамотрицательных бактерий. Антитела к ним обнаруживаются как после вакцинации, так и при естественном развитии инфекции (Achouak и соавт., 2001). Таким образом, уже на данном этапе исследований мутант BKT12 представляет самостоятельный интерес для изучения его биологических свойств, так как возможное отсутствие OmpF тримера во внешней мембране может повлечь за собой изменение иммуногенности и патогенности штамма, так как порины связаны нековалентной связью с нерастворимым слоем пептидогликана, разделяющего наружную и цитоплазматическую мембраны.
Рецензенты:
Абрамова З.И., д.б.н., профессор кафедры биохимии Казанского (Приволжского) федерального университета, г. Казань;
Канарский А.В., д.т.н., профессор кафедры пищевой биотехнологии Казанского национального исследовательского технологического университета, г. Казань.
Работа поступила в редакцию 07.06.2013.



