Гипертензия (ГТ) сосудов является одним из основных риск-факторов развития сердечно-сосудистых и почечных заболеваний. Несмотря на существенный прогресс в понимании патофизиологических механизмов этого явления и широкого арсенала средств коррекции ГТ, основные молекулярные механизмы ГТ изучены недостаточно. ГТ характеризуется величинами диастолического/систолического артериального давления выше 90/140 мм. Hg. К числу фактов, способствующих усилению ГТ, относят ожирение, алкоголь, стрессы, солевую диету и др. [8].
Развитие ГТ чаще всего связывают с усилением вазоконстрикции сосудов [2] и с увеличением входа Са2+ в гладкомышечные клетки через различные каналы, в присутствии агонистов – норадреналина (NE, α -адренорецепторы), ангиотензинаII, эндотелина-1 и др. и (или) с дисфункцией эндотелия и недостаточной продукцией ими факторов релаксации мышечных клеток сосудов – NO, H2O2, CO и производных арахидоновой кислоты (АА) при действии ацетилхолина (Ach), брадикинина, NE (β – адренорецепторы) и др. [15].
Одним из важных показателей «нормального» состояния сосудистой системы является ритмическая активность сосудов, регистрируемая как Са2+ колебания и волныв изолированных клетках гладких мышц [4] и эндотелия [3]; колебания силы сокращений сосудистых препаратов (препараты мышечных клеток и эндотелия сосудов) invitro [6], ритмические сокращения и волны, возникающие в сосудах invivo (регистрируемые с использованием методов лазерного или ультразвукового сканирования) [11]. Наличие таких автономных (эндогенных) периодических ритмов обычно связывают с наличием генератора колебаний в PLC/IP3/IP3-рецептор (IP3R)/Ca2+-сигнальном пути клеток [6,11], реже – в системе Са2+ сигнализации с участием NO/cGMP/cADPr [4]. В условиях ГТ наблюдаемое ритмическое разнообразие утрачивается [6,11], поэтому анализ механизмов генерации периодических режимов в таких системах может быть важным инструментом при анализе механизмов дисрегуляции различных Са2+-сигнальных систем мышечных клеток и эндотелия и дисфункции сосудистой системы при ГТ. В качестве модели ГТ нами взяты спонтанно-гипертензивные крысы (SHR) линии Вистар-Киото (WKY).Ниже приведены результаты начального этапа сравнительных исследований сосудистых образцов и папиллярных мышц миокарда здоровых животных и животных с ГТ.
Материалы и методы исследования
В экспериментах использовали здоровых крыс линии WKY в возрасте 2–3 месяца и 10 месяцев, а также крыс с ГТ SHR в возрасте 10 месяцев. Показателями ГТ у животных SHRсчитали: устойчивое наличие высокого артериального давления в интервале 200–230 mmHg, регистрируемого с помощью прибора NicoleitML-105 с капсулой Марра.
Половина животных из группы SHR (6 животных) получала с питьевой водой многокомпонентный состав гепатопротектора – БАД «Хелпер-1» («Х-1») из расчета 1,5 г/1 кг веса в день в течение 4 недель. Перед декапитацией животных использовали эфирный наркоз, затем быстро извлекали сердце и препараты аорты и помещали в аэрированные растворы Тироде. Исследования сократимости миокарда проводились на папиллярных мышцах (ПМ) правого желудочка сердца при температуре 30 ± 1 °С.
Выделение папиллярных мышц (ПМ), стимуляцию и измерение амплитуды сокращения в изометрическом режиме проводили по ранее описанной методике [10]. Механическая активность мышц регистрировалась с помощью механотрона 6Х-2М и автоматизированной установки на основе РС и плат АЦП-ЦАП (L-Сard 154 и L-Card E14-440). Исследование механических свойств сосудистой системы проводили на кольцевых сегментах (длина 3–3,5 мм) грудной аорты по описанной ранее методике. Состав раствора Тироде для колец аорты (в моль/литр): Na + 150,0; K + 4,0; Mg2 + 1.0; Cа2 + 2,0; HCO3– 12,0; HPO4– 1,8; Сl– 148,4; глюкоза 11,0; pH = 7,4). Регистрацию силы изометрического сокращения проводили с помощью механотрона 6Х2М на ПК и Linerecorder TZ 4221 (Чехия) при температуре раствора 20 °С. В работе использовались реагенты (в т.ч. агонисты и ингибиторы) TOCRIS bioscience.
Результаты исследования и их обсуждение
Сравнительное исследование на папиллярных мышцах. Большинство патологий сердца сопряжено с перегрузкой клеток по кальцию. Саркоплазматический ретикулум (СР) является одной из ключевых структур кардиомиоцитов, отвечающих за внутриклеточный гомеостаз Са2 + и сократительный резерв [1, 9].
Для оценки роли СР в регуляции сократительной активности миокарда крыс использовался эффект потенциации паузой («эффект паузы»), который описан в методике. Во время интервала покоя внеклеточный Са2+ продолжает поступать в клетку и аккумулироваться в СР, в результате чего при первом после паузы сокращении в цитоплазму (а не в саркоплазму) высвобождается значительно большее количество кальция, чем при ритмическом сокращении. «Эффект паузы» выражен в миокарде с хорошо развитым СР. В миокарде с ослабленной функцией СР (при патологических состояниях) – эффект потенциации паузой значительно снижен [1, 9].
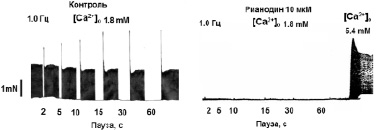
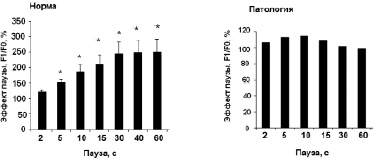
На рис. 1, а приведен пример регистрации «эффекта паузы» в сердце здоровой крысы WKY – имеет место позитивное влияние длительности паузы t (с) на амплитуду силы сокращений первого после паузы ответа (F1). «Эффект паузы» полностью подавляется рианодином – блокатором Са2+-каналов саркоплазматического ретикулума (СР) (рис. 1, б). Таким образом, амплитуда (F1) первого сокращения после паузы определяется емкостью кальциевого пула СР сердечной клетки. Из данных, представленных на рис. 1, в, г видно, что эффект паузы практически отсутствует у крыс SHR, что свидетельствует о нарушении функционирования системы поддержания Са2+ гомеостаза на уровне CP. Эти данные согласуются с результатами других авторов [13]. Судя по предварительным данным, после проведенного приема «Х-1» величина «эффекта паузы»изменяется у крыс SHR и становится подобной характеристике, регистрируемой у здоровых животных (рис. 1, в), что может свидетельствовать о нормализации процессов регуляции кальциевого гомеостаза на уровне СР у крыс SHR.
 б
б
 г
г
Рис. 1. Эффект паузы как качественный показатель содержания Са2+ в саркоплазматическом ретикулуме: А – типичный пример регистрации «эффекта паузы» в сердце крысы WKY (10 месяцев) на частоте стимуляции 1,0 Гц; Б – подавление эффекта паузы рианодином. Сокращения восстанавливаются только при повышении концентрации Са2+ в составе перфузирующего раствора до 5,4 мМ; В, Г – сравнительная картина эффекта паузы в ПМ крысы WKY (В) и SHR (Г). * – достоверность отличия потенцирующего эффекта паузы от его величины при длительности паузы 2 с (p < 0,05)
Сила сокращений F(f), развиваемая полосками папиллярных мышц крыс SHR, в 3–4 раза ниже силы сокращений, развиваемых здоровыми животными. Ниспадающие кривые зависимости силы F от частоты стимуляции f – F(f) наблюдаются у здоровых животных при низких частотах стимуляции и при увеличении f может иметь место рост силы F с увеличением частоты стимуляции f (не показано). Обычно такой рост F при физиологических частотах стимуляции связан с ростом Са2+i в миокардиоцитах объясняется активацией выброса Са2+ из рианодинового рецептора (RyR) при его фосфорилировании CaMKII [5]. В условиях гипертрофии и недостаточности миокарда [1, 9, 7] избыточное фосфорилирование RyR с участием PKA или CaMK II [12] может переводить канал в полуоткрытое состояние с ростом уровня Саi в покое (в диастоле) с нарушением формы характерных для здоровых животных зависимостей F(f). У крыс SHR форма зависимости F(f) существенно меняется. При малых частотах стимуляции f сила сокращений F почти не зависит от f, а при физиологических частотах стимуляции (f > 1 гЦ) сила сокращений F незначительно уменьшается с ростом f (не показано). У крыс SHR, принимавших «Х-1», кривая зависимости F(f) имеет отрицательный наклон, однако рост силы сокращений при больших частотах стимуляции не восстанавливается (не показано). Учитывая положительные изменения эффекта паузы, можно говорить лишь о частичном улучшении сократительных функций миокарда при введении препарата «Х-1». В состав «Х-1» входят: L-карнитин, который может улучшать сократительную функцию мышц и снижать окислительный стресс при диабете 2 типа, а также L-аргинин – источник синтеза NO.
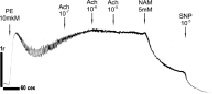
Сравнительные исследования на препаратах аорты. На рис. 2 представлены данные записей силы сокращений (сила F) образцов кольца аорты здоровых животных WKY в возрасте 3 месяца (рис. 2, а) и 10 месяцев (рис. 2, б, в), а также крыс SHR, получавших чистую питьевую воду (рис. 2, г) и воду, содержащую состав «Х-1» (рис. 2, е).
 б
б 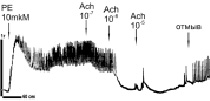
 г
г 

Рис. 2. Влияние PE и Ach на сокращение колец аорты здоровых крыс WKY в возрасте 3 месяцев (а) и 10 месяцев (б, в) и крыс SHR, не принимавших (г) и принимавших (Д) многокомпонентный состав «Х-1». Пояснение в тексте
Из рис. 2, а видно, что сокращение кольца аорты, вызванное PE, сопряжено с ритмическими изменениями величины F (с периодом 1–5 с). Аппликация Ach приводит к полному расслаблению образцов аорты с последующей генерацией медленных (период более 30 с) колебаний силы сокращений F высокой амплитуды. Генерация быстрых колебаний F обычно наблюдается в различных типах сосудов при аппликации NE, Ach и др. и объясняется наличием генератора колебаний в Са2+-сигнальной системе с участием PLC/IP3/IP3 рецептора [6, 11]. Медленные колебания F большой амплитуды (рис. 2, а) зарегистрированы впервые. У здоровых животных в возрасте 10 месяцев (рис. 2, б) наблюдаются только быстрые колебания F как при действии PE, так и при отмывке Ach. Cам по себе Ach, вызывающий эффективное расслабление колец аорты, не приводит к генерации колебаний F в этих условиях. У животных этого возраста (так же как и у молодых животных) введение ингибитора NO-синтаз (NOS) – L-NAME приводит к подавлению расслабляющего эффекта Аch. Считается, что Ach может вызывать расслабление сосудов, обеспечивая генерацию факторов релаксации – NO, H2O2, а также производных АА [15]. Слабое увеличение силы сокращений F при последовательных добавках Ach может быть связано в этих условиях с малым вкладом метаболитов АА в расслабляющий эффект Ach, поскольку последующие добавки донора NOSNP приводят к полному расслаблению колец аорты (Рис. 1В). Считается, что NO в этих условиях активирует PKG по цепочке NO/cGMP/PKG, обеспечивая активацию K+-каналов, гиперполяризацию и расслабление миоцитов [15].
Ранее нами было показано[14], что автокаталитический Са2+-сигнальный путь:
Ca2+/NOS/NO/sGC/cGMP/PKG/CD38/cADPr/RyR/Ca2+ (1)
играет важную роль в регуляции уровней Са2+, NO и активности PKG и RyR в адипоцитах и может быть источником Ca2+ и NO колебаний и волн в этих и других типах клеток.
По нашему мнению, активация PKG в цепочке (1) должна также способствовать расслаблению миоцитов за счет уменьшения уровня Са2+i при активации SERCA и PMCA, с одновременным ингибированием различных Са2+-каналов с участием PKG, как это имеет место в адипоцитах [14].
В препаратах аорты, выделенных из животных с ГТ (крысы SHR), добавки Achне приводят к расслаблению колец аорты, вызванных PE (рис. 2, г), подобно тому, как это имеет место у контрольных животных при введении блокатора NOSL-NAME (рис. 2, в). Последующее введение донора NOSNP приводит к полному расслаблению колец (рис. 2, г), что свидетельствует о дисфункции автокаталитического Ca2+/NO-сигнального пути эндотелия (1), связанной с низкой активностью еNOS [15] или с низким уровнем Са2+ (активатора eNOS) в эндотелиальных клетках. Введение в этих условиях вместо SNP, продукта ADP рибозилциклазы (или CD38) – никотинамида (NAM, рис. 1, г) также приводят полному расслаблению миоцитов аорты. Ингибируя ADP рибозилциклазу, NAM приводит к уменьшению концентрации продукта этой реакции c ADP ribose в миоцитах, являющегося активатором RyR. Это приводит в свою очередь к полному блокированию сигнальной цепочки (1), к подавлению выброса Са22+ из RyR-зависимых Са22+ депо и к расслаблению миоцитов. Последующие добавки донора NOSNP усиливают расслабляющий эффект NAM (рис. 2, г), по-видимому, за счет накопления c GMP и активации PKG. В отличие от клеток сердечной мышцы прием состава «Х-1» не приводит к улучшению сократительных функций миоцитов аорты или к снятию дисфункции эндотелия у крыс SHR (рис. 2, д).
Заключение
Неспособность Ach обеспечивать расслабление препаратов аорты крыс SHR может быть связана с дисфункцией Са2+/NOS/NO/sGS/cGMP/PKG/CD38/cADPr/RyR/Ca2+-сигнального пути клеток эндотелия и миоцитов аорты.
Работа выполнена при финансовой поддержке Президиума РАН (ФНМ, проект № 01201256033); грант РФФИ № 13-04-01234-а.
Рецензенты:
Асланиди К.Б., д.ф.-м.н., ведущий научный сотрудник, Лаборатория биофизики внутриклеточной регуляции, Учреждения Российской академии наук Института теоретической и экспериментальной биофизики РАН, г. Пущино;
Маевский Е.И., д.м.н., профессор, зам. директора Учреждения Российской академии наук Института теоретической и экспериментальной биофизики РАН, г. Пущино.
Работа поступила в редакцию 03.06.2013.



